
Metod_Medical_chem_1_Stomat
.pdf3)до 2-3 мл розчину солей цинку, мангану, хрому і феруму додати сірководневої води. Спостерігати утворення осадів, відмітити їх колір і скласти рівняння відповідних реакцій.
IV. Узагальнення результатів практичної роботи і залік теми.
Заняття № 8
Тема: Термодинамічні та кінетичні закономірності перебігу біохімічних процесів
Значення матеріалу теми. Більшість хімічних процесів супроводжуються помітним виділенням або вбиранням енергії у вигляді теплоти, що пояснюється руйнуванням одних хімічних зв’язків і утворенням інших. Розділ хімії, в якому вивчаються теплові ефекти (енергетика) хімічних реакцій, називають термохімією. Дані з енергетики використовують для оцінки стабільності хімічних сполук, енергетичної вартості різних видів палива, калорійності харчових продуктів, а також для встановлення напрямленості чи то можливості протікання хімічних та біохімічних реакцій.
Хімічна кінетика пов’язана з механізмами хімічних реакцій, які відбуваються в різних умовах, у тому числі в живих тканинах та біологічних рідинах. Проте біохімічні процеси в організмі досить складні і обумовлені багатьма факторами, зокрема ферментами. Дія багатьох ліків іноді також підлягає кінетичним закономірностям і зводиться до блокування активних центрів ферментів макрочи мікроорганізмів.
Мета заняття. Вивчити основні поняття та закони термохімії. Навчитись проводити термохімічні розрахунки для оцінки калорійності харчових продуктів і визначати теплові ефекти хімічних реакцій і процесів.
Навчитись визначати експериментально константи швидкості хімічних реакцій та використовувати їх для характеристики хімічних процесів.
Форма заняття: семінарсько-лабораторне.
Домашня підготовка до заняття
І. Засвоїти основний матеріал навчальної програми.
Предмет хімічної термодинаміки. Основні поняття хімічної термодинаміки: термодинамічна система (ізольована, закрита, відкрита, гомогенна, гетерогенна), параметри стану (екстенсивні, інтенсивні), термодинамічний процес (оборотний, необоротний). Живі організми – відкриті термодинамічні системи. Необоротність процесів життєдіяльності.
41
Перший закон термодинаміки. Ентальпія. Термохімічні рівняння. Стандартні теплоти утворення та згорання. Закон Гесса. Метод калориметрії. Енергетична характеристика біохімічних процесів. Термохімічні розрахунки для оцінки калорійності продуктів харчування та складання раціональних та лікувальних дієт.
Самодовільні і несамодовільні процеси. Другий закон термодинаміки. Ентропія. Термодинамічні потенціали: енергія Гіббса, енергія Гельмгольца. Термодинамічні умови рівноваги. Критерії направленості самодовільних процесів.
Застосування основних положень термодинаміки до живих організмів. АТФ як джерело енергії для біохімічних реакцій. Макроергічні сполуки. Енергетичні супряження в живих системах: екзергонічні та ендергонічні процеси в організмі.
Хімічна кінетика як основа для вивчення швидкостей та механізму біохімічних реакцій. Швидкість реакції. Залежність швидкості реакції від концентрації. Закон діючих мас для швидкості реакції. Константа швидкості. Порядок реакції. Кінетичні рівняння реакцій першого, другого та нульового порядку. Період напівперетворення - кількісна характеристика зміни концентрації в довкіллі радіонуклідів, пестицидів тощо. Поняття про механізм реакції. Молекулярність реакції.
Залежність швидкості реакції від температури. Правило Вант-Гоффа. Особливості температурного коефіцієнту швидкості реакції для біохімічних процесів.
Енергія активації. Теорія активних співударів. Рівняння Арреніуса. Поняття про теорію перехідного стану (активованого комплексу).
Уявлення про кінетику складних реакцій: паралельних, послідовних, супряжених, оборотних, ланцюгових. Поняття про антиоксиданти. Вільнорадикальні реакції в живому організмі. Фотохімічні реакції, фотосинтез.
Каталіз та каталізатори. Особливості дії каталізаторів. Гомогенний, гетерогенний та мікрогетерогенний каталіз. Кислотно-основний каталіз. Автокаталіз. Механізм дії каталізаторів. Промотори та каталітичні отрути.
Уявлення про кінетику ферментативних реакцій. Ферменти як біологічні каталізатори.
Особливості дії ферментів: селективність, ефективність, залежність ферментативної дії від температури та реакції середовища.
Хімічна рівновага. Константа хімічної рівноваги та способи її виразу. Зміщення хімічної рівноваги при зміні температури, тиску, концентрації речовин. Принцип Ле Шательє.
42
Реакції осадження та розчинення. Добуток розчинності. Умови випадання та розчинення осадів. Роль гетерогенної рівноваги за участю солей в загальному гомеостазі організму.
ІІ. Дати відповіді на контрольні запитання.
1.Опишіть суть основних понять термодинаміки: система, фаза, компонент, параметр, функція стану. Вкажіть різницю між ізольованими, відкритими і закритими системами.
2.Що таке ентальпія, стандартна ентальпія, ентальпія утворення і згоряння речовин?
3.Напишіть формулювання закону Гесса. Як проілюструвати його ентальпійною діаграмою?
4.Що характеризує теплота розчинення і теплота гідратації?
5.Напишіть математичний вираз і декілька формулювань другого закону термодинаміки. Чи можна застосувати цей закон до біологічних систем?
6.Дайте визначення ентропії, вільної енергії Гіббса і Гельмгольца. Який фізичний зміст цих термодинамічних функцій?
7.Напишіть математичний вираз об’єднаного закону хімічної термодинаміки і вкажіть, що характеризують ентальпійний і ентропійний чинники.
8.Яку роль відіграє АТФ у процесах перетворення енергії і біосистемах? Напишіть термохімічне рівняння реакції гідролізу АТФ.
9.Що вивчає біоенергетика? Вкажіть особливості живих систем з точки зору термодинаміки.
10.Залежність швидкості хімічних реакцій від концентрації. Закон діючих мас.
11.Фізичний зміст константи швикості реакцій. Рівняння констант швидкості І-го, ІІ-го та нульового порядків. Одиниці їх вимірювання.
12.Пояснити фізичний зміст понять: молекулярність і порядок реакцій. Псевдомономолекулярні реакції (навести приклади).
13.Період напівперетворення реакції і його рівняння для реакцій І-го та ІІ-го порядків. За рівняннями якого порядку відбувається перебіг псевдомономолекулярних реакцій та реакцій радіоактивного розпаду?
14.Що таке енергія активації молекул? Рівняння Ареніуса. Які є способи активації молекул?
15.Який механізм дії каталізаторів при гомота гетерогенному каталізах? Ферментативний каталіз і його особливості. Рівняння Міхаеліса-Ментен.
43
ІІІ. Розв’ язати задачі
а) Алгоритми розв’ язування типових задач
Задача 1. Обчислити тепловий ефект реакції утворення сечовини з аміаку і діоксиду карбону за стандартних умов.
Алгоритм розв’язування 1.Запишемо рівняння реакції, вказавши агрегатні стани реагентів та продуктів
реакції і значення відповідних стандартних ентальпій утворення (з таблиць) під формулою сполуки:
|
|
2NH3 (г ) + CO2 (г ) ® (NH2)2CO (к ) + H2O (г ) + DHр |
||
|
кДж |
|
|
|
DH ° |
|
–46,2 –393,5 |
–333,0 |
– 285,8 |
|
||||
|
моль |
|
|
|
2.Підставимо значення стандартних ентальпій утворення вихідних (вих.) речовин і продуктів (прод.) реакції у формулу для визначення теплового ефекту (ентальпії) реакції, враховуючи стехіометричні коефіцієнти:
DHр=SDH°прод..– SDH°вих..
DHр= –333,0 – 285,8 –(2 ×(–46,2) – 393,5) |
= –132,9 кДж |
2.Запишемо термохімічне рівняння: |
|
2NH3(г ) + CO2 (г) ® (NH2)2CO(к ) + H2O (p); |
DHр = –132,9 кДж |
Задача 2. Дієта при цукровому діабеті обмежує вміст у їжі вуглеводів до 50 % при збереженні фізіологічної норми жирів та білків. Обчислити калорійність цієї дієти.
Алгоритм ров’язування
1.Знаючи добову потребу у вуглеводах, знаходимо пропоновану при захворюванні масу вуглеводів :
m= 385 × 0,5 = 192,5 г
2.Обчислюємо калорійність дієтичної норми DH°згор., виходячи з добової потреби і теплот окиснення харчових продуктів в умовах фізіологічного середовища:
DH°згор. = 192,5 × 19,8 + 100 × 37,8 + 16,8 × 80 = 8935,5 (кДж)
Відповідь: калорійність дієти становить 8935,5 кДж.
Задача 3. Обчислити зміну ентропії в реакції
CO2 + 2 Н2  СН3ОН за стандартних умов
СН3ОН за стандартних умов
Алгоритм розв’язування
1.Запишемо термохімічне рівняння даної реакції, вказавши агрегатні стани реагуючих речовин і стандартні ентропії (з таблиць) під формулами речовин.
44
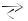
0 |
|
CO2 (г) |
|
2H2 (г) |
|
CH3OH(р) |
||
S 298 (Дж/моль×К) |
|
+ |
|
|
|
|
|
|
213,6 |
2×130,6 |
|
126.7 |
|
||||
2. Записуємо формулу для обчислення |
реакції і підставляємо значення: |
|||||||
|
DS0р = ∑n ×S(0прод) |
- ∑ n'× S(0вих) |
||||||
DS р |
= 126,7 - (213,6 + 2 ×130,6) = -348,1( Дж / моль× К) |
|||||||
Відповідь: DS 0р |
» – 0,35 кДж/моль×К, |
DS p < 0 , – |
реакція за стандартних |
|||||
умов неможлива. |
|
|
|
|
|
|
||
Задача 4. Чи може за стандартних умов відбуватись реакція окиснення фтороводню киснем?
Алгоритм розв’язування.
1.Запишемо ймовірне рівняння реакції, вказавши агрегатні стани реагуючих речовин:
2HF(г) + 1/2O2 (г) → F2(г) + Н2О(р)
2.Вирахуємо зміну енергії Гіббса в реакції, використовуючи табличні значення стандартних ізобарно-ізотермічних потенціалів речовин DG0298
DG р = ∑n × DG(0прод) |
- n / × ∑DG(0вих) |
|
2HF(г) + 1/2O2 (г) → F2(г) + Н2О(г) |
||
DG0298 кДж/моль –272,8 0 |
0 |
–228,6 |
DG0р= –228,6 – 2 × (–272,8) = 317 ( кДж).
Робимо висновок: дана реакція за стандартних умов не може відбуватись, тому що DG0р > 0
Задача 5. Розрахувати енергію активації, якщо константа швидкості цієї реакції при 273 К і 280 К дорівнює відповідно 4,04· 10–5 с–1 та
7,72·10 с–1 . R = 8,314 Дж/(моль·К).
Алгоритм розв’язання.
1.Записуємо об’єднане рівняння, що характеризує залежність швидкості реакції від температури, виходячи з рівняння Ареніуса:
|
ln K = ln K0 - |
|
E |
|
|
|
|||||
|
|
RT |
|
||||||||
|
|
|
|
|
|
|
|
|
|||
|
K |
T2 |
|
Eакт |
|
1 |
|
|
1 |
|
|
ln |
|
= |
|
|
- |
|
|||||
KT1 |
R |
|
T1 |
|
|
|
|||||
|
|
|
|
T2 |
|||||||
45

2.Розраховуємо з рівняння Еакт., замінивши натуральний логарифм на десятковий:
Eакт = lg |
KT |
|
2,303 × R |
|
= lg |
7,72 ×10−5 |
× |
2,303 ×8,314 |
= |
||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
KT |
|
|
1 |
1 |
|
|
4,04 ×10−5 |
|
1 |
|
1 |
||||||
|
|
|
|
|
|
|
|||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
T |
- T |
|
|
|
273 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
280 |
|
||||||
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
= 58753 Дж/моль = 58,75 кДж/моль
Задача 2. Взято 5 мг радію С, період напівперетворення якого становить 19,7 хв. Яка кількість радію С залишиться через 2,5 год
(150 хв.)?
Алгоритм розв’язання.
Період напівперетворення – це час, за який розпадається половина взятої речовини. Рівняння швидкості радіоактивного розпаду будь-якого радіоізотопу має перший порядок.
|
|
|
K = |
2,303 |
lg |
N0 |
|
||
|
|
|
|
t |
Ni |
||||
|
|
|
|
|
|
|
|||
де |
К |
– |
константа швидкості І-го порядку; |
||||||
|
t |
– |
проміжок часу, за який проводиться вимір розпаду, |
||||||
N0, Ni |
– |
вихідна кількість та число ядер, що не розпалось за |
|||||||
|
|
|
проміжок часу t. |
|
|
|
|
|
|
Між константою швидкості К і періодом напівперетворення |
|||||||||
залежність: |
|
|
|
|
|
|
|
||
|
|
|
K = |
0,693 |
|
||||
|
|
|
t1/ 2 |
||||||
|
|
|
|
|
|||||
де t1/2 – |
час напівперетворення. |
|
|
|
|
|
|
||
З двох рівнянь (І) і (II) знаходимо: |
|
|
|
|
|||||
t = 3,32 × t1/ 2 ×lg N0 Ni
Проводимо розрахунок задачі:
|
|
|
150 = 3,32 × t1/ 2 lg |
N0 |
|
, звідки: |
|||||
|
|
|
Ni |
||||||||
|
|
|
|
|
|
|
|
|
|||
lg |
N0 |
= |
150 |
|
= 2,29 |
; |
N0 |
= ant lg 2,29 = 195,0 |
|||
|
3,32 ×19,7 |
|
|||||||||
|
Ni |
|
|
|
|
Ni |
|
||||
|
|
|
|
N = |
5 |
=0,0256 мг. |
|||||
|
|
|
|
|
|||||||
|
|
|
|
|
i |
195 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(I),
iснує
(II),
(III).
46

Задача 6. Визначити середнє значення константи швидкості першого порядку розкладу Н2О2, якщо на титрування однакових об’ємів реакційної суміші витрачено такі об’єми розчину КМnО4:
t – |
час відбору проб, хв. |
0 |
10 |
20 |
30 |
V – |
об’єм КМnO4 , см3 |
21,6 |
12,4 |
7,2 |
4,1 |
Алгоритм розв’язання.
2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2- + 8H2O
Початкова концентрація C0=21,6 см3, концентрації для відповідних моментів часу: 12,4; 7,2; 4,1 см3. За рівнянням константи швидкості реакції першого порядку:
K = 2,303 ×lg C0 t CX
обчислюємо величини К для даних проміжків часу:
K |
= |
|
|
2,303 |
×lg |
21,6 |
= 0,055 хв–1 ; |
||||||||
|
|
|
|
|
|||||||||||
1 |
10 |
12,4 |
|
|
|||||||||||
|
|
|
|||||||||||||
K2 = |
2,303 |
|
×lg |
21,6 |
|
= 0,0550 хв–1 ; |
|||||||||
|
|
|
|
||||||||||||
|
20 |
7,2 |
|
|
|
|
|||||||||
K3 |
= |
2,303 |
×lg |
21,6 |
= 0,0554 хв–1 . |
||||||||||
|
|
||||||||||||||
|
30 |
4,1 |
|
|
|
|
|||||||||
Знаходимо |
|
|
|
Ксер. |
= |
К1 + К2 + К3 |
= 0,0553 хв–1 |
||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
3 |
|
|||||||||
Задача 7. Речовина А введена в реакцію з речовиною В різ-них концентрацій (С0=1 моль/л). Через 1000 с залишилось 50 % речовини А. Скільки речовини А залищиться через 2000 с, якщо реакція має другий порядок ?
Алгоритм розв’язання.
Період напівперетворення для реакції ІІ порядку становить:
|
|
|
|
t1/ 2 = |
1 |
, |
звідси |
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
KIICo |
|
|
|||
KII = |
1 |
= |
1 |
|
|
= 10−3 |
л/(моль·с) |
|||||
|
|
|
|
|
|
|
||||||
|
t1/ 2 ×C0 |
1000 ×1 |
||||||||||
|
|
|
|
|
|
|
||||||
KII |
= |
|
|
CX |
|
|
|
; КІІ ·t·C0·(C0 – C X) = CX |
||||
t |
|
|
|
|
|
|||||||
|
|
×C0 (C0 - CX ) |
|
|
||||||||
|
|
|
|
10–3 ·2000·1·(1 – C ) = C |
||||||||
|
|
|
|
|
|
|
|
|
|
|
X |
X |
CX = 2/3 = 0,666 або 66,6 %.
47
Отже, через 2000 с у реакційній суміші залишилось (100–66,6)=33,4 % речовини А.
б) Задачі для самостійного розв’ язання
1.Вирахувати тепловий ефект реакції повного окиснення глюкози в організмі, використовуючи стандартні ентальпії утворення речовин. Відповідь: Hр. = –2802,8 кДж
2.При згорянні фосфіну РН3 виділяється 2360,8 кДж теплоти. Обчислити ентальпію утворення фосфіну.
Відповідь: Н0 утв(РН3) = 5,4 кДж/моль
3.Обчислити зміну ентропії в реакціях:
а) 2NH3(г) + H2SO4(р) = (NH4)2SO4(к);
б) 2С(гр.) + СО2(г) = 2СО(г).
Відповідь: а) –322,2 е.о. б) 175,6 е.о.
4.Знайти зміну енергії Гіббса наведених реакцій і визначити чи можливі вони для стандартних умов:
а) SO2(г) + 2 H2S(г) = 3S(т) + 2 H2O(р);
б) Cl2 + 2H2O(г) = 4HCl(г) + O2
Відповідь: а) –106,8 кДж, реакція можлива; б) 76,4 кДж, реакція за стандартних умов неможлива.
5.Реакція А + В = С є другого порядку. За 500 с реакція при однакових концентраціях реагучих речовин проходить на 20 %. За який час реакція пройде на 60 % ?
Відповідь: 3000 с.
6.Розрахувати енергію активації розкладу диоксиду азоту 2NО2=2NО+О2, якщо константа швидкості цієї реакції при 600 К і 640 К відповідно дорівнює 83,3 і 407,0 л·моль–1 ·с–1 .
Відповідь: 126,06 кДж/моль
7.Під час вичення радіоактивного забруднення було встановлено, що від 1,000 г стронцію-90 через 2 роки залишилось 0,953 г. Визначити:
а) період напівперетворення стронцію-90; б) скільки стронцію-90 залишиться через 5 років ?
Відповідь: 28,8 роки; 0,885 г.
8.Реакція розкладу пероксиду водню у воді проходить за першим порядком. Період напівперетворення становить 15,86 хв. За який час розкладеться 99
% Н2О2 ?
Відповідь: 105,4 хв.
48

9. При поляриметричному дослідженні кінетики реакції інверсії сахарози
отримано такі дані: |
|
|
|
|
час від початку реакції, хв |
0 |
30 |
40 |
∞ |
визначений кут, град |
37,2 |
31,5 |
29,8 |
–11,7 |
Визначити середнє значення константи швидкості та період напівперетворення реакції.
Відповідь: К= 4,12·10–3 хв–1 , t1/2=168.3 хв.
ЛІТЕРАТУРА
1.А.С.Мороз, А.Г.Ковальова, Фізична та колоїдна хімія, Львів; Світ, 1994,
гл.1, с. 5-17.
2.Л.П.Садовничая с соавт. Биофизическая химия. К., Вища школа, 1986, с. 21-37.
3.Ахметов. Общая и неорганическая химия. М., Вища школа, 1981, с.158172.
4.Р.Чанг, Физическая химия с приложением к биологическим системам. М.,
Мир, 1980, с. 289-320..
Зміст та методика проведення заняття
І. Уточнення і пояснення незрозумілих питань теми.. ІІ. Розв’язування типових задач.
ІІІ. Пояснення методики виконання лабораторної роботи (кожен студент виконує один із описаних дослідів).
ІV. Лабораторна робота. Визначення теплових ефектів хімічних реакцій.
Завдання 1. Визначення ентальпії нейтралізації сильної основи сильною кислотою.
Зважити на технічних терезах калориметричну посудину (внутрішню), влити у неї 150 мл 1 н розчину КОН, виміряти температуру розчину з точністю до 0,1 оС. Відміряти мірним циліндром 150 мл 1 н розчину НСl або НNОЗ. Розчин кислоти влити у колориметричну посудину, перемішати і виміряти максимальну температуру. Обчислити кількість теплоти, яка виділилась при реакції за формулою:
DQ = (mp × CP + mc × Cc) × Dt
де mp і mc – маса розчину і калориметричної посудини, Ср i Cc – питома теплоємність розчину (4,18 Дж/(г×град)) і скла (0,75 Дж/(г×град)). Густину розчинів кислоти і лугу знайти в таблиці. За теплотою реакції визначити теплоту нейтралізації кислоти в розрахунку на її еквівалент:
DHнейтр.= – DQ E [Дж]
m
49

де Е – моль-еквівалент кислоти; m – маса 100 % кислоти у грамах. Порівняти експериментальне і теоретичне значення теплот нейтралізації, враховуючи що DHтеор= –57,2 кДж. Визначити відносну похибку досліду (у %).
Завдання 2. Визначення ентальпії нейтралізації слабкої основи слабкою кислотою.
Провести дослід, який описаний вище, використовуючи замість КОН –
1 н. розчин NH4ОН, а замість НСl – 1 н. СН3СООН. Розрахувати DНтеор по теплотах утворення речовин і визначити відносну похибку. Порівняйте
результати з результатами попереднього досліду і дайте теоретичне пояснення.
Завдання 3. Визначення ентальпії розчинення і гідратації сульфату купруму. Дослід проводять в калориметрі. У попередньо зважену калориметричну посудину наливають 300 мл дистильованої води і вимірюють її температуру з точністю до 0,1 оС. Зважують приблизно 8 г безводного (попередньо прожареного) сульфату купруму з точністю до 0,01 г. Швидко всипають сіль у калориметричну посудину, перемішують розчин мішалкою і відмічають найвищу температуру розчину. Розрахувати кількість теплоти DQ, яка
виділилася в процесі розчинення за формулою:
DQ = (mp × CP + mc × Cc) × Dt
де mp і mc – маса розчину і калориметричної посудини, Ср i Cc – питома теплоємність розчину (4,18 Дж/(г×град)) і скла (0,75 Дж/(г×град)). Перерахувати одержане значення на 1 моль CuSO4 за формулою :
DH2 = DQ M , m
де М – молярна маса CuSO4 (160 г/моль), m – маса речовини в грамах. Аналогічно проводять дослід і розрахунки для кристалогідрату сульфату купруму CuSO4·5H2O, використовуючи наважку купоросу біля 10 г. За знайденими теплотами розчинення CuSO4 – DН1 і його кристалогідрату – DН2, вирахувати теплоту гідратації солі на основі закону Гесса.
За одержаними експериментальними даними і теоретичним значенням DНгідр= –77,7 кДж визначити відносну похибку досліду.
Завдання 4. Залежність швидкості реакції від концентрації реагуючих речовин.
Досліджується швидкість утворення сірки (утворення каламуті) за реакцією:
Na2S2O3 + H2SO4 ® Na2SO4 + H2S2O3
H2S2O3 ® H2O + SO2 + S
В 10 пронумерованих пробірок налити розчини 1 М Na2S2O3, 1 М H2SO4 та води в кількостях, що приведені в наступній таблиці:
50
