
- •Содержание умкд
- •1. Типовая учебная программа дисциплины.
- •3. Силлабус по дисциплине «Химия почв» для специальности 050113 «Биология»
- •3.10 Критерии и правила выставления баллов
- •6. Лекционный комплекс
- •Силикаты – это большая группа минералов, основой кристаллохимической структуры является кремнекислородный тетраэдр. Они представлены полевыми шпатами, слюдами, пироксенами, амфиболами и оливином.
- •7. План практических (семинарских) занятий
- •8.Методические рекомендации по дисциплине
- •10. Материалы срс
- •11. Материалы по контролю и оценке учебных достижений обучающихся. Элементный и фазовый состав
- •12. Программное и мультимедийное сопровождение учебных занятий.
- •13. Перечень специализированных аудиторий, кабинетов и лабораторий.
3.10 Критерии и правила выставления баллов
Список рекомендуемой литературы
|
№
|
Название, год и место издания |
|
|
Основная литература |
|
1. |
Химия почв. Под.ред. Орлов Д.С, Садовникова Л.К., Суханова Н.И. – М.: ВШ, 2005. |
|
2. |
Лабораторный практикум по курсу «Химия почв». Затулей Е.Д., Прожорина Т.И.- Воронеж,2004 |
|
3. |
Почвоведение. В.Ф.Вальков, К.Ш. Казеев, С.И. Колесников.- М.: МарТ,2006 |
|
|
Дополнительная литература |
|
1. |
Воробьева Л.А. Химический анализ почв – М.:Изд-во Моск.ун-та,1998 |
|
2. |
Современные химические и физические методы исследования почв/ Под.ред. Орлова Д.С., Воронина А.Д. – М.: изд-во Моск.ун-та, 1987 |
|
3. |
Муравьев А.Г. Оценка экологического состояния почв. – СПб.: Крисмас, 2000. |
4. График выполнения и сдачи заданий по дисциплине. См. РУП/силлабус по дисциплине «Химия почв» раздел 2 п.2.6
5. Карта учебно - методической обеспеченности дисциплины. См. РУП/силлабус по дисциплине «Химия почв» раздел 4 пп. 4.1, 4.2
6. Лекционный комплекс
Лекции №1СРСП №1
История развития химии почв как науки
Химия почв — наука о свойствах, динамике, происхождении почв, как естественноисторических образований, как объекта труда и средства сельскохозяйственного производства. Почвоведение в качестве самостоятельной области естествознания оформилось 100 лет назад (основоположник Докучаев). До этого почвоведение рассматривалось как часть агрономии или геологии. Толчком к развитию П. послужила практическая деятельность людей. Самый верхний слой земли, на котором человек жил, получал урожай, стал объектом труда и средством производства. Это произошло много тысяч лет назад. Накопление знаний началось в III веке до н.э. в древнем Китае и Египте. В древней Греции имели детальную классификацию земли. Юлий Цезарь ввёл обязательное известкование немецких земель для повышения плодородия. Позже церковь запретила изучать почву, но в 16-19 веке возникла агрономия — наука о приёмах обработки почв и выращивании культурных растений (начала развиваться в Германии как наука). Возглавил это в 19 веке Теер. Он выдвинул теорию органического питания растений, к нему присоединилось много крупных немецких химиков. Все они изучали органическое вещество гумуса (16-18% гумуса — почва хорошая). Почвенный гумус очень сложное по структуре органическое вещество, включает в себя несколько групп органических веществ. Но не только от гумуса зависит плодородие почв. N, P, K также очень важное звено. После выяснения этого начала развиваться минеральная теория. В этот период расширяются экспериментальные работы. Вся морфология почв является информационной. Это одна из функций почвы. Она показывает генезис почвы. Каждая почва прошла через этап развития в определённых условиях. Развитие почвоведения делится на додокучаевский и докучаевский периоды. Докучаев сумел объединить две теории в одну (гумусовую и минеральную). Также он установил 5 факторов почвообразования: рельеф, климат, растительность, геология, деятельность человека (он рассматривал почву как часть географической среды). Почвоведение — зеркало физической географии. Все факторы действуют взаимно. На основании этих факторов были предложены зоны земного шара: северная зона, тундра, лесотундра, тайга, лесостепь, степь, лапиритная зона (тропики, субтропики). Докучаевым было предложено изучение почв по их генезису. Основным показателем являлась морфология почв. Методы Докучаева сейчас повсеместны. С ним работали Северцев (картографирование и классификация почв), Костычёв (органомическое почвоведение), Кассович (физика и химия почв), Глинка (география и классификация почв), Гедройц (поглотительная способность почв), Высоцкий (гидрологический режим почв), Вильямс (развитие почвенного процесса (Полынов, Ковда, Тюрин, Глазовская)). Все они принимали участие в составлении мировой карты почв.
Все методические вопросы решаются с учётом учения Докучаева. В 1922 году в Беларуси был открыт институт сх. Кафедру почвоведения возглавил профессор Касаткин (кафедра представила схематическую карту почв Беларуси). В 1923 году был открыт (в Горках) с/х инст. (Медведев, Пашин, Булгаков, Моисеев). Кафедра провела детальное исследование почв всех областей Беларуси. В 1925 году Минский и Горецкий инст. были объединены в Горецкую с/х академию. В 1930 году появилась вторая сводная карта почв Беларуси. После войны материал был обобщён в монографию почвы БССР. К этой книге была приложена карта №3 (Медведев, Булгаков, Роговой). В 1957 году было принято решение о проведении крупномасштабного картографирование почв Беларуси и создание агрохимической службы Беларуси. Для этого был создан беларуский НИИ почвоведения и агрохимии, который и сейчас проводит огромную работу по изучению почв.
Связь с другими науками.
П. связано с физикой, химией, географией, биологией, математикой, геологией и др. П. опирается на разработанные ими фундаментальные законы и методы исследования. Сейчас выделяют: физику, химию, биологию почв, микробиологию, минералогию, микроморфологию, географию, картографию почв. От этого отталкиваются: мелиоративное П., лесное, санитарное, военное П.; грунтоведение (очень важный параметр при строительстве). Почва — верхний слой суши земного шара, видоизменённый и продолжающий изменятся под действием биологических и географических факторов.
Особенности почвы
Почва — живое тело, напоминающее по своему сложению губку.
Почва населена живыми организмами, чего нет в геологической породе.
Почва очень неоднородна по составу.
Почва однотипна в пределах одинаковых форм рельефа.
Почва всегда связана с факторами почвообразования и с географической средой.
Почва характеризуется специфическими свойствами (физ/хим).
Почва изменяется во времени.
Почва обладает плодородием.
Происхождение почвы
Почва образуется из горной породы в результате выветривания и почвообразования. Все горные породы, прежде чем стать почвой, подвергаются выветриванию, при этом горная порода превращается в мелко раздробленную массу, обладающую способностью впитывать и удерживать питательные вещества, воду, воздух. Таким образом, горная порода становилась благоприятной средой для поселения микроорганизмов, низших растений. Простые разрушительные процессы+выветривание+биохимическое разрушение=почвообразование. Появление растений резко меняет направление процесса миграции различных продуктов. Микроорганизмы захватывали нужные им соли, тем самым фиксируя их и не давая вымыться им из «почвы». В конце жизненного цикла растения отмирают и минерализуются, служа пищей микроорганизмам (малый круговорот), а те переводят его органику в минералы, которыми могут питаться следующие поколения растений. Каждое новое поколение какой-либо формы жизни приводит к накоплению элементов почвенного плодородия
Виды выветривания
Выветривание — механическое разрушение и химическое изменение горных пород и минералов, протекает в верхних горизонтах горных пород (в коре выветривания).
Механическое выветривание — механическое разрушение пород без изменения химического состава.
Химическое выветривание — химическое изменение пород и минералов. Химическое выветривание более полезно, потому что образуются вторичные минералы, а также химические соединения, которые придают породе следующие свойства: связность, влагоёмкость, поглотительную способность. Всё это создаёт благоприятные условия для жизни микроорганизмов.
Биологическое выветривание — перераспределение химических элементов по типу биогенной аккумуляции. В результате физико-химического взаимодействия элементы питания переходят в раствор и становятся доступными для растений. Схема большого геологического круговорота: осадки—растворение—вынос в море—выход на поверхность осадочных отложений. Отсутствие биологического выветривания не допускает существования живых организмов. Химическое и физическое выветривание готовит почву для биологического выветривания. С момента действия биологического выветривания начинается малый биологический круговорот веществ: поступление из горной породы и атмосферы питательных элементов в живые организмы, малый биокруговорот синтезирует органику, возвращение химических элементов в почву с ежегодным опадом органического вещества. Биокруговорот связан с минерализацией мёртвого органического вещества в почве, в результате происходит накопление гумуса и минеральных макро- и микроэлементов, которые служат для формирования живых организмов. Биокруговорот веществ связан с развитием специфического почвообразовательного процесса, который носит название дёрнового процесса. Растительность, как лесная так и травянистая, ежегодно частично или полностью отмирает к концу вегетации. Мёртвая органика частично или полностью минерализуется, высвобождая гумус и минеральные элементы. Они служат питанием для других растений, которые, закончив свой цикл, тоже станут кормом. За счёт дёрнового процесса существует жизнь на Земле.
Лекции №2 СРСП №2
Элементный и фазовый состав почв.
Почва состоит из твердой, жидкой (почвенный раствор; и газовой (почвенный воздух) фаз.
Почвенный воздух отличается от атмосферного повышенным содержанием углекислого газа (в среднем около 1%, иногда до 2—3% и более) и меньшим — кислорода. Состав почвенного воздуха зависит от интенсивности газообмена между почвой и атмосферой. Образование углекислого газа в почве происходит в результате разложения органического вещества микроорганизмами и дыхания корней. Образующийся углекислый газ частично выделяется из почвы в атмосферу, улучшая воздушное питание растений, а частично растворяется в почвенной влаге, образуя угольную кислоту (H2O + СО2 = Н2СО3). Последняя вызывает подкисление раствора, в результате чего усиливается растворение и перевод в усвояемую для растений форму содержащихся в почве нерастворимых минеральных соединений Р, К, Са, Mg и др. При избыточном увлажнении почвы и плохой аэрации содержание углекислоты в почвенном воздухе повышается, а количество кислорода снижается до 8—12% и менее, что отрицательно сказывается на развитии растений и микроорганизмов.
Почвенный раствор — наиболее подвижная и активная часть почвы. Он является непосредственным источником воды и питательных веществ для растений. Состав и концентрация его изменяются в результате разнообразных биологических, химических и физико-химических процессов. Между жидкой, газообразной и твердой фазами почвы постоянно устанавливается подвижное (динамическое) равновесие. Поступление солей в почвенный раствор зависит от хода процессов выветривания и разрушения минералов, разложения органического вещества в почве, внесения органических и минеральных удобрений.
Концентрация почвенного раствора незасоленных почв невелика и колеблется от десятых долей грамма до нескольких граммов веществ на литр. В засоленных почвах содержание растворенных веществ достигает десятков, а иногда и сотен граммов на литр.
Избыток водорастворимых солей в почве (более 0,2%, или 2 г на 1 кг почвы) вредно действует на растения, а при содержании их 0,3—0,5% растения погибают.
В почвенном растворе содержатся не только минеральные, но и органические вещества, органоминеральные соединения, а также растворенные газы (углекислый газ, кислород, аммиак и др.). В составе почвенного раствора могут находиться различные анионы и катионы. Наиболее важное значение для питания растений имеет присутствие в почвенном растворе ионов К+ Са2+, Mg2+, NH4+ NO3- SO42- и H2PO4- и постоянное их пополнение. Железо и алюминий содержатся в почвенном растворе в основном в виде устойчивых комплексов с органическими веществами, а в кислых почвах — в виде катионов и гидратов полуторных окислов в коллоидно-растворимой форме.
Огромное значение для питания и роста растений, как уже указывалось ранее, имеет реакция почвенного раствора.
От концентрации и степени диссоциации растворенных веществ зависят осмотическое давление почвенного раствора и поглощение воды корнями растений. Осмотическое давление почвенного раствора в незаселенных почвах значительно ниже, чем в клеточном соке растений. На засоленных почвах с большим осмотическим давлением поглощение воды культурными растениями затрудняется.
Концентрация солей и осмотическое давление почвенного раствора зависят от влажности почвы и являются весьма динамичными величинами.
Твердая фаза почвы состоит из минеральной и органической частей, которые являются основными источниками питательных веществ для растений.
Около половины твердой фазы приходится на кислород, одна треть — на кремний, свыше 10% — на алюминий и железо и лишь 7% составляют остальные элементы.
Азот практически полностью содержится в органической части почвы, углерод, фосфор, сера, кислород и водород — как в минеральной, так и в органической, а все другие из указанных в ице элементов — в минеральной части почвы.
Минеральная часть составляет 90—99% массы твердой фазы почв и имеет сложный минералогический и химический состав. Она представлена кристаллическими кремнекислородными и алюмокремнекислородными (или силикатными и алюмосиликатными) минералами, аморфными и кристаллическими гидроксидами алюминия, железа и кремния, а также различными нерастворимыми минеральными солями. Наиболее распространен в почве первичный силикатный минерал кварц (SiO2, двуокись кремния). Содержание его во всех почвах превышает 60%, а в легких песчаных достигает 90% и более. Кварц характеризуется большой механической прочностью и устойчивостью к химическому выветриванию, он не участвует в химических реакциях в почве.
Из первичных алюмосиликатных минералов в почве широко распространены калиевые и натрий-калиевые полевые шпаты, в меньшей степени — калийная и железисто-магнезиальные слюды. Постепенно разрушаясь, эти минералы служат источником калия, кальция, магния и железа для растений. Первичные минералы — кварц, шпаты и слюды — обычно присутствуют в почве в виде частиц песка и пыли.
Вторичные, или глинистые, минералы образуются при изменении полевых шпатов и слюд в процессе выветривания и почвообразования. Они находятся в почве главным образом в виде мелкодисперсных илистых и коллоидных частиц и обладают большой суммарной поверхностью и поглотительной способностью. По строению кристаллической решетки, степени дисперсности и другим свойствам глинистые минералы объединяют в три группы: каолинитовую; монтмориллонитовую; гидрослюд. Они состоят главным образом из кремния, алюминия, кислорода и водорода, а также содержат небольшое количество железа, кальция, магния, калия и могут быть источником этих элементов для растений. В твердой фазе почвы всегда присутствуют в сравнительно небольшом количестве труднорастворимые соли фосфорной кислоты (фосфаты кальция, магния, железа и алюминия), а в отдельных почвах может быть значительное количество малорастворимых карбонатов кальция, магния и сульфата кальция.
В почве постоянно протекают процессы превращения труднорастворимых соединений в легкорастворимые и, следовательно, более доступные растениям. Одновременно происходят и обратные процессы. Различные механические фракции почвы имеют неодинаковый минералогический и химический состав, отличаются по содержанию элементов питания. Более крупные частицы почвы — песчаные и пылеватые — состоят в основном из кварца, поэтому характеризуются высоким содержанием кремния, но меньшим — алюминия, железа, а также кальция, магния, калия, фосфора и других элементов. В состав мелкодисперсной коллоидной и илистой фракции входят преимущественно первичные и вторичные алюмосиликатные минералы, поэтому в ней больше содержится алюминия и железа, а также кальция, магния, калия, натрия, фосфора и других элементов питания. В связи с этим более тяжелые глинистые и суглинистые почвы богаче элементами питания, чем песчаные и супесчаные. Мелкодисперсные минеральные частицы почвы (глинистые минералы) вместе с органическим веществом обусловливают ее поглотительную способность, которая играет важную роль при взаимодействии удобрений с почвой.
Следовательно, механический состав почвы в значительной степени определяет многие важные ее свойства — содержание элементов питания (Са, Mg, К, Р, Fe, микроэлементов), поглотительную способность, а также физические свойства (влагоемкость, водопроницаемость, воздушный и тепловой режим).
Лекции №3 СРСП №3
Почвенные пигменты
Критерий окраски почв включает в себя такие понятия, как цвет, чистота окраски, интенсивность окраски или насыщенность и оттенок или тон окраски. На окрашивание почв природа использует практически всю палитру цветов радуги. Но по интенсивности и насыщенности окраска почв обычно не яркая, а скорее сдержанно-тусклая с гаммой всевозможных тонов. Поэтому определить расцветку почвы одним цветом, например, бурым, обычно не представляется возможным. По этой причине приходится прибегать еще и к обозначению дополнительных тонов и степени осветленности (или чистоты цвета): светло-бурый с палевым оттенком и т.д. Следует, однако, заметить, что надо избегать громоздких тройных терминов по типу известного выражения "серо-буро-малиновый". Допускается употребление образных сравнительных обозначений -шоколадная, кофейная, стально-серая, пепельная, седоватая, грязно-болотная ит.д. Но не следует злоупотреблять этим приемом и допускать излишнюю фантазию. Известные затруднения при определении окраски почв возникают у начинающих из боязни ошибиться и стремления абсолютно точно обозначить цвет. Между тем это вообще недостижимо. Словарный запас людей не настолько богат, чтобы дать точное название всему множеству оттенков почв. Гораздо важнее дать относительную характеристику окраски, пользуясь выражениями "светлее", "темнее", "ярче" и т.д. по сравнению с предыдущим слоем. Понятно, что такие определения окраски страдают излишней субъективностью. Для большей объективности был предложен ряд методов определения окраски почв с помощью соответствующих шкал и методов. Но пока широко практического применения они не нашли. Вполне очевидно, что окраска почв, с одной стороны, наследуется от исходных горных пород, особенно внизу профиля, а с другой, - является результатом почвообразования. В свою очередь, цвет почвы непосредственно связан и определен минералогическим и химическим составом, дисперсностью, сложением, влажностью и другими свойствами почвы. А это значит, что все изменения в окраске по профилю являются отражением внутренних изменений почвенного материала. В зависимости от степени однородности (или изменчивости) цвета в пределах горизонтов выделяют следующие типы окраски:
1 - равномерная - цвет, тон и насыщенность окраски не меняется по всему горизонту;
2 - неравномерная - интенсивность, осветленность или оттенок окраски постепенно меняется сверху вниз;
3 – пятнистая - пятна различной формы и размеров одного цвета спорадически разбросаны на фоне другого основного цвета горизонта;
4 - крапчатая - мелкие (d < 5 мм), хаотично расположенные пятнышки на сплошном фоне другого цвета;
5 – полосатая или муаровая - правильное, порою симметричное чередование параллельных полос разного цвета и прихотливой формы (например, реликт ленточных глин);
6 - мраморовидная - крайне пестрое переплетение причудливых узоров и орнаментов из пятен и прожилок разного цвета.
Важнейшими красящими пигментами почвы, от которых зависит ее цвет, является гумус, окись железа, марганца, меди, закись железа, кварц, палевые шпаты, карбонаты, глины, соли, гипс и др. Так, темная окраска является обычно следствием наличия в почве гумуса. При этом интенсивность цвета зависит не только от содержания гумуса, но и от его природы. Бывают случаи, когда почва, окрашенная в смолисто-черный цвет, содержит всего около 2-3 % гумуса, тогда как другая почва с более чем 5-8 % гумуса довольствуется лишь светло-серой окраской. Однако в пределах почвенного типа связь интенсивности темной окраски с количеством содержания в ней перегнойных веществ настолько тесна, что опытный наблюдатель может на глаз достаточно точно определить содержание гумуса в том или ином горизонте. Визуально наличие гумуса фиксируется в зависимости от его дисперсности и господствующего фона на уровне 0,2-0,5 %. Так, у черноземов интенсивно темная с бархатистым оттенком окраска (иссиня-черный, цвет "вороньего крыла") указывает на высокое содержание - более 10 % гумуса. По темному, но не такому насыщенному цвету, можно судить о концентрации гумуса в 7-8 %. Темно-серая окраска говорит о 5-6 % гумуса, серая с бурым оттенком – о 3-4 %, бурая с серым оттенком - 1-2 %, бурая с сероватым оттенком - меньше 1 %. Гумус пропитывает всю почву и всегда оказывает на ее окраску затемняющее действие. Этим как раз и объясняется отсутствие у почв чистых и ярких тонов, так как затемненность понижает яркость. Поэтому почвам присущи смягченные матовые тона, придающие им "землистый" характер. Наряду с гумусом, черную окраску почве "навязывают" некоторые минералы группы амфиболов, сульфиды, гидроокислы марганца, нонтранит, реликтовый органический детрит (шунгитовые сланцы, например) и т.д.
Белая окраска и светлые тона почвы вызваны преимущественно каолинитом, чистыми бокситами (гиббситом. бемитом), аморфным кремнеземом, мелом, пропиткой и выцветами солей, тонкодисперсным гипсом или ангидритом.
Носителями белой, порой слепящей на солнце глаза окраски, могут быть некоторые первичные минералы, такие, как кварц, полевые шпаты и др. Красная окраска обусловлена обилием в почве окислов железа, чаще всего в форме гематита. Чем более окислена и обезвожена богатая свободным железом почва, тем более сочную ярко-красную окраску она имеет. И, наоборот, чем более гидротирован оксид железа в ряду гематит-лимонит, тем успешнее красно-ржавая окраска вытесняется желтой. Бурым цветом окрашена почва в том случае, если она располагает изобилием иллита, гидрослюд, фульватов гумуса, гидроокислов железа с переменным содержанием конституционной влаги.
Синеватые, грязно-голубые, бутылочно-оливковые, салатные и сизоватые оттенки возникают в почве при восстановлении железа в анаэробной переувлажненной обстановке. Сочно-изумрудные и малахитово-зеленые побежалости и разводы чаще всего связаны с окислами и карбонатами меди.
Сочетаясь в различных соотношениях и находясь в состоянии различной дисперсности перечисленные основные пигменты и определяют все огромное разнообразие цветов почв, которое наблюдается в природе. При этом дающие окраску почве компоненты могут составлять относительно малую ( с учетом их роли в окрашивании) долю от общей массы почвы, не более 0,1-0,5 %. Но за счет своей дисперсности и "размазанности" по поверхности всего песчанистого и пылевого материала почвы, за счет создания тонких пленок и манжетов, за счет обволакивания агрегатных отдельностей этим компонентам становится под силу затушевать и оттеснить все остальные цвета и навязать почве свою окраску. И поэтому самые незначительные биогеохимические изменения среды почвы могут решающим образом сказаться на ее цветовом спектре и тем самым дадут знать о себе. По этой причине цветовая гамма исходного и растертого в порошок образца, как правило, далеко не одинакова, что может служить диагностическим показателем.
И, наконец, необходимо помнить, что цвета и оттенки окраски почвы определяются многими ее свойствами и состоянием. Так, например, оструктуренные и влажные почвы кажутся более темными, чем бесструктурные и сухие. В вечерние и утренние часы почвы кажутся более темными, чем днем при рассеянном свете. Поэтому оправдано определение окраски почвы производить во влажном и сухом состоянии. В противном случае не исключена утеря нужной информации, что может привести к ошибкам в трактовке генезиса почвы.
Лекции №4 СРСП №4
Представители щелочных металлов в почвах Na, K.
Минеральные вещества в почвах составляют 90-95 % в гумусовых горизонтах и более 99% в минеральных горизонтах. Исключением являются торфяные горизонты, лесные подстилки и ветошь. Минеральная часть в основном наследуется от почвообразующих пород. По мере развития почвообразовательного процесса минералы претерпевают ряд изменений.
В рыхлых почвообразующих породах и в почвах минеральная часть слагается из минералов, по своему происхождению относящимся к двум группам:
Первичным минералам магматического и метаморфического происхождения.
Вторичным минералам, образовавшихся в коре выветривания и в почвах в результате стадийного разрушения первичных минералов и синтеза из конечных продуктов выветривания.
По содержанию минералы подразделяются на породообразующие, содержание которых в почве и породах составляет более 5%, относительно редкие и акцессорные, образующие относительно ничтожную примесь в горных породах.
Полевые шпаты по массе в почве составляют ~ 50%. Их кристаллохимическая структура также как и кварца представляет собой каркас из кремнекислородных тетраэдров. В отличие от кварца внутри тетраэдров кремний частично замещен ионом алюминия, имеющего больший радиус. Возникшая нестабильность в строении компенсируется включением в структуру силикатов катионов щелочных ищелочноземельных металлов (К+,Na+,Ca2+). Полевые шпаты делятся на кислые и основные. К кислым полевым шпатам относятся К- и Nа- полевые шпаты. Они имеют светлую окраску, отношение SiO2/Al2O3, характеризующее относительное содержание кремния и алюминия в минерале, составляет 5-6. Они представлены минералами калиевыми полевыми шпатами микроклином (триклинный) и ортоклазом (моноклинный) K[AlSi3O8] и натриевым полевым шпатом альбитом Na[AlSi3O8]. К основным полевым шпатам относятся кальциевые полевые шпаты, представителем которых является минерал анортит Ca[Al2Si2O8].
Изоморфные смеси Na- и Ca- полевых шпатов образуют группу плагиоклазов. Если в плагиоклазах преобладают Na- полевые шпаты, то они относятся к кислым (олигоклаз, олигоклаз-альбит). Если в плагиоклазах преобладают Ca- полевые шпаты, то они относятся к основным (андезин, лабрадор).
Слюды входят в состав многих изверженных и осадочных пород.. Содержание их в почвах составляет 4-5%. Они имеют слоистую кристаллохимическую структуру, в которой SiO4-тетраэдры образуют плоские сетки. Вершины обращенных друг к другу тетраэдров связаны ионами Al c OH- группой, образуя трехслойные пакеты, соединенные между собой ионами К,Mg,Fe .
Калийная слюда – мусковит KAl[AlSi3O10](OH)2, светлая, устойчива к выветриванию. Магнезиально-железистая слюда – биотит K(Mg,Fe)[AlS3O10](OH)2 темная, менее устойчива к выветриванию. Слюды в процессе выветривания легко теряют ионы щелочей.
Пироксены и амфиболы составляют 5-15 % в почвах. SiO4 – тетраэдры их образуют цепочки, соединенные ионами Mg, Fe, Al, Са, К, Na. Это темные зеленоватые минералы. Наиболее распространены: среди пироксенов авгит R2(Si2O6), среди амфиболов роговая обманка R7 (Si4O11) (OH)2.
Лекции №5 СРСП №5
Теоретические и методические проблемы почвенного раствора.
Почвенный раствор участвует в в процессах абиотических взаимодействий и масспереноса в почвах: сорбционном, комплексо- и хелатообразовании, физико-химическом разложении веществ; а также в процессах абиотического перемещения веществ в почвах. Сорбционные процессы характеризуются перераспределением вещества в ионной и молекулярной формах между твердой, жидкой и газообразной формами почвы. Твердая фаза почвы благодаря развитой поверхности, наличию различных функциональных групп, представляет собой сложный полифункциональный сорбент, способный к одновременному поглощению катионов. Анионов и нейтральных молекул. При этом прочность образующихся связей, механизм поглощения, возможность обратного перехода сорбированных почвой частиц в раствор или газообразную фазу очень сильно варьируют. Обычно в почвах выделяют несколько типов сорбционных взаимодействий. Обменное и необменное поглощение ионов, главным образом катионов, характерно для всех типов почв. Различные почвы в зависимости от гранулометрического состава, содержания органического вещества и других особенностей, способны поглощать от единиц до десятков миллиграмм-эквивалентов катионов на 100 гр. Почвы. При этом для большей части поглощенных катионов соблюдается правило обратимости и эквивалентности ионного обмена. Согласно этому правилу, поглощенные катионы твердой фазы могут замещаться другими катионами из почвенного раствора в эквивалентных количествах. Таким образом, обменно сорбированные катионы способны легко переходить в почвенный раствор, поглощаться растениями, мигрировать в результате диффузии, перемещаться с почвенной влагой и т.д. В то же время наряду с обменным поглощением некоторые катионы способны необменно поглощаться твердой фазой почвы, или, как иногда говорят, фиксироваться. Состав поглощенных катионов оказывает существенное влияние на корневое питание, а следовательно, и на жизнь растений. Так, избыточное содержание обменных водорода и алюминия в кислых почвах таежной зоны и влажных субтропиков может оказывать угнетающее действие на многие культурные растения и должно быть устранено известкованием. Избыточное содержание обменных натрия и магния в засоленных почвах также оказывает неблагоприятное действие на плодородие почв и устраняется различными приемами химической мелиорации, например, гипсованием. Почвы также обменно и необменно поглощают анионы, хотя эта способность выражена заметно слабее, поскольку в почвах преобладают функциональные группы, несущие отрицательный заряд. Обменные и необменные поглощения ионов показывают, что сорбция не только массперенос вещества на коллоидном и микроагрегатном уровне, но и один из видов трансформации вещества, приводящий к возникновению качественно новых поверхностей в почвах, изменению концентрации ионов в почвенных растворах. В принципе любой тип сорбционного взаимодействия в почве может рассматриваться как трасформационный абиотический процесс. В почвах также широко представлены другие виды сорбционных взаимодействий — поглощение молекул по типу физического взаимодействия, химического взаимодействия с образованием различных по характеру и прочности связи сорбционных систем и т.д. Процессы сорбционного закрепления молекул имеют исключительно важное значение в сохранении и относительной стабилизации почвенного гумуса, детоксикации многих пестицидов, вносимых в пахотные почвы. Комплексо — и хелатообразование широко представлено в почвах благодаря наличию в них многих веществ, особенно органических, способных образовывать особый класс более сложных химических соединений, отличающихся характерным строением, в частности, наличием атома металла (реже неметалла) в определенном валентном состоянии, связанного с одним или несколькими способными к самостоятельному существованию ионами или молекулами. Вещества типа хелатов представляют собой особую группу комплексных соединений. Комплексо- и хелатообразование может протекать в почвенном растворе практически без участия твердой фазы. В результате этих процессов существенно изменяются свойства молекул и ионов, участвующих во взаимодействии. Например, ионы металлов, входящие в состав комплексных соединений, могут полностью утратить способность к обменномк поглощению, и за счет этого существенно увеличивать способность к перемещению в составе почвенного раствора. Изменяется и способность к биологическому поглощению закомплексованного иона. В настоящее время комплексообразованию придается важное значение в процессах трансформации и миграции вещества во многих почвах. В почвах также могут протекать реакции комплексообразования, сопровождающиеся переходом продуктов взаимодействия, образующих комплекс, в твердую фазу почвы. В этом случае имеет место так называемая комплексообразовательная сорбция. физико-химическое разложение вещества в почве наиболее изучено для некоторых веществ, поступающих в почву извне, Например, органических пестицидов, молекула которых распадаются на более простые соединения. Известно, что в этом распаде определенную роль может играть гидролиз, в частности, с участием гидролитических ферментов, образующихся микробилогическим путем. Некоторые компоненты почвы, например гумус, могут играть роль катализаторов, существенно ускоряющих химические процессы. Определенная роль отводится и фоторазложению - распаду вещества под действием солнечного света. Почвенные соединения также подвержены разложению под влиянием абиогенных физико-химических факторов, в т.ч. процессов кислотного и щелочного гидролиза некоторых минералов. Почвенные растворы также участвуют в процессах перемещения вещества. В почвах, расположенных на территориях с достаточным количеством атмосферных осадков, наблюдается более или менее интенсивное нисходящее перемещение почвенной влаги, вместе с которой перемещаются и растворенные вещества, а также взвешенные тонкодисперсные частицы. Этим потокам традиционно отводилось очень большое место в формировании многих типов почв. В естественных биогеоценозах на почвах подзолистого типа, в меньшей степени в других типах почв, благодаря нисходящей абиогенной миграции осуществляется возврат в корнеобитаемый слой биофильных элементов, вынесенных на поверхность почвы биологическим путем. Основные звенья биогеохимического круговорота веществ в почвах включают биологическое перемещение вещества снизу вверх и абиотическую миграцию его в обратном направлении. Благодаря абиотической нисходящей вертикальной миграции происходит перемещение удобрений, сельскохозяйственных ядохимикатов, различных загрязнений по профилю почв и частичное их поступление в грунтовые воды. Пути вертикальной миграции вещества в почвах довольно сложны. В почвах осуществляется не сплошной фронтальный перенос влаги и растворенных веществ, а перемещение локализовано по трещинам, ходам корней и т.д. Кроме того, направление потоков вследствие неоднородности почвы, наличия постоянных и временных водоупоров и по другим причинам часто более или менее значительно отклоняется от строго вертикального, переходя в ряде случаев в боковые латеральные потоки. В процессе миграции меняется состав почвенного раствора. Это связано с тем, что средняя скорость перемещения растворенного вещества ниже скорости перемещения воды, т.к. вода перемещается по полостям и объемам почвы, не заполненным твердой фазой, а почвенный раствор вследствие большей или меньшей сорбируемости, перемещаясь по тем же каналам, что и вода, периодически входит в состав твердой фазы, т.е. Одновременно с перемещением вещества в составе жидкой фазы протекают процессы его сорбции и десорбции. При исследовании скорости и путей перемещения почвенных растворов удобно использовать изотопно-индикаторный, а также лизиметрический методы. При этом удается наблюдать траектории перемещения вещества, оценивать средние скорости перемещения и т.д. Используется также метод лизиметрических хроматографических колонок, разработанный Кауричевым и Ноздруновой. Анализ сорбированного вещества позволяет установить, какое его количество может выноситься из определенной части почвы или вносится в нее за время наблюдения.
Лекции № 6 СРСП №6
Катионообменная способность почв
Обменные катионы в почвах представлены главным образом элементами I и II групп периодической системы. В кислых почвах значительную, а иногда преобладающую роль играют ионы Н+ и А13+. В обменной форме в почвах находятся и многие микроэлементы: ионы Zn2+, Сu2+, Мn2+ и др.; эти формы микроэлементов учитывают при оценке их доступности растениям, но на физические и физико-химические свойства твердых фаз почвы и почвенного раствора они практически не влияют. Наиболее подробно катионный обмен изучен для катионов Са2+, Мg2+, К+ и Nа+.
Открытое Г.С. Томпсоном и впервые изученное Дж. Уэем явление обмена катионов в почвах оказало исключительно большое влияние на развитие химии почв и генетического почвоведения и привело к созданию искусственных ионообменников (ионитов), широко используемых в современной химии и химической технологии. Основы учения о ионном обмене и его использования в теоретическом и прикладном почвоведении создал выдающийся ученый академик К.К. Гедройц.
К.К. Гедройц рассматривал ионный обмен как один из видов поглотительной способности почв. Он предположил различать следующие виды поглотительной способности:
• механическая поглотительная способность — свойство почвы одерживать частицы, взмученные в фильтрующейся через почву воде;
• физическая поглотительная способность — концентрирование или разжижение растворенных в почвенном растворе веществ у поверхности соприкосновения твердых частичек почвы с почвенной влагой, обусловленное поверхностной энергией почвенных частиц;
• физико-химическая, или обменная, поглотительная способность, — свойство почвы обменивать некоторую часть содержащихся в твердых фазах катионов на эквивалентное количество катионов, находящихся в соприкасающемся с почвой растворе;
• химическая поглотительная способность — образование в почвенном растворе нерастворимых или малорастворимых солей, которые выпадают в осадок и примешиваются к твердым фазам почвы;
• биологическая поглотительная способность — обусловлена деятельностью растений и микроорганизмов, населяющих почвы, и заключается в поглощении живыми организмами различных веществ из почвенного раствора.
Эти виды поглотительной способности и основные закономерности обмена изложены К.К. Гедройцем в книге «Учение о поглотительной способности почв» (1922).
Катионообменная способность относится к числу фундаментальных свойств почвы. Ее роль и значение в неполном объеме можно охарактеризовать следующими положениями.
1. От состава обменных катионов зависят физические свойства почв: их пептизируемость и агрегированность. Обменный Na+ вызывает пептизацию тонкодисперсной части почв, образование почвенной корки, ухудшает структуру. Обменный Са2+ повышает степень агрегированности, способствует формированию водопрочной структуры.
2. От состава обменных катионов зависят поглощение органических веществ твердыми фазами, образование органоминеральных соединений.
3. Реакции обмена катионов влияют на рН почвенного раствора и его солевой состав.
4. Обменные катионы — один из непосредственных источников элементов минерального питания растений. В частности, обеспеченность почв калием определяется по содержанию обменного калия.
5. Состав обменных катионов — один из важнейших показателей, используемых при диагностике и классификации почв. Еще в работе В.В. Докучаева «Материалы к оценке земель Нижегородской губернии» указывалось, что поглотительная способность почв должна оказать большую услугу как масштаб для предварительного разделения почв на группы, при определении колебаний в пределах данной группы и для установки границ между соседними группами почв. К.К. Гедройц первым предложил использовать обменные катионы для генетической классификации почв. В современной практике широко используется деление почв на насыщенные и ненасыщенные основаниями; при подразделении почв по степени солонцеватости учитывается доля Nа+ в составе обменных катионов.
6. Состав обменных катионов и его ожидаемое изменение учитывают при составлении проектов промывок засоленных почв и полива почв минерализованными водами.
7. Законы катионного обмена являются теоретической основой доя некоторых видов химической мелиорации почв — известкования кислых почв и гипсования солонцов.
Катионный обмен — частный случай ионного обмена, под которым в химии понимают обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами.
Реакцию
обмена катионов М![]() и М
и М![]() формально можно записать так:
формально можно записать так:
П(М![]() )m
+ nМ
)m
+ nМ![]() ↔
П(М
↔
П(М![]() )n
+ mМ
)n
+ mМ![]() ,
,
где П — почвенный поглощающий комплекс. Эта форма записи показывает, что составная часть почвы — ее поглощающий комплекс, обозначаемый символом П (или ППК),— отдает в раствор катионы в обмен на эквивалентное количество катионов другого рода. Например, при обмене ионов Са2+ и Na+
ПСа2+ + 2Nа+ ↔ ПNа+2 + Са2+ или А13+ и Са2+
П(А13+)2 + 3Са2+ ↔ П(Са2+)3 + 2А13+.
Материальным носителем катионообменной способности почв является ППК. Почвенный поглощающий комплекс — это совокупность минеральных, органических и органоминеральных компонентов твердой части почвы, обладающих ионообменной способностью. Согласно определению, в ППК входят и способные к обменным реакциям катионы; в противном случае этот комплекс не смог бы выделить в ходе реакции эквивалентное количество катионов в обмен на катионы почвенного раствора. Не все твердые фазы почв способны проявлять катионообменную способность. Практически не обладают обменной способностью такие минералы, как кварц; очень слабо проявляется это свойство во фракциях механических элементов крупнее 0,002—0,005 мм. Способность к поглощению и обмену катионов сосредоточена главным образом в илистой фракции почв.
Катионы, которые входят в состав ППК и могут быть замещены Катионами другого рода при взаимодействии с нейтральными растрами солей, называют обменными катионами, в качестве синонима употребляют термин поглощенные катионы. При характеристике ППК и обменных реакций часто используют термин обменные основания, под которым понимают только обменные катионы Са2+, Мg2+, К+ и Na+, тогда как в число обменных катионов входят кроме того, Н+, А13+ и др. Таким образом, обменные основания составляют только часть обменных катионов, хотя в большинстве степных и сухостепных почв практически весь фонд обменных катионов представлен обменными основаниями. Термин «обменные основания» нельзя признать удачным; по определению Бренстеда — Лоури, основаниями называют вещества, способные соединяться с ионами водорода. По Аррениусу, основание — вещество, повышающее в растворе концентрацию гидроксильных ионов. Основаниями, следовательно, являются не сами катионы Са2+, Nа+ и т. д., а их гидроксиды. Однако в литературе по почвоведению прочно укоренилось понятие «обменные основания», и этим термином приходится пользоваться, хотя терминологические неточности нередко приводят к неверной трактовке почвенно-химических процессов. Так, встречаются мнения, что поступление в почвы ионов Са2+, Мg2+, Na+ независимо от сопутствующего им аниона вызывает снижение уровня почвенной кислотности.
Важнейшей характеристикой почвенного поглощающего комплекса и почвы в целом является емкость катионного обмена (ЕКО). Как синоним употребляют термин «емкость поглощения». Последний термин менее строгий, и поэтому его не следует рекомендовать для использования в научно-исследовательской и производственной работе.
По К.К. Гедройцу, емкость поглощения определяется как сумма всех обменных катионов, которые можно вытеснить из данной почвы. Он считал, что для данной почвы это величина постоянная и может изменяться лишь с изменением природы самой почвы. Позже было установлено, что величина ЕКО существенно зависит от рН взаимодействующего с почвой раствора и несколько варьирует при замене одного вида насыщающего катиона на другой.
Под емкостью катионного обмена будем понимать общее количество катионов одного рода, удерживаемых почвой в обменном состоянии при стандартных условиях и способных к обмену на катионы взаимодействующего с почвой раствора. Величину емкости катионного обмена выражают в миллиграмм-эквивалентах на 100 г почвы или ее фракции. Согласно правилам Международной системы единиц (СИ), величина ЕКО, выраженная в сМ(р+) • кг-1 (сантимоли положительных зарядов в 1 кг почвы), численно совпадав с числом миллиграмм-эквивалентов на 100 г почвы.
Емкость обмена не следует отождествлять с суммой обменных катионов. Последняя определяется как общее количество катионов, вытесняемых из незасоленной и бескарбонатной почвы нейтральным раствором соли. Сумма обменных катионов характеризует природное состояние почвы, она может совпадать количественно с ЕКО, но может и существенно от нее отличаться. Поскольку ЕКО зависит от рН, для одной и той же почвы сумма обменных катионов может быть ниже, если почва имеет кислую реакцию, ЕКО — выше, если ее определяют с помощью буферного раствор при рН 8,2. Возможны и обратные зависимости.
Учитывая зависимость емкости обмена от рН и необходимость характеристики почвы не только в условно выбранном стандартном состоянии, но и в природной обстановке, следует различат три вида ЕКО:
• емкость катионного обмена стандартную определяют с помощью буферных растворов при постоянном значении рН. С этой целью почву насыщают ионами Ва2+ из буферного раствора с рН 6,5 После насыщения емкость определяют по количеству поглощенно го почвой Ва2+;
• емкость катионного обмена реальную (или эффективную) определяют путем обработки почвы небуферными растворами солей о реальной емкости катионного обмена можно судить с достаточной точностью по сумме обменных катионов;
• дифференциальная (или рН-зависимая) емкость катионного обмена характеризует приращение емкости катионного обмена с увеличением рН равновесного раствора: ∆ЕКО/DрН. Чтобы найти дифференциальную ЕКО, почву насыщают катионами одного рода из буферных растворов с различными значениями рН (например 6,5 и 8,2), а затем рассчитывают общее приращение ЕКО или её приращение на единицу рН.
Емкость катионного обмена зависит от гранулометрического состава почвы и строения веществ, входящих в состав почвенного поглощающего комплекса. Увеличение ЕКО в тяжелых по механическоскому составу почвах обусловлено не только нарастанием удельной поверхности, но и изменением природы слагающих различные фракции веществ. Предылистые и илистые фракции содержат слоистые алюмосиликаты, в них повышено содержание гумусовых веществ, для которых характерна более высокая плотность зарядов на единицу поверхности, чем для первичных минералов крупных фракций.
Величина ЕКО зависит от числа отрицательных зарядов, приходящихся на единицу массы или поверхности ППК. Обменные катионы компенсируют отрицательный заряд, и в отсутствие внешнего электрического поля каждая частица ППК электронейтральна.
Емкость катионного обмена составляющих почву веществ меняется в очень широких пределах: практически от нуля (обломки кварца) до 500—900 мг-экв/100 г для гуминовых кислот. Величина емкости зависит от состава ППК. Каолинит в зависимости от степени дисперсности обладает емкостью от 2 до 15 мг-экв/100 г, галлуазит — от 15 до 30 мг-экв, монтмориллонит — от 70 до 150 мг-экв, а после растирания—до 200—250 мг-экв/100 г. Емкость иллита порядка 20—30 мг-экв/100 г, слюды — около 5—10 мг-экв на 100 г.
Наибольшей емкостью обладают гумусовые вещества, для которых особенно сильно выражена зависимость ЕКО от рН. В нейтральной и кислой средах в реакциях обмена участвует водород только карбоксильных групп. В щелочной среде диссоциируют также фенольные группы и некоторые другие гидроксилы, что резко увеличивает ЕКО. Надо иметь в виду, что карбоксильные группы гумусовых кислот неодинаковы. Константы диссоциации групп СООН зависят от их положения в молекуле и ближайшего окружения. Способность водорода карбоксилов к диссоциации особенно сильно возрастает при наличии близко расположенных электроотрицательных заместителей. Часть групп СООН гумусовых кислот активно участвует в реакциях обмена катионов при рН 5—6; другие (более слабые) группы вступают в реакцию лишь при возрастании рН.
В обогащенных гумусом горизонтах почв величина ЕКО обусловлена в значительной мере органическими веществами. По данным М.А. Винокурова, емкость органической части почвы в 10—30 раз превышает ЕКО минеральной части, и при содержании гумуса около 5—6 % на его долю приходится 30—60 % ЕКО
При количественном описании явлений катионного обмена редко используют уравнения изотерм адсорбции, например уравнения Фрейндлиха, Ленгмюра и др. Иногда и само явление обмена рассматривают как один из видов адсорбции. Однако различия между адсорбционными явлениями и ионным обменом настолько велики, что на этом следует остановиться подробнее.
Адсорбцией называют концентрированно вещества адсорбата объема газа или жидкости на поверхности твердого тела (адсорбе та) или жидкости. Если молекулы адсорбата образуют поверхностное химическое соединение с адсорбентом, то говорят о хемосорбции. Адсорбция увеличивается с ростом давления газа или концентрации раствора. При снижении парциального давления адсорбируемого компонента газовой смеси или при бесконечном разбавлении раствора адсорбция уменьшается вплоть до полного освобождения поверхности адсорбента от молекул адсорбата.
Сухие почвы обладают способностью адсорбировать различные газы и пары. Наиболее интенсивно происходит адсорбция молекул воды, которая описывается уравнением Брунауера — Эммета — Теллера (изотерма БЭТ). В меньшей степени адсорбируются СО2, O2, N2. Адсорбция воды, диоксида углерода и кислорода может сопровождаться химическим взаимодействием с компонентами твердых фаз почв (хемосорбция). Из растворов почвы адсорбируют нейтральные молекулы органических соединений, гумусовые вещества.
Адсорбцию вызывают молекулярные силы поверхности адсорбента Неполярные молекулы удерживаются за счет дисперсионных сил. Полярные молекулы (диполи, мультиполи) взаимодействуют с электростатическим полем поверхности адсорбента, что усиливает адсорбцию. Одно из главных различий между адсорбцией и ионным обменом заключается в том, что обменные катионы являются обязательным компонентом ППК и могут быть только заменены на катионы другого рода, но не удалены вовсе. Попытка пространственного расчленения ППК на анионную часть и катионы привела бы к нарушению принципа электронейтральности. В противоположность этому поверхность адсорбента может быть полностью лишена молекул адсорбата. Общее содержание обменных катионов остается сравнительно постоянным (в пределах постоянства величины ЕКО), тогда как количество адсорбированного вещества является функцией активности адсорбата в объеме фазы. Иными словами адсорбент и адсорбат могут существовать раздельно, тогда как ППК составляет единое целое.
В то же время количественные закономерности адсорбции и ионного обмена могут быть описаны сходными по форме уравнениями. Для описания изотерм адсорбции пользуются уравнением Фрейндлиха или уравнением Ленгмюра.
Эмпирическое
уравнение
Фрейндлиха имеет
вид![]()
где Q — количество адсорбированного вещества; с — его равновесная концентрация (или равновесное парциальное давление); m и n -эмпирические константы. Это уравнение впервые было сформулировано Беммеленом в 1888 г., но в литературе закрепилось как уравнение Фрейндлиха. Оно хорошо описывает многие сорбционные процессы, хотя и не позволяет найти предельную величину максимальной адсорбции.
Уравнение Ленгмюра для мономолекулярной адсорбции записывают в следующем виде:
![]()
где Q— количество адсорбированного вещества на 1 г адсорбента; С - равновесная концентрация; C—константа равновесия; Qmax — максимальное количество вещества, адсорбируемое адсорбентом, его сорбционная емкость.
При изучении процессов поглощения почвами катионов, анионов, неполярных молекул широко используют представление о специфической и неспецифической адсорбции. Различие между ними определяется характером связи поглощенных почвой веществ с активными адсорбционными центрами на поверхностях твердых фаз.
Неспецифическая адсорбция обусловлена слабыми молекулярными (вандерваальсовыми и кулоновскими электростатическими, силами). Электрическое взаимодействие характерно для классического варианта ионного обмена, когда удерживаемые за счет электростатического взаимодействия катионы и анионы легко обмениваются на катионы и анионы равновесного почвенного раствора.
Такое
взаимодействие характерно в чистом
виде для катионов Nа+,
Сs+,
частично для К+,
Са2+,
Мg2+,
Ва2+,
а также для таких анионов, как Сl-
и NO![]() .Большинство
важнейших анионов (Н2РО
.Большинство
важнейших анионов (Н2РО![]() ,
НРО
,
НРО![]() ,SО
,SО![]() ,SеO
,SеO![]() ,F-),
катионы щелочно-земельных металлов,
катионы и гидроксиды практически всех
тяжелых металлов в значительной мере
или полностью поглощаются по механизму
специфической
адсорбции. Это
означает, что при таком взаимодействии
образуются значительно более прочные
координационные и ковалентные связи с
поверхностными соединениями или
группами. Иногда отмечают, что хемосорбция
отличается образованием еще более
прочных связей. Связанные по механизму
специфической адсорбции ионы не удается
вытеснить катионами и анионами нейтральных
солей по типу обычных реакций ионного
обмена. При специфической адсорбции
может поглощаться значительно большее
количество ионов, чем это вытекает из
ЕКО и уравнений обмена, причем уровень
поглощения сильно зависит от рН.
,F-),
катионы щелочно-земельных металлов,
катионы и гидроксиды практически всех
тяжелых металлов в значительной мере
или полностью поглощаются по механизму
специфической
адсорбции. Это
означает, что при таком взаимодействии
образуются значительно более прочные
координационные и ковалентные связи с
поверхностными соединениями или
группами. Иногда отмечают, что хемосорбция
отличается образованием еще более
прочных связей. Связанные по механизму
специфической адсорбции ионы не удается
вытеснить катионами и анионами нейтральных
солей по типу обычных реакций ионного
обмена. При специфической адсорбции
может поглощаться значительно большее
количество ионов, чем это вытекает из
ЕКО и уравнений обмена, причем уровень
поглощения сильно зависит от рН.
Специфически
могут связываться также ионы К+
и NН![]() ,
в том числе в межпакетных пространствах
минералов с расширяющейся решеткой, а
также гидроксокомплексы катионов многих
металлов. Все это осложняет анализ
количественных закономерностей реакций
ионного обмена.
,
в том числе в межпакетных пространствах
минералов с расширяющейся решеткой, а
также гидроксокомплексы катионов многих
металлов. Все это осложняет анализ
количественных закономерностей реакций
ионного обмена.
Лекции №7 СРСП №7
Соединения алюминия и проблема почвенной кислотности
Из элементов III группы периодической системы элементов Д.И. Менделеева только алюминий содержится в почвах в макроколичествах и играет важную конституционную роль. Остальные элементы могут быть отнесены к группе микро- и ультрамикроэлементов; в их числе существенное физиологическое и сельскохозяйственное значение имеет бор.
Среднее содержание А1 в земной коре составляет около 8 % (массовых); по А.Е. Ферсману — 7,45 %, по А.П. Виноградову — 8,05 %. Для алюминия характерна отчетливо выраженная концентрационная дифференциация в зависимости от породы. Ультраосновные породы содержат в среднем около 0,45 % А1, а в осадочных породах (глинах, сланцах) оно возрастает до 10—11 %. Кислые, средние и основные породы (граниты, диориты, базальты и т. п.) занимают промежуточное положение — 7—9 %.
В океанических водах концентрация А1 близка к 0,01 мг/л. В речных и озерных водах содержание алюминия несколько выше — 0,02—0,03 мг/л, а в щелочных водах при рН 9—11 концентрация его может достигать 0,5—0,7 мг/л. Наиболее высокая концентрация была найдена в подземных водах — до нескольких миллиграммов в литре.
В живых организмах в среднем содержится 5 • 10-3 % А1; в золе растений содержание его довольно высоко и может составлять до 1,4%.
На общий фоновый уровень содержания алюминия существенный отпечаток накладывает процесс почвообразования. В зависимости от типа почвы меняется как среднее содержание Аl в почвенной толще, так и его распределение по генетическим горизонтам. Повышено содержание Аl в бурых лесных суглинистых почвах до 8—9 %, в красноземах — до 14—15 %, а в латеритах содержание Аl2Оз может составлять до 50 % всей массы почвы (или около 26 % Аl). Столь высокое содержание Аl2O3 характерно для бокситов наиболее высоких промышленных марок (не менее 52 % А12О3; наиболее низкая промышленная марка боксита характеризуется содержанием А12О3 не менее 28 %).
Равномерное распределение А1 по профилю характерно для многих степных почв, особенно для черноземов. Значение алюминия в почвообразовании и плодородии почв определяется следующими положениями.
1. Высокое содержание А1 в почвах и его участие в формировании алюмосиликатов обусловливает его ведущую наряду с Si, О и С конституционную роль. Следует упомянуть, что алюмосиликаты — наиболее распространенные минералы, составляющие до 85 % массы земной коры. При этом какое-либо специфическое влияние Аl на морфологические признаки почв не выражено.
2. Алюминий обладает достаточно высокой реакционной и миграционной способностью и образует многообразные формы соединений. Он активно участвует в перераспределении вещества по почвенному профилю, а его соединения и их распределение по профилю могут быть использованы для диагностики почв и некоторых процессов.
3. Алюминий участвует в формировании потенциальной (обменной и гидролитической) кислотности почв.
4. Для растений небезразлично повышенное содержание подвижных соединений А1; в их присутствии образуются труднорастворимые фосфаты алюминия, фосфор которых при старении и кристаллизации осадков становится малодоступным растениям. Кроме того, алюминий токсичен для многих растений; уже при концентрации А1 в растворе около 2 мг/л наблюдается резкое ухудшение развития корневой системы, нарушается углеводный, азотный и фосфатный обмен в растениях. Более высокие концентрации алюминия вызывают резкое снижение урожая зерновых культур и даже их гибель.
Поведение А1 в почве обусловлено его положением в периодической системе элементов Д.И. Менделеева. Находясь в III группе периодической системы, алюминий имеет следующее распределение электронов в атоме:1s22р63s23р1.
Во всех встречающихся в почвах соединениях алюминий трехвалентен, хотя в очень жестких лабораторных условиях могут быть получены соединения, в которых А1 проявляет валентность 1+ и 2+.
Соединения алюминия
Алюминий в почвах представлен соединениями с резко различной растворимостью, а для почв гумидных областей (подзолистые, дерново-подзолистые, болотные, красноземные) характерно присутствие не только легкорастворимого, но и обменного алюминия. Обменный А1 присутствует обычно в количестве от десятых долей до 3—10 мг-экв/100 г почвы (т. е. от единиц до нескольких десятков миллиграммов на 100 г почвы).
Соединения алюминия в почвах очень разнообразны. Это оксиды и гидроксиды алюминия; содержащие алюминий минералы-соли; простые и комплексные соединения А1 с органическими веществами и, наконец, алюмосиликаты.
Оксид алюминия А12О3 встречается в породах в виде корунда, отличающегося высокой твердостью и устойчивостью к кислотам. Корунд имеет серую с синеватым или желтоватым оттенком окраску, но примеси Сr, Мn, Fе, Тi придают ему интенсивную красную, синюю или черную окраску. Окрашенные разновидности корунда относятся к числу известных драгоценных камней: сапфир, рубин, топаз и т. п. Корунд встречается в бокситах, сиенитах, пироксенитах, сланцах, гнейсах.
Несмотря на его устойчивость к кислотам в природной обстановке, корунд, по-видимому, постепенно трансформируется в диаспор или гиббсит.
Чаще других в почвах встречается гиббсит (или гидраргиллит) — А1(ОН)3, кристаллическая решетка которого построена из слоев алюмогидроксильных октаэдров (рис. 1). Формулу гиббсита иногда формально записывают в виде А12О3 • 3Н2О. Гидроксид алюминия может находиться в почвах как в окристаллизованном, так и в аморфном состоянии. Свежеосажденный Аl(ОН)3 не обнаруживает признаков кристаллического строения. В почвах и породах гиббсит образует шестиугольно-таблитчатые кристаллы правильной или неправильной формы, друзы, а также натечные формы и конкреции.
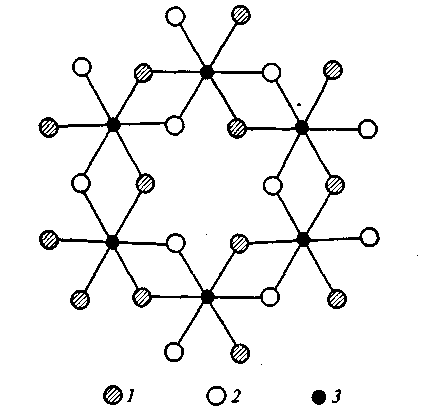
Рис. 1. Схема структуры гиббсита: 1— ОН, расположенные ниже плоскости чертежа; 2— ОН, расположенные выше плоскости чертежа; 3 — А1
Совместно с гиббситом или независимо от него встречается бёмит — γ-АlOОН и диаспор α-А1ООН (или НА1О2). Иногда в литературе можно встретить формальное написание формулы бёмита и диаспора в виде А12О3 • Н2О. Эти минералы более характерны для бокситов и древних аллитизированных тропических почв.
В природной обстановке образуются и в некоторых условиях накапливаются минералы-соли, содержащие алюминий. В почвенной среде такие соединения алюминия за небольшим исключением неустойчивы.
При испарении природных водных растворов образуются квасцы КА1(SО4)2 • 12Н2О. В кислых породах при воздействии сернистых газов образуется и накапливается квасцовый камень алунит КА13(SО4)2(ОН)6. В пегматитах и гнейсах встречается криолит Na3А1F6. Квасцы хорошо растворимы в воде, криолит хотя и слабо (порядка 0,03 %), но все же растворим, и поэтому, попадая в почву, такие минералы очень быстро трансформируются, переходя главным образом в различные гидроксиды.
Преобладающая часть алюминия в большинстве почв представлена силикатами, причем они являются и наиболее устойчивыми соединениями.
В числе силикатов, встречающихся в почвах, следует назвать безводные силикаты алюминия: силлиманит и дистен (или кианит). Состав этих минералов может быть выражен общей формулой Аl2SiO5 (иногда записывают в виде АlO • АlSiO4), различаются они формой кристаллизации. Эти минералы более характерны для метаморфических пород, в почвах сравнительно редки.
В крупных гранулометрических фракциях алюминий представлен различными ортосиликатами и полисиликатами. Для почв характерны мусковит, эпидот, микроклин, ортоклаз; плагиоклазы — альбит, анортит и промежуточные формы.
В тонкодисперсных фракциях почв алюминий, кроме оксидов и гидроксидов, представлен и слоистыми силикатами (их часто называют глинистыми или глинными минералами).
Многообразие форм соединений алюминия в почвах, как, впрочем, и ряда других элементов, делает практически невозможной и нецелесообразной попытку определения всех индивидуальных веществ, которые присутствуют в конкретной почве и содержат алюминий. Значительно удобнее и эффективнее использовать определение групп соединений, понимая под группой совокупность входящих в состав почвы веществ, обладающих одним или несколькими сходными (однотипными) свойствами.
По С.В. Зонну, различают следующие группы соединений алюминия:
1) силикатный алюминий, входящий в кристаллическую решетку алюмосиликатов;
2) свободный алюминий, не входящий в кристаллическую решетку силикатов. Свободный алюминий, в свою очередь, подразделяется на окристаллизованные и аморфные соединения алюминия.
Силикатный алюминий определяется по разности между валовым содержанием А1 и его количеством, переходящим в вытяжку 1 н. NaОН (по Дюшофуру — Сушье). Окристаллизованные соединения А1 извлекаются из почвы вытяжкой Тамма.
Кроме того, отдельно определяют содержание обменного А1, извлекаемого раствором 1 н. КС1, и так называемый экстрагируемый алюминий, извлекаемый ацетатно-аммонийным буферным раствором с рН 4,8.
Концентрация и состав соединений алюминия в почвенном растворе регулируются главным образом степенью кислотности или щелочности раствора.
Гидроксид алюминия проявляет типичные амфотерные свойства. В достаточно кислой среде он растворяется с образованием соли, содержащей катион алюминия А13+:
А1(ОН)3 + 3НС1 → А1С13 + 3Н2О
В щелочной среде образуются алюминаты. При реакции гидроксида алюминия с избытком щелочи образуются гидроксоалюминаты:
А1(ОН)3 + NаОН → Nа[А1(ОН)4]
Соли метаалюминиевой кислоты НА1О2 — метаалюминаты — образуются при сплавлении оксида алюминия со щелочью:
А12О3 + 2КОН → 2КА1O2 + Н2О
В
промежуточном интервале рН в растворе
присутствуют различные частицы
алюминия: А13+
(или Аl(Н2О)![]() ),А1OН2+,
А1(ОН)
),А1OН2+,
А1(ОН)![]() ,
А1(ОН)3,
А1(ОН)
,
А1(ОН)3,
А1(ОН)![]() .
.
Все эти особенности позволяют записать реакцию растворения гидроксида алюминия в следующей общей форме:
qА1(ОН)3(тверд)
↔Аlq(ОН)![]() +nОН-,
+nОН-,
где q выражает степень полимеризации соответствующих ионов, а n — их заряд. Соответствующую константу реакции К можно записать в виде
K=
где квадратные скобки означают активности компонентов. Принимая, что активность гидроксида в твердой фазе равна единице, и обозначая отрицательный логарифм символом р, получим
рК=р![]()
Концентрация А1 в почвенном растворе обусловлена веществами, которые находятся в твердых фазах. Наибольшей растворимостью обладает свежеосажденный гидроксид алюминия А1(ОН)3; растворимость минералов (пород) уменьшается в ряду
А1(ОН)з > гиббсит = боксит > диаспор.
При растворении любых алюминийсодержащих минералов — гиббсита, бёмита, диаспора — переходящие в раствор ионы алюминия образуют осадок А1(ОН)3, если будет достигнуто соответствующее произведение растворимости. Тогда концентрация А1 в растворе будет отвечать растворимости свежеосажденного А1(ОН)3. Поскольку в водной среде всегда имеются гидроксильные ионы, а значение рН почвенных растворов ниже 4 встречается редко, то для алюминия регулирующим концентрацию компонентом является преимущественно А1(ОН)3.
Исходя из изложенных выше представлений можно сделать заключение о способности алюминия к миграции в почвенном профиле и о формах, в которых алюминий реально может мигрировать.
Возьмем за основу гидроксид алюминия, произведение растворимости которого равно 5 • 10-33. Величина ПР позволяет вычислить концентрацию ионов А13+ при любых значениях рН.
По Л.Н. Александровой, алюминий образует комплексные соли гумусовыми кислотами, входя при этом в анионную часть молекулы. Формулы таких соединений могут быть записаны в следующем виде'
![]() или
или
![]()
Участие карбоксильных групп гумусовых кислот в образовании таких соединений подтверждено Л.Н. Александровой прямым определением их количества в соответствующих соединениях.
По Л.Н. Александровой, часть алюминия, входящего в состав алюмогуминовых соединений, не способна к обменным реакциям, а часть вытесняется катионом нейтральной соли. Это говорит о двойственной природе алюминия в алюмогуминовых соединениях: часть алюминия входит во внутреннюю сферу молекулы и не способна к реакциям обмена катионов, другая часть алюминия замещает водород функциональных групп и вступает в реакции катионного обмена. Это можно иллюстрировать общей формулой вида:

Экспериментальные данные показывают, что при участии А1 как и Fе, возможны реакции трех типов:
1) участие в реакции одной карбоксильной группы СООН и одной фенольной группы ОН:

где R — радикал гуминовои кислоты;
2) участие в реакции двух карбоксильных групп:

3) участие только одной карбоксильной группы, способной занимать два координационных места:
ВИДЫ ПОЧВЕННОЙ КИСЛОТНОСТИ
Одна из важнейших функций алюминия в почвах связана с формированием почвенной кислотности; выяснение вопроса о природе почвенной кислотности и роли алюминия в ее проявлении вызвало одну из наиболее острых и длительных дискуссий по проблемам химии почв.
Кислотность почв проявляется в разных формах и обусловлена помимо алюминия другими элементами и соединениями. В настоящее время различают следующие формы или виды почвенной кислотности: 1) актуальная кислотность; 2) потенциальная кислотность, которая подразделяется на обменную и гидролитическую кислотность.
Актуальная кислотность. Эта форма кислотности наиболее проста для понимания; так называют кислотность почвенного раствора, обусловленную растворенными в нем компонентами.
На практике редко измеряют рН почвенного раствора. Вместо этого анализируют водные вытяжки или водные суспензии почв. Согласно решению II Международного конгресса почвоведов, водные вытяжки и суспензии для измерения рН готовят при отношении почва : вода, равном 1 : 2,5. Для торфянистых почв и торфов это отношение расширяют до 1 : 25.
Степень кислотности почвенных растворов, вытяжек и суспензий оценивают величиной рН, количество кислотности — по содержанию титруемых щелочью веществ, обладающих кислотными свойствами.
Кислотность почвенных растворов обусловлена присутствием свободных органических кислот или других органических соединений, содержащих кислые функциональные группы, свободных минеральных кислот (главным образом угольной кислоты), а также других компонентов, проявляющих кислотные свойства. В числе последних наибольшее влияние оказывают ионы А13+ и Ре3+, причем их кислотные свойства соизмеримы с кислотными свойствами таких кислот, как угольная и уксусная.
По данным И.Н. Скрынниковой, в кислых почвенных растворах дерново-подзолистых почв содержатся:
• свободные нелетучие органические кислоты;
• соли сильных оснований и слабых органических кислот;
• свободный СО2 и соли угольной кислоты;
• аммонийные соли слабых органических кислот. Сочетание этих компонентов в почвенных растворах обусловливает значение рН в интервале 4,2—6,8.
Лекции №8 СРСП №8
Элементы IV группы и соединения кремния в почвах.
