
Физика / ЛЕКЦИИ_1-ый_семестр / 2_МОЛ_ТЕРМОДИНАМИКА / ЛК_№10_Теплота_давление
.doc
РАЗДЕЛ II. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Тема 1. Газы, теплота, давление.
Лекция №10
1. Основные состояния вещества.
2. Теплота как форма энергии, температура.
3. Давление идеального газа.
1. Основные состояния вещества.
В отличие от механики, которая изучает движение отдельных частиц или тел под действием различных сил, молекулярная физика имеет дело со свойствами вещества.
Можно выделить три наиболее характерных состояния, в которых может находиться вещество, — твердое, жидкое и газообразное.
Определение 1.
Макроскопические свойства — это свойства тела, рассматриваемые без учета его внутренней структуры.
Как проявление макроскопических свойств рассмотрим существование твердого, жидкого и газообразного состояний.
Из механики известно, что
-
минимум потенциальной энергии частицы U(r) отвечает положению её устойчивого равновесия;
-
величина кинетической энергии T служит мерой движения частицы.
Таким образом, в зависимости от соотношения между величинами потенциальной и кинетической энергий частица будет или «привязана» к определенной области пространства, или совершать свободное движение.
Н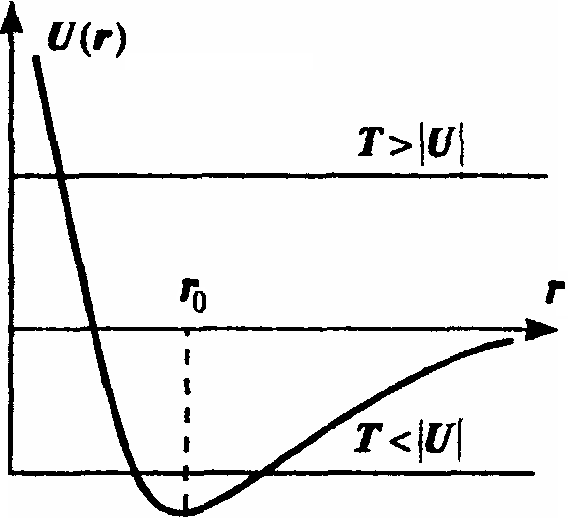 а
графике изображена характерная кривая
потенциальной энергии частицы во внешнем
поле центра притяжения, имеющая глубокий
минимум в точке r0.
а
графике изображена характерная кривая
потенциальной энергии частицы во внешнем
поле центра притяжения, имеющая глубокий
минимум в точке r0.
Эта кривая отвечает взаимодействию частицы с полем, которое приводит к притяжению частицы на больших расстояниях (r > r0) и к отталкиванию на малых (r < r0).
Двумя прямыми изображены возможные значения полной энергии частицы E = T + U .
В первом случае T >> |U| и частица не может покинуть «потенциальную яму» — эта ситуация отвечает случаю твердого тела.
Во втором случае, когда T >> |U|, частица свободно покидает яму — имеет место случай газа частиц.
Промежуточный случай отвечает жидкости.
Макроскопические свойства тела определяются суммарными и усредненными по большому числу частиц величинами. Такой способ описания является статистическим.
Определение 2.
Макроскопические характеристики системы, вычисляемые методами математической статистики, называются термодинамическими переменными.
Пользуясь термодинамическими переменными, можно изучать процессы передачи и преобразования энергии в физических объектах, не обращаясь к микроскопической картине.
2.Теплота как форма энергии. Температура.
Беспорядочное движение микроскопических частиц связано с содержанием в веществе особой формы энергии — теплоты . Эта связь достаточно очевидна на примере зависимости броуновского движения от количества сообщенного телу тепла.
Макроскопическая характеристика теплового движения — температура.
Определение 1.
Температура есть мера содержащегося в теле теплоты.
Рассматривая теплоту как форму энергии, необходимо связать ее с кинетической энергией частиц.
Следует помнить, что температура — это макроскопическая характеристика тела, т. е. термодинамическая переменная, поэтому она должна быть связана со средней кинетической энергией, приходящейся на одну частицу в системе большого числа частиц.
Среднюю
кинетическую энергию одинаковых частиц
в системе, состоящей из N
частиц,
обозначим через
![]() и определим ее
следующим образом:
и определим ее
следующим образом:
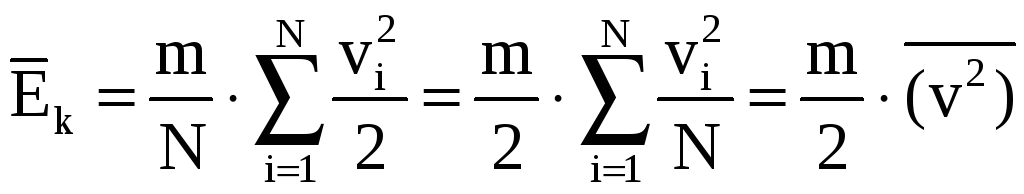 ,
(1)
,
(1)
где
![]() средняя
величина квадрата скорости.
средняя
величина квадрата скорости.
Как следует из статистического анализа, температура
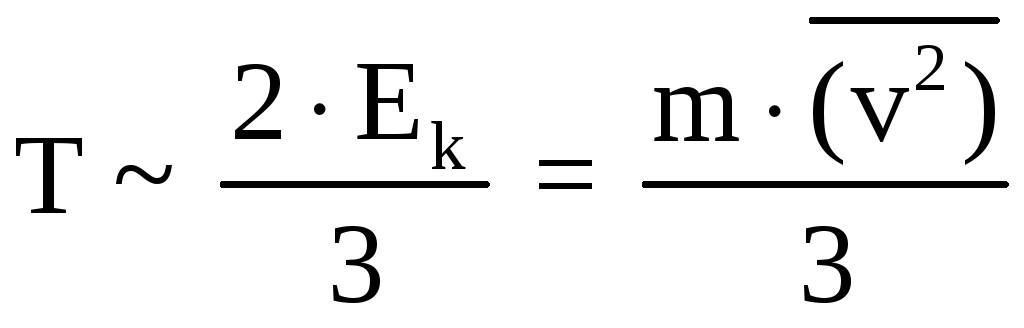 .
(2)
.
(2)
Для того чтобы выразить температуру в градусах, нужно ввести коэффициент пропорциональности, показывающий, сколько джоулей соответствует одному градусу.
Определение 2.
Коэффициент
пропорциональности,
показывающий, сколько джоулей соответствует
одному градусу, называется постоянной
Больцмана
–
![]() Дж/К,
где К
означает градус Кельвина — единицу
измерения температуры, используемую в
физической шкале.
Дж/К,
где К
означает градус Кельвина — единицу
измерения температуры, используемую в
физической шкале.
Теперь соотношение между температурой в градусах и энергией в джоулях запишется в виде:
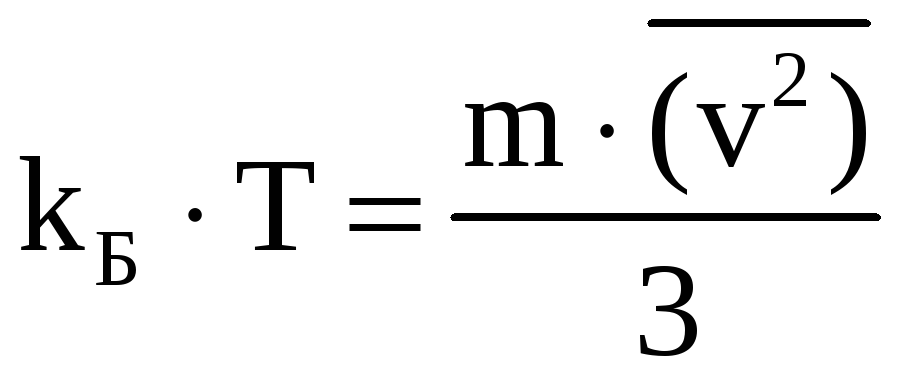 или
или
![]() .
(3)
.
(3)
Определение 3.
Шкала температур называется абсолютной шкалой, или шкалой Кельвина, по которой температура замерзания воды по Цельсию – 0°С, соответствует +273,15 градусов Кельвина (обозначается 273,15 К).
Определение 4.
Температурой абсолютного нуля называется температура, при которой прекращается всякое тепловое движение частиц в веществе (согласно выражению (3) при T = 0!) .
Примечание. Понятие температуры тела приобретает смысл в том случае, если обмен теплом между телом и прибором в процессе измерения температуры мало изменяет состояние тела.
3. Давление идеального газа.
Закономерности процессов в газах удобно рассматривать на примере идеального газа.
Определение 1.
Идеальным газом называется газ, частицы которого можно считать материальными точками, дальние взаимодействия между которыми пренебрежимо малы, а столкновения между собой и стенками ограничивающих сосудов можно описать законами соударения упругих шаров.
Определение 2.
Абсолютно упругим ударом называется столкновение, при котором сохраняется механическая энергия системы тел. При абсолютно упругом ударе наряду с законом сохранения импульса выполняется закон сохранения механической энергии.
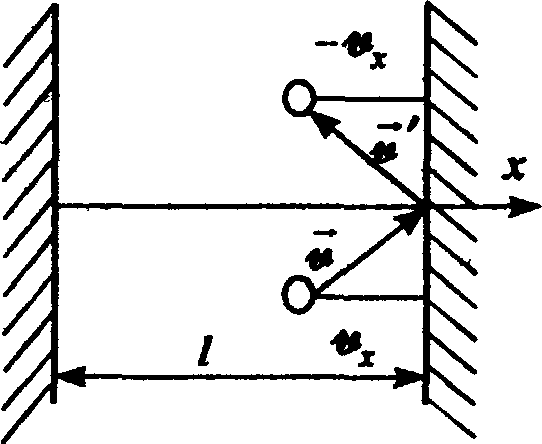 Пусть
в прямоугольном сосуде находится N
молекул
идеального газа. Примем,что при отражении
от стенки скорость молекулы не меняется
по величине, но меняется лишь по
направлению. Если молекула, компонента
скорости которой в направлении оси ОХ
равна
vx,
ударяется о стенку, то после отражения
компонента ее скорости в этом направлении
будет ‑
vx.
Пусть
в прямоугольном сосуде находится N
молекул
идеального газа. Примем,что при отражении
от стенки скорость молекулы не меняется
по величине, но меняется лишь по
направлению. Если молекула, компонента
скорости которой в направлении оси ОХ
равна
vx,
ударяется о стенку, то после отражения
компонента ее скорости в этом направлении
будет ‑
vx.
Для изменения импульса в этом же направлении имеем
px = 2·m·vx.
Долетев
до противоположной стенки, молекула
отразится от нее и снова ударится о
первую стенку. Время между ударами
составит Δt
= 2·/vx,
а число ударов за 1 секунду будет равно
–
![]() .
За 1 секунду молекула сообщит стенке
импульс с компонентой вдоль оси ОХ
–
.
За 1 секунду молекула сообщит стенке
импульс с компонентой вдоль оси ОХ
–
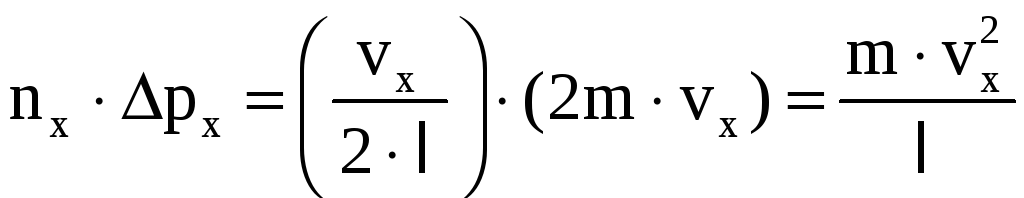 .
.
Но импульс, передаваемый за единицу времени стенке, равен силе, с которой данная молекула действует на стенку. Таким образом, i-я молекула действует на стенку с силой, компонента которой в направлении оси ОХ – Fix = m·v2ix/.
Компонента силы, действующей вдоль оси ОХ со стороны всех частиц, находящихся в сосуде, составит
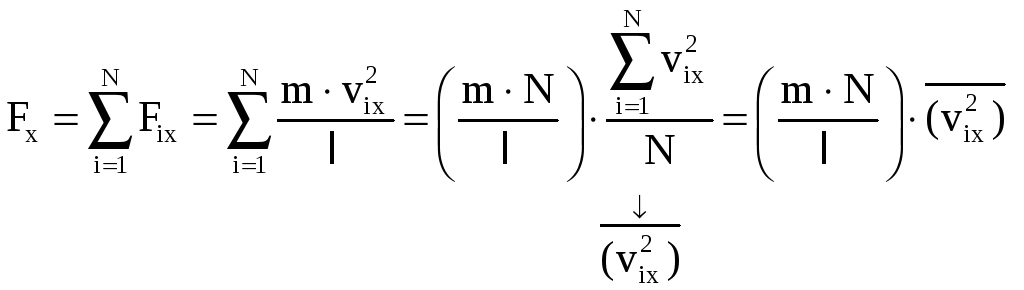 .
(1)
.
(1)
Если
эту силу разделить на площадь стенки
S, то получим
величину давления на стенку. А если
объём сосуда –
![]() ,
то формула для давления на стенки
принимает вид:
,
то формула для давления на стенки
принимает вид:
 .
(2)
.
(2)
Из
выражения (2) следует, что давление газа
на стенку оказалось связанным со средним
квадратом скорости смещения частиц в
направлении нормали к стенке. Если
движения по всем направлениям равноправны,
то можно считать, что
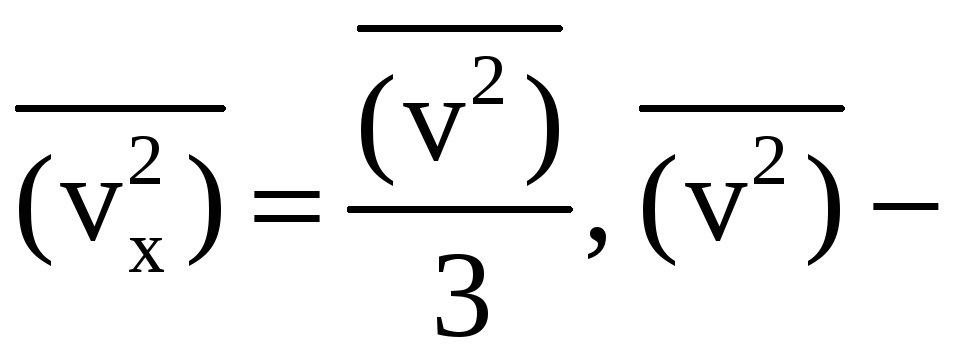 среднённая
скорость по всем направлениям.
среднённая
скорость по всем направлениям.
Теперь выражение для давления принимает вид:
![]() или
или
![]() ,
(3)
,
(3)
где
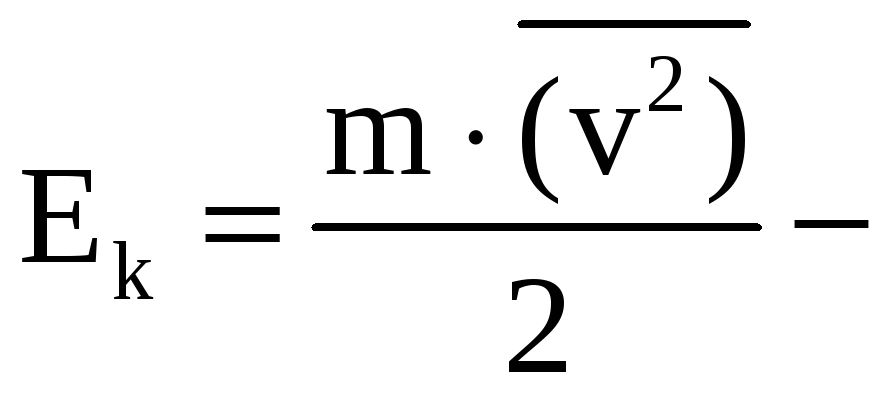 кинетическая
энергия в газе.
кинетическая
энергия в газе.
Это соотношение является одним из основных в
кинетической теории газов!
4.Уравнение состояния идеального газа.
Давление P, объем V и температура T не являются независимыми величинами.
Определение 1.
Соотношение, связывающее давление, температуру и объём, называется уравнением состояния газа, то есть, f (P, V, T) = 0 .
Найдем уравнение состояния идеального газа.
Ранее
указывалось, что
![]() .
Подставляя это соотношение в формулу
для давления, получаем уравнение
состояния
.
Подставляя это соотношение в формулу
для давления, получаем уравнение
состояния
PV = N·kБ·T. (1)
Определение2.
Объём, приходящийся на единицу вещества, называется – МОЛЬ. В 1 моле любого вещества содержится одинаковое число молекул, называемое числом АВОГАДРО – NA=6·1023 молекул.
Число молекул в объеме газа можно записать в виде: N =n ·NA, где n — число молей данного вещества в указанном объеме.
Теперь уравнение (1) запишется в виде:
P·V=n·R·T, (2)
где величина R = kБ·NA называется газовой постоянной.
Примечание. Физический смысл газовой постоянной состоит в том, что она численно равна работе, совершенной 1 молем газа при его нагревании на 1 К при постоянном давлении.
______________________________________________________________________________
Действительно, пусть при нагревании газа на 1 К объем, занимаемый 1 молем газа, изменился при неизменном давлении на ΔV. Представляя давление газа в виде P = F/S, а объем сосуда в виде ΔV =S · h , видим, что величина P · ΔV = F·h есть работа, произведенная газом при его расширении, газовой постоянная численно равна работе, совершенной 1 молем газа при его нагревании на 1 К при постоянном давлении.
