
Физика / ЛЕКЦИИ_1-ый_семестр / 2_МОЛ_ТЕРМОДИНАМИКА / ЛК_№14-Энтропия_Свойства_жидкости
.doc
Тема 2. Энтропия. Жидкости.
Лекция №13
1. Энтропия, второе начало термодинамики, пример расчёта.
2. Основные свойства жидкостей.
3. Поверхностное натяжение в жидкостях, смачивание.
1.Энтропия, второе начало термодинамики, пример расчёта.
Мы убедились, что КПД необратимого кругового процесса всегда меньше, чем КПД при обратимом цикле. Этот результат можно сформулировать в следующем виде:
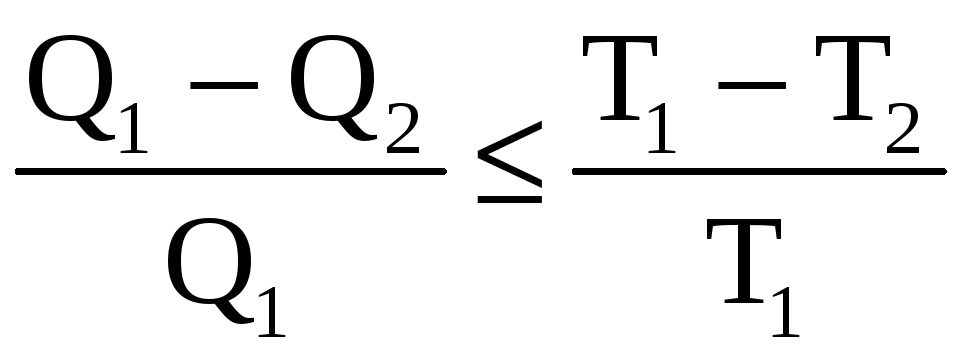 .
.
Знак равенства соответствует случаю обратимых процессов. Отсюда нетрудно получить соотношение, которое играет важную роль в термодинамике:
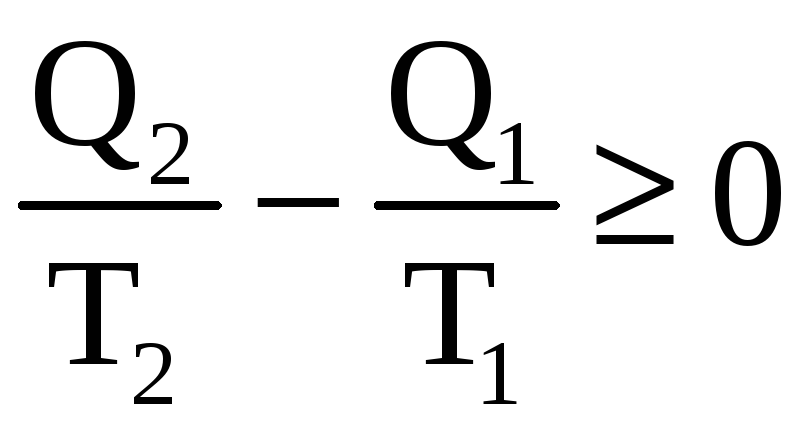 . (1)
. (1)
Определение 1.
Функция
состояния системы, определяемая как
отношение количества теплоты, сообщаемого
системе, к абсолютной температуре
последней называется энтропией,
то есть
![]() .
.
Энтропия,
как видно из полученного соотношения,
при обратимом
процессе остается неизменной
![]()
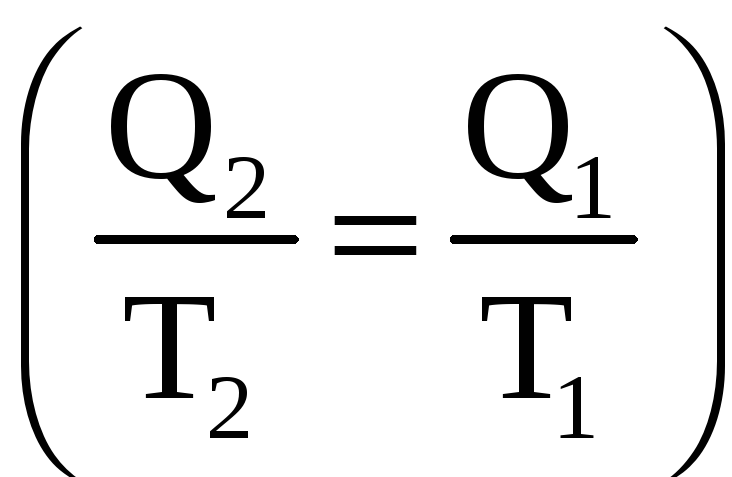 и возрастает
и возрастает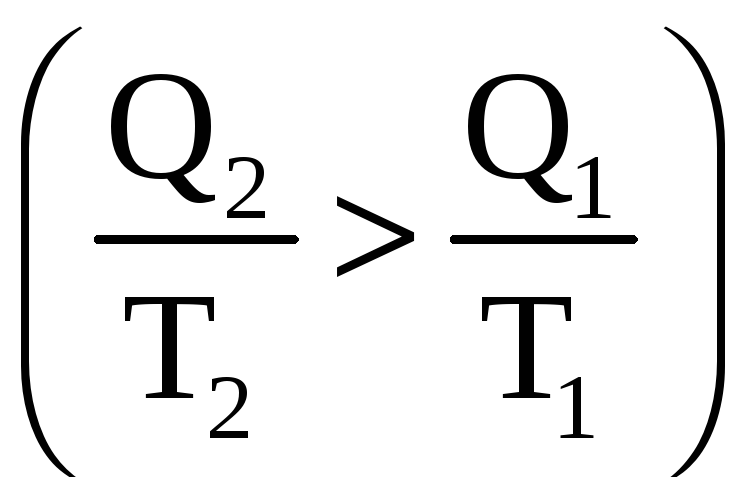 ,
если термодинамический процесс необратим.
,
если термодинамический процесс необратим.
Энтропия — важная термодинамическая характеристика системы, позволяющее сформулировать второе начало термодинамики:
«При необратимых процессах энтропия замкнутой системы может только возрастать.»
Возрастание энтропии системы при необратимом процессе выражает тот факт, что тепло само по себе не может переходить от менее нагретых к более нагретым телам. Последнее утверждение можно рассматривать также как пример формулировки второго начала термодинамики.
Из изложенного следуют важные выводы.
-
Невозможность создания вечного двигателя.
Поскольку КПД реальной тепловой машины всегда меньше, чем КПД идеальной машины (работающей по циклу Карно), а обязательным условием работы последней является необходимость отдавать тепло более холодному телу, становится очевидной невозможность создания так называемого вечного двигателя второго рода — устройства, одновременно превращающего все полученное тепло в механическую работу, то есть, осуществляющего полный круговорот тепла в природе.
-
Состояние равновесия – это состояние полного беспорядка, а неравновесное состояние – это состояние с направленным упорядоченным движением.
Рассмотрим, что представляет собой состояние термодинамического равновесия.
В состоянии равновесия система однородна. Все её средние характеристики одинаковы. Равновесная система изотропна. В системе не существует направленного потока какой-либо физической величины. Иными словами, все частицы совершают полностью хаотическое тепловое движение. Таким образом, состояние равновесия, с точки зрения статистической физики, представляет собой состояние полного беспорядка, в то время как состояние, отличное от равновесного, характеризуется существованием в системе направленного, т. е. упорядоченного движения. Указанное отличие равновесного состояния от неравновесного дает возможность рассматривать энтропию как количественную меру беспорядка, существующего в системе.
Пример расчёта энтропии.
Определить изменение энтропии одного моля идеального газа для заданного интервала изменения переменного параметра в
-
изобарном (
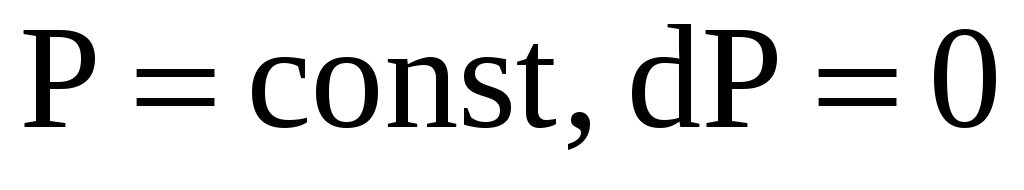 ),
),
-
изохорном (
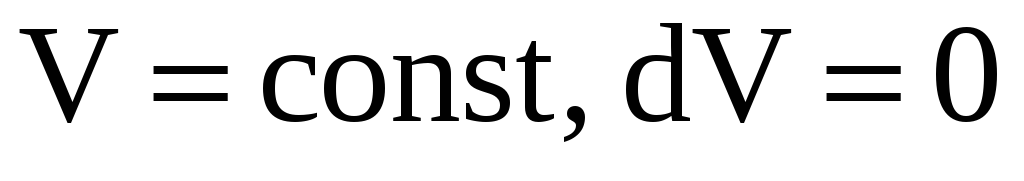 )процессах.
)процессах.
Решение.
Физическая система – один моль идеального газа участвует в двух изопроцессах.
«Элементарное» изменение энтропии на основе определения можно записать в виде формулы:
![]() .
.
-
В изобарном процессе давление есть величина постоянная, но температура изменяется в интервале
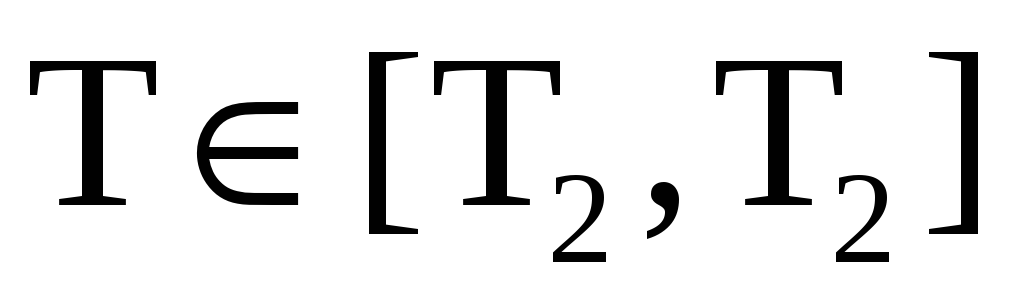 .
Следовательно,
.
Следовательно,
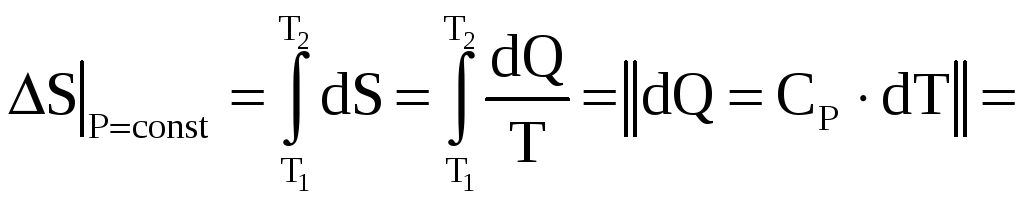
(![]() теплоёмкость
при постоянстве давления)
теплоёмкость
при постоянстве давления)
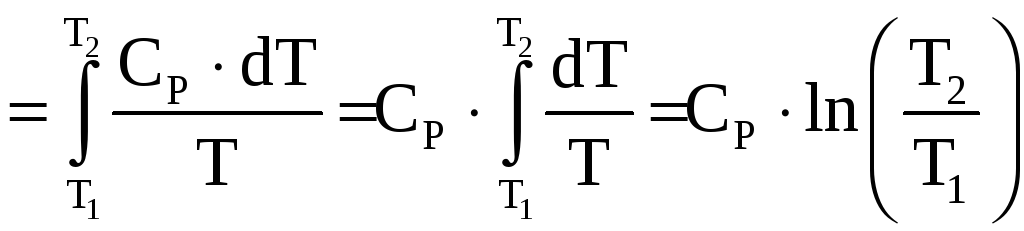 .
.
-
В изохорном процессе объём есть величина постоянная, но температура изменяется в интервале
 .
Следовательно,
.
Следовательно,
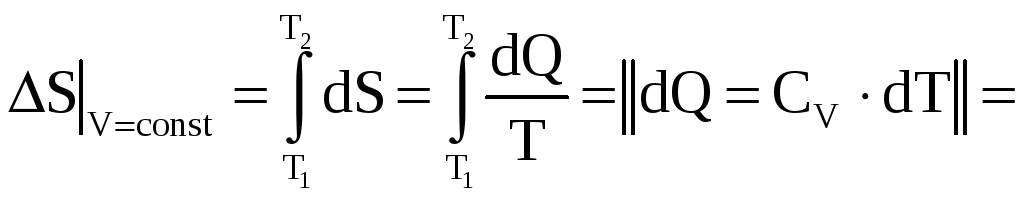
(![]() теплоёмкость
при постоянстве объёма)
теплоёмкость
при постоянстве объёма)
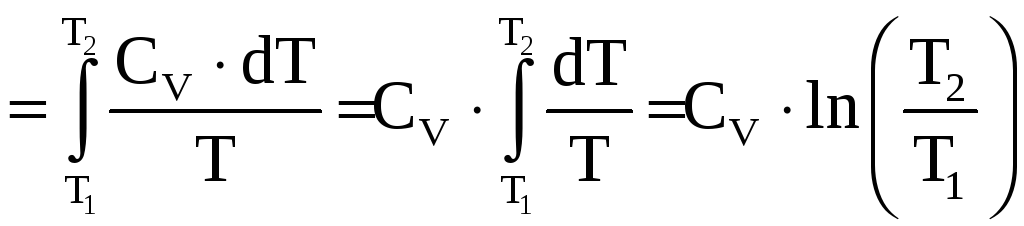 .
.
Ответ: изменения энтропий в рассмотренных изопроцессах
отличаются только значениями теплоёмкостей!
2. Основные свойства жидкостей.
Определение 1.
Жидкость – это агрегатное состояние вещества, промежуточное между газообразным и твердым , обладающее свойствами как газообразных, так и твердых веществ.
Жидкости, подобно твердым телам, обладают определенным объемом, а подобно газам, принимают форму сосуда, в котором они находятся. Рентгеноструктурный анализ жидкостей показал, что характер расположения частиц жидкости промежуточен между газом и твердым телом.
В газах молекулы движутся хаотично, поэтому нет никакой закономерности в их взаимном расположении.
Для твердых тел наблюдается так называемый дальний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на больших расстояниях.
В жидкостях имеет место так называемый ближний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на расстояниях, сравнимых с межатомными.
3. Поверхностное натяжение в жидкостях, смачивание.
На каждую молекулу жидкости со стороны окружающих молекул действуют силы притяжения, быстро убывающие с расстоянием, следовательно, начиная с некоторого минимального расстояния силами притяжения между молекулами можно пренебречь (порядка ~ 10 – 9 м) .
Определение 1.
Расстояние, на котором силами притяжения между молекулами можно пренебречь, называется радиусом молекулярного действия r, а сфера радиуса r — сферой молекулярного действия.
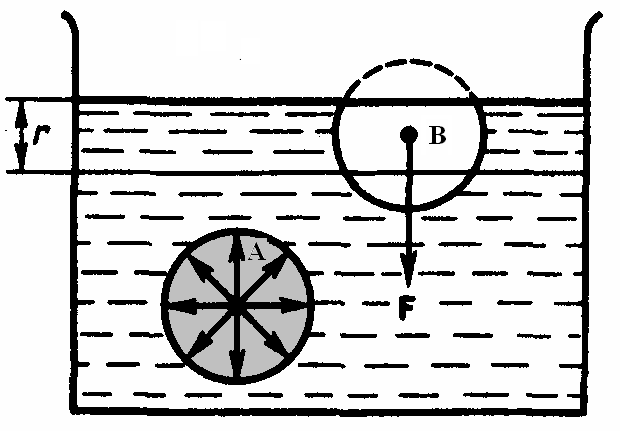
Рассмотрим две ситуации.
1.Молекула полностью внутри жидкости.
Как показано на рисунке слева, на выделенную произвольную молекулу А действуют силы со стороны только тех молекул, которые находятся внутри сферы молекулярного действия с радиусом – r. Эти силы направлены в разные стороны, в среднем скомпенсированы, и поэтому их результирующая величина будет равна нулю.
2. Молекула в поверхностном слое жидкости.
Молекула В,
расположена от поверхности на расстоянии,
меньшем r,
то есть сфера молекулярного действия
лишь частично расположена внутри
жидкости. Силы, дейтсвующие на молекулу
В,
не скомпенсированы. Их
равнодействующая
![]() и направлена внутрь жидкости.
и направлена внутрь жидкости.
Таким образом, результирующие силы всех молекул поверхностного слоя оказывают на жидкость давление, называемое молекулярным (или внутренним).
Энергия, которой обладают молекулы в поверхностном слое жидкости, называемая поверхностной энергией, пропорциональна площади слоя S:
![]() , (1)
, (1)
где коэффициент пропорциональности – называется поверхностным натяжением.
Идеализируя, поверхностный слой жидкости можно уподобить растянутой упругой пленке, в которой действуют силы натяжения (рисунок слева!).
Р ассмотрим
поверхность жидкости с формой замкнутого
контура в в поперечном сечении.
ассмотрим
поверхность жидкости с формой замкнутого
контура в в поперечном сечении.
Под действием сил поверхностного натяжения рассматриваемый контур переместился в положение, отмеченное пунктиром.
Силы, действующие со стороны выделенного участка на граничащие с ним участки, совершают работу
![]() ,
(2)
,
(2)
где f — сила поверхностного натяжения, действующая на единицу длины контура поверхности жидкости.
Эта работа совершается за счет уменьшения поверхностной энергии, т. е.
![]()
![]() .
(3)
.
(3)
Из (3) следует, что поверхностное натяжение
равно силе поверхностного натяжения
![]() ,
приходящейся на единицу длины контура,
ограничивающего поверхность.
,
приходящейся на единицу длины контура,
ограничивающего поверхность.
Единица поверхностного натяжения — [Н/м] или [Дж/м2] .
Большинство жидкостей при температуре 300 К имеет поверхностное натяжение порядка 10–2—10–1 Н/м. Поверхностное натяжение с повышением температуры уменьшается, так как увеличиваются средние расстояния между молекулами жидкости.
Поверхностное натяжение существенным образом зависит от примесей, имеющихся в жидкостях. Вещества, ослабляющие поверхностное натяжение жидкости, называются пoвеpxностно-активными. Наиболее известным поверхностно-активным веществом по отношению х воде является мыло. Оно сильно уменьшает ее поверхностное натяжение (примерно с 7,5 •10–2 до 4,5 • 10–2 Н/м). Поверхностно-активными веществами, понижающими поверхностное натяжение воды, являются также спирты, эфиры, нефть и др.
Существуют вещества (сахар, соль), которые увеличивают поверхностное натяжение жидкости благодаря тому, что их молекулы взаимодействуют с молекулами жидкости сильнее, чем молекулы жидкости между собой. Например, если посолить мыльный раствор, то в поверхностный слой жидкости выталкивается молекул мыла больше, чем в пресной воде. В мыловаренной технике мыло «высаливается» этим способом из раствора.
В заключение несколько слов о физической сущности смачивания.
Из практики известно, что капля воды растекается на стекле, в то время как ртуть на той же поверхности превращается в несколько сплюснутую каплю.
В первом случае говорят, что жидкость смачивает твердую поверхность, во втором — не смачивает ее.
Для смачивающей жидкости силы притяжения между молекулами жидкости и твердого тела больше, чем силы притяжения между молекулами самой жидкости, и жидкость стремится увеличить поверхность соприкосновения с твердым телом.
Для несмачивающей жидкости силы притяжения между молекулами жидкости и твердого тела меньше, чем между молекулами жидкости, и жидкость стремится уменьшить поверхность своего соприкосновения с твердым телом.
