
Общая химия (часть 2, 2012 г
.).pdf
Рис. 54. Кривая титрования сильной кислоты (HCl) сильным основанием (NaOH)
Наоборот, движение справа налево соответствует изменению рН при титровании щелочи кислотой.
Как следует из рисунка 54 общий вид кривой является довольно своеобразным. В начале титрования рН среды по сравнению с исходным его значением изменяется очень медленно, вплоть до расходования более 90% вещества в титруемом растворе. Затем наблюдается более быстрое изменение рН и, наконец, вблизи точки эквивалентности добавление буквально одной капли титранта вызывает резкое (взрывное) изменение величины рН сразу на несколько единиц. Этот участок на кривой титрования называется иначе скачком титрования. Дальнейшее добавление титранта опять сопровождается медленным и плавным изменением рН.
Скачок титрования является самой существенной частью кривой титрования, т.к. на нём всегда лежит точка эквивалентности.
С помощью него осуществляют выбор индикатора, решают некоторые другие вопросы.
Чем больше скачок титрования, тем точнее будут результаты анализа и более широкий выбор индикаторов для его проведения.
На величину скачка титрования влияют, в первую очередь, кислотные и основные свойства исходных веществ, их содержание в растворе, а также температура реакционной среды.
221
Чем более сильными являются используемые кислота и основание, и чем выше их концентрация в растворе, тем скачок титрования больше. Так, при молярной концентрации химического эквивалента НСl и NaOH, равной 0,1 моль/дм3, величина скачка титрования составляет почти 6 единиц рН (рис. 54).
В случае сантимолярных растворов этих же исходных веществ (0,01 моль/дм3) скачок титрования составляет уже 4 единицы рН. Обычно на практике редко используют растворы с концентрацией химического эквивалента вещества больше 0,2 моль/дм3. Это связано с тем, что значительно возрастают ошибки титрования за счёт неточности измерения количественных характеристик (объема, массы растворенной навески) более концентрированных растворов.
Повышение температуры оказывает существенное влияние на скачок титрования в сторону его уменьшения вследствие возрастания константы диссоциации воды. Отсюда следует, что кис- лотно-основное титрование лучше проводить, не прибегая к нагреванию.
Для титрования можно использовать только те индикаторы, интервал перехода которых полностью лежит на скачке титрования. Причём, чем более симметрично он расположен относительно точки эквивалентности, тем более предпочтительным является данный индикатор (в идеале точка эквивалентности должна лежать в середине интерва-
ла перехода). Показатель титрования (рТ) индикатора при этом тоже будет лежать на скачке титрования и может отклониться от точки эквивалентности в ту или иную сторону. Наиболее оптимальным является случай, когда рТ индикатора совпадает на графике с точкой эквивалентности, но это происходит далеко не всегда. В случае несовпадения значений рН для рТ индикатора и точки эквивалентности возникает так называемая индикаторная ошибка, связанная с недотитровыванием части исследуемого раствора или, наоборот, с добавлением небольшого избытка титранта. Однако следует подчеркнуть, что если рТ индикатора лежит внутри скачка титрования, то индикаторная ошибка составляет не более 0,3% и, таким образом, существенно не влияет на результаты анализа.
222

Сопоставляя данные таблицы 20 и вид графика на рис. 54, можно сделать вывод, что при титровании соляной кислоты щёлочью (NаOH) в качестве индикатора можно использовать метиловый оранжевый (рТ≈4) или фенолфталеин (рТ≈9). В первом случае рТ индикатора будет иметь меньшее значение, чем рН в точке эквивалентности, и мы будет немного не дотитровывать кислоту. Во втором случае рТ индикатора лежит выше точки эквивалентности на скачке титрования. Вследствие этого мы добавим щелочи немного больше, чем нужно (другими словами, мы слегка перетитруем исследуемый раствор).
При титровании слабой кислоты (СН3СООН) сильным основанием (NаOH) точка эквивалентности смещается в щелочную область (рН>7) из-за гидролиза образующейся соли (СН3CООNa) и лежит выше линий нейтральности на кривой титрования с проходящим через рН = 7 и параллельной оси абсцисс (рис. 55). Скачок титрования становится менее выраженным. Например, при сравнении с предыдущим случаем (рис. 54) он уменьшается на 3 единицы рН. Уменьшение (сужение) скачка титрования выражено тем сильнее, чем более слабой является исследуемая кислота. Для кислот, имеющих значение (рКа>7), скачок титрования будет практически отсутствовать, т.е. он выродится в точку перегиба на кривой титрования. Такие кислоты нельзя количественно измерить в водном растворе с помощью титриметрии. Необходимо использовать в этом случае неводное титрование, т.е. в растворителе, который бы значительно усилил кислотные свойства слабой кислоты.
Рис. 55. Кривая титрования слабой кислоты (СН3СООН) сильным основанием (NaOH)
223

Как видно из рис. 55, метиловый оранжевый нельзя использовать в качестве индикатора при титровании уксусной кислоты или любой другой слабой кислоты, т.к. его интервал перехода лежит ниже скачка титрования. В противном случае мы будем получать заниженные результаты вследствие недотитровывания исследуемого раствора.
А вот интервал перехода фенолфталеина лежит внутри скачка титрования, поэтому его можно применять в качестве индикатора при титровании слабой кислоты. Соответственно, для этих же целей можно использовать и другие индикаторы, интервал перехода которых и величина рТ лежат в области значений рН >7: тимолфталеин, ализариновый красный и т.д. (табл. 20).
При взаимодействии слабого основания с сильной кислотой наблюдаются такие же отличительные способности (по сравнению с реакцией нейтрализации между сильными электролитами), как и при титровании слабой кислоты щелочью. Так, вследствие гидролиза соли, образующейся в ходе реакции, точка эквивалентности тоже не совпадает с точкой нейтральности, но смещается в данном случае уже в кислую область (рН<7). Величина скачка титрования тоже становится заметно меньше (рис. 56) по сравнению с кривой титрования сильной кислоты щелочью (рис.
54).
Рис. 56. Кривая титрования слабого основания (NН3 · Н2О) сильной кислотой (HCl)
224
Причем, чем слабее выражены основные свойства у титруемого вещества, тем в меньшей степени проявляется скачок титрования. На рисунке 56 показана кривая титрования слабого основания NН3 · Н2О сильной кислотой НCl. Как следует из ее вида, для фиксирования точки эквивалентности в данном случае могут быть использованы только те индикаторы, интервал перехода которых смещен в кислую область значений рН: метиловый оранжевый, бромфеноловый синий, метиловый красный (табл. 20). Интервал перехода фенолфталеина, тимолфталеина и других индикаторов, рТ которых лежит при рН>7, не укладывается в скачок титрования и лежит за его пределами. При использовании данных индикаторов мы будем перетитровывать исследуемый раствор и получать завышенные результаты анализа.
При взаимодействии слабой кислоты и слабого основания изменение рН происходит постепенно на протяжении всего процесса титрования. Скачок титрования на соответствующей кривой практически отсутствует, вследствие чего точно определить момент эквивалентности и подобрать для данного случая соответствующий индикатор становится невозможным.
На основании данного заключения в кислотно-основном методе анализа в качестве рабочих растворов (титрантов) не используют растворы слабой кислоты либо слабого основания.
Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато. Кривые титрования данных соединений могут иметь в соответствии с этим несколько (два и более) скачков титрования и точек эквивалентности. На рисунке 57 представлена кривая титрования трёхосновной фосфорной кислоты (H3PO4) щелочью (NaOH). Отчётливо видно наличие двух скачков титрования. Первый из них соответствует достижению первой точки эквивалентности, когда кислота оттитровывается по первой ступени
Н3PO4 + NaOH = NaH2PO4 + H2O
с образованием однозамещённого дигидрофосфата натрия.
225

Второй скачок титрования соответствует взаимодействию кислоты с NaOH по второй ступени с образованием двухзамещённого гидрофосфата натрия:
NaH2PO4 + NaOH = Na2HPO4 + H2O
Третий скачок титрования на графике, соответствующий реакции:
Na2HPO4 + NaOH = Na3PO4 + H2O,
отсутствует, т.к. константа диссоциации фосфорной кислоты на третьей стадии очень мала (≈10-13).
При необходимости можно оттитровать Н3PO4 по всем трём стадиям. Для этого в исследуемый раствор вводят CaCl2, в результате чего образуется малорастворимый Ca3(PO4)2
2H3PO4 + 3 CaCl2 = Ca3(PO4)2↓ + 6HCl,
а выделившееся эквивалентное количество соляной кислоты титруют обычным способом.
Рис. 57. Кривая титрования трехосновной фосфорной кислоты (H3PO4) сильным основанием (NaOH)
Как следует из рис. 57, каждой стадии нейтрализации фосфорной кислоты соответствует свой индикатор. Если мы будем использовать метиловый оранжевый, то оттитруем фосфорную
226
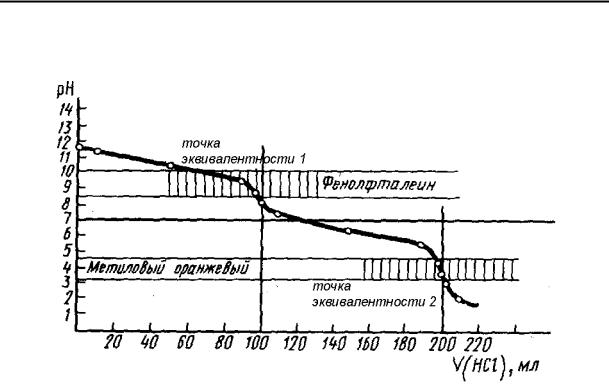
кислоту только по первой стадии. При использовании фенолфталеина оттитруем фосфорную кислоту как двухосновную с образованием двухзамещенной соли. Соли слабых многоосновных кислот и щелочных металлов при взаимодействии с сильными кислотами ведут себя как слабые основания, и кривые титрования таких веществ тоже имеют несколько точек эквивалентности и скачков титрования (рис. 58) вследствие ступенчатого протекания реакции:
Na2CO3 + HCl = NaHCO3 + NaCl – точка эквивалентности 1
NaHCO3 + HCl = NaCl + CO2 + H2O – точка эквивалентности 2
Na2CO3 + 2 HCl = 2NaCl + CO2 + H2O
Рис. 58. Кривая титрования раствора Na2CO3 сильной кислотой (HCl)
В смеси сильных кислот можно установить только их общую суммарную концентрацию, раздельное определение компонентов невозможно. Кривая титрования такой смеси не отличается от кривой титрования одной сильной кислоты (рис. 54).
При титровании сильной кислоты в присутствии слабой наблюдаются два скачка титрования (рис. 59) и используются 2
227

индикатора, причём первой оттитровывается с использованием метилового оранжевого сильная кислота, и скачок титрования в данном случае невелик. Соответственно, и погрешность измерения может достигать нескольких процентов.
HCl + NaOH = NaCl + H2O – точка эквивалентности 1
CH3COOH + NaOH = CH3COONa + H2O – точка эквивалент-
ности 2.
Зато скачок титрования, соответствующий нейтрализации слабой кислоты, является хорошо выраженным. При титровании в присутствии фенолфталеина можно точно определить суммарное содержание обеих кислот в смеси.
Титрование смеси нескольких слабых кислот практически не отличается от титрования многоосновной кислоты, подробно рассмотренной нами выше.
Рис. 59. Кривая титрования смеси кислот (НСl и СН3СООН) раствором NaOH
Точное количественное определение более сильной кислоты в этой смеси возможно, если константы диссоциации присутствующих кислот различаются на четыре и более порядка.
228
Применение кислотно-основного титрования
Методы кислотно-основного титрования находят широкое применение в самых разных областях человеческой деятельности. Их используют для контроля технологических процессов в химической, пищевой, текстильной, металлургической и др. промышленности. При этом определяют содержание различных неорганических и органических кислот, солей, оснований, а также веществ, не обладающих кислотно-основными свойствами, но вступающих в реакцию с кислотами или основаниями.
Всанитарно-гигиенической практике кислотно-основное титрование используют для определения карбонатной жёсткости воды, оценки качества продуктов питания: молока, творога, хлебобулочных изделий, в которых при хранении в результате порчи образуются органические кислоты.
Втоксикологии, судебно-медицинской экспертизе этот ме-
тод используется для определения NH3, CH3COOH, HCN, фенолов, аминов и других ядовитых соединений кислотно-основного характера.
Вфармацевтической промышленности, аптеках его применяют для определения концентрации в растворах ряда лекарственных препаратов кислотного или основного характера.
Вбиохимических исследованиях, клинической практике с помощью кислотно-основного титрования определяют буферную ёмкость биологических жидкостей, щелочной резерв крови и плазмы, кислотность желудочного сока. В последнем случае различают его активную и общую кислотность.
Активная кислотность обуславливается концентрацией в желудочном соке свободной соляной кислоты. Её определяют титрованием сока щелочью (NaOH) в присутствии индикатора метилового оранжевого. При этом изменение окраски наблюдается при значении рН, близком к четырем. К этому моменту практически вся свободная HCl успевает расходоваться.
Общая кислотность обуславливается не только концентрацией HCl, но и содержанием в желудочном соке связанной соляной кислоты в виде хлороводородных солей белков и некоторых других азотсодержащих соединений (их условно можно предста-
вить как R-NH3Cl), а также наличием солей H3PO4, некоторых слабых органических кислот, диссоциация которых в присут-
229
ствии сильной кислоты HCl подавляется. Чтобы определить общее содержание всех вышеперечисленных компонентов (в том числе и свободной HCl), желудочный сок титрируют щёлочью в присутствии индикатора фенолфталеина. В этих условиях, наряду с HCl, в реакцию со щёлочью вступят и все другие вещества.
При клинических анализах содержание соляной кислоты в желудочном соке (иначе - активную кислотность сока) и его общую кислотность измеряют в титриметрических единицах (ТЕ), т.е. числом см3 0,1М р-ра NaOH, затраченных на титрование 100 см3 сока в присутствии в качестве индикатора метилового оранжевого или фенолфталеина, соответственно.
Нормальными показателями (натощак) являются: активная или свободная кислотность ≈20ТЕ, общая кислотность ≈40ТЕ. Таким образом, оба вида кислотности могут отличаться друг от друга в 2 раза.
Редоксиметрия
Общая характеристика и классификация методов
Окислительно-восстановительным титрованием, или редоксиметрией, называют группу титриметрических методов анализа, основанных на использовании окислительновосстановительных реакций.
Методы, в которых рабочими растворами являются окислители (KMnO4, K2Cr2O7, I2 и др.), называют иначе оксидиметрией. С их помощью определяют количественное содержание веществ, обладающих восстановительными свойствами.
Методы, в которых рабочими растворами или титрантами являются растворы восстановителей (аскорбиновой кислоты, гидразина, гидрохинона), называются редуктометрией. Они служат для количественного определения веществ, проявляющих окислительные свойства.
Следует отметить, что деление методов окислительновосстановительного титрования на оксидиметрию и редуктометрию является условным, т.к. в рамках одного и того же метода в качестве титрантов могут быть использованы как восстановители, так и окислители. Так, например, в перманганатометрии рабочими растворами являются раствор KMnO4
230
