
Общая химия (часть 2, 2012 г
.).pdfМинистерство здравоохранения Республики Беларусь
Учреждение образования «ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ»
Кафедра общей и биоорганической химии
В.В. БОЛТРОМЕЮК
ОБ Щ А Я Х И М И Я
В2-х частях
Часть 2
Учебное пособие для студентов медицинских вузов по специальностям 1-79 01 01 Лечебное дело и 1-79 01 02 Педиатрия
Гродно
ГрГМУ
2012
УДК 544(075.8)
ББК 24
Б79
Автор: зав. каф. общей и биоорганической химии, канд. хим. наук, доц. В.В. Болтромеюк.
Рецензенты: декан ф-та биологии и экологии, проф. каф. химии и химической технологии УО «ГрГУ им. Я. Купалы», д-р хим. наук, проф. В.Н. Бурдь;
Болтромеюк, В.В.
Б79 Общая химия : учебное пособие в 2-х частях / В.В. Болтромеюк. – Гродно : ГрГМУ, 2012. – Часть 2. – 244 с.
ISBN
В учебном пособии рассматриваются избранные разделы физической, коллоидной и общей химии, которые необходимы при изучении физикохимической сущности и механизма процессов, происходящих в организме человека на молекулярном и клеточном уровне.
УДК 544(075.8)
ББК 24
ISBN |
Болтромеюк В.В., 2012 |
2
СТРОЕНИЕ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
3
СТРОЕНИЕ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Понятие «атом» (по-древнегречески «атомос» – неделимый) ввел в обращение греческий философ Демокрит (IV-III вв. до н.э.), который считал, что из мельчайших, неделимых частиц состоят все объекты окружающего нас мира. Представление о неделимости атома просуществовало неизменным более двух тысяч лет, вплоть до начала ХХ столетия.
Однако, уже к концу XIX века, был накоплен ряд фактов и физических открытий прямо или косвенно свидетельствовавших о сложном составе атомов и о возможности их взаимопревращений. В первую очередь к ним относятся: изучение закономерностей электролиза растворов и расплавов электролитов, электропроводности металлов, открытие катодных лучей, явления фотоэффекта, радиоактивности. Исследования в этих областях приве-
ли к открытию элементарной отрицательно заряженной части-
цы – электрона (табл. 1), которая входит в состав атомов всех веществ и при определенных условиях (нагревании, освещении, рентгеновском облучении) может ими испускаться.
Но так как атом электронейтрален, то в его состав должны входить и другие частицы, заряженные в отличие от электронов положительно. Подтверждением этой гипотезы послужило открытие и исследование радиоактивности. Возникла необходимость выяснить, каким образом эти положительно и отрицательно заряженные частицы распределены внутри атома. Первая теория о строении атома была предложена в 1903 году английским ученым Дж.Томсоном. Согласно этой теории любой атом состоит из положительно заряженной субстанции, равномерно распределенной по всему объему, в которую вкраплены отрицательно заряженные электроны, нейтрализующие положительный заряд. Модель Томсона (рис. 1) получила образное название «сливового пудинга».
Однако, уже в 1911 году известный английский ученый Эрнст Резерфорд, проводя опыты по рассеянию положительно заряженных -частиц, проходящих через тонкие пластинки тяжелых металлов, опроверг ее.
4

Рис. 1. Модель атома по Томсону
Эрнест Резерфорд (1871 – 1937).
Один из самых выдающихся ученых XX в. Он установил наличие двух типов радиоактивного излучения ( - и -лучей), доказал, что -частицы являются двухзарядными ионами гелия, предложил планетарную модель строения атома и, наконец, высказал предположение о существовании протона и нейтрона. В 1908 г. Резерфорд получил Нобелевскую премию за исследования радиоактивности.
Между атомами в кристаллической решетке твердых веществ, в том числе и металлов, имеются промежутки, о чем свидетельствует, например, сжимаемость металлов. Однако обнаружить обычными методами исследования эти промежутки нельзя, поскольку они очень малы. -Частицы по размеру гораздо меньше атомов металлов и, следовательно, могут свободно проходить сквозь межатомные пустоты, не отклоняясь в ту или иную сторону. При столкновении же -частицы с атомом под влиянием взаимодействия с содержащимися в нем положительно заряженными частицами направление ее движения должно как-то измениться.
Проведенные исследования показали, что абсолютное большинство -частиц проходит через металлическую пластинку без отклонения от первоначального пути и лишь незначительное их число изменяет свою траекторию. Очень редко -частицы отбрасывались от пластинки назад, как бы столкнувшись с непроницаемым препятствием (рис. 2).
5

ядро
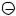 электронпуть -частиц
электронпуть -частиц
Рис. 2. Рассеяние -частиц, приближающихся к атомному ядру
Теоретические расчеты показали, что такой характер прохождения -частиц через металлическую пластинку может наблюдаться только тогда, когда положительный заряд и масса атома сосредоточены в небольшом объеме.
В соответствии с этим Резерфордом была предложена новая модель строения атома, получившая название ядерной или планетарной.
Согласно этой модели (рис. 3) атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов, движение которых напоминает движение планет вокруг солнца. Возникающая при этом центробежная сила противодействует силе притяжения электронов ядром и не дает им упасть на него. Почти вся масса атома (более 99,98%) сосредоточена в его ядре, диаметр которого приблизительно в 100000 раз меньше диаметра самого атома. Таким образом, ядро имеет очень большую плотность.
Рис. 3. Модель атома по Резерфорду.
6

Нильс Бор (1885 – 1962). Выдающийся датский физик, один из основоположников современной квантовой теории. Н. Бор создал первую квантовую модель строения атома, многие элементы которой вошли в современную квантовую теорию: уровни энергии, квантовые числа и т.д. Однако не меньшее значение имеет влияние Н.Бора на следующее поколение физиков, включая В.Гейзенберга, П.Дирака, В.Паули и Э.Ферми.
В последующие годы предложенная Резерфордом модель атома была взята за основу и доработана другими учеными: Бором, Планком, Гейзенбергом и др., – на основании более современных квантово-механических представлений.
Современная теория строения атома основана на законах, описывающих движение микрочастиц (микрообъектов). Так как массы и размеры микрочастиц чрезвычайно малы, по сравнению с массами и размерами макроскопических тел, то свойства и закономерности движения отдельной микрочастицы (например, электрона) качественно отличаются от свойств и закономерностей движения макроскопического тела (в совершенстве изученных классической физикой). В 20-е годы ХХ столетия возник новый раздел физики, описывающий движение и взаимодействие микрочастиц, – квантовая (или волновая) механика. Она основывается на представлениях о квантовании энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания поведения микрообъектов.
Немецкие физики М. Планк и А. Зоммерфельд, датский ученый Н. Бор показали, что при движении электрона в атоме энергия поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами. Причем величина кванта ( Е) зависит от частоты излучения v:
Е = h v
где h – постоянная Планка, равная 6,63 10–34 Дж/с.
7

Альберт Эйнштейн (1879 – 1955), выда-
ющийся физик, родился 14 марта 1879 г. в Ульме (Германия), с 14 лет жил в Швейцарии. Работал преподавателем средней школы, экспертом патентного бюро, с 1909 г. был профессором Цюрихского университета (Швейцария), с 1914 до 1933 г. – профессор Берлинского университета. С 1933 г. в знак протеста против гитлеровского режима отказался от германского подданства и от звания члена Прусской Академии наук. С 1933 г. до конца жизни – профессор Института фундаментальных исследований в Принстоне (США). С 1905 г. Эйнштейн разработал частную, а к 1916 г. – общую теорию от-
носительности, заложившую основы современных представлений о пространстве, тяготении и времени; осуществил основополагающие исследования в области квантовой теории света; ряд его важных работ посвящен теории броуновского движения, магнетизму и другим вопросам теоретической физики. В 1921 г. был награжден Нобелевской премией. С 1927 г. – почетный член Академии наук СССР.
Луи Виктор Пьер Раймон, 7-й
герцог Брольи, более известный как Луи де Бройль (1892 – 1987) – французский физик-теоретик, лауреат Нобелевской премии по физике за 1929 год.
Луи де Бройль является автором работ по фундаментальным проблемам квантовой теории. Ему принадлежит гипотеза о волновых свойствах материальных частиц (волны де Бройля или волны материи), положившая начало развитию волновой механики. Он предложил оригинальную интерпретацию квантовой механики (теория волны-пилота, теория двойного решения), развивал релятивистскую теорию частиц с произвольным спином, в частности фотонов (нейтрин-
ная теория света), занимался вопросами радиофизики, классической и квантовой теориями поля, термодинамики и других разделов физики.
В 1924 г. французский физик Луи де Бройль предложил рассматривать движение любой микрочастицы (в том числе и электрона) как волновой процесс. Причем частице, имеющей массу m и движущейся со скоростью , соответствует волна длиной :
8

mh
Из двойственной природы электрона и других микрочастиц вытекает установленный Вернером Гейзенбергом принцип не-
определенности. Невозможно одновременно точно устано-
вить и скорость и положение микрочастицы в пространстве (т.е. ее координаты).
Таким образом, квантование энергии, волновой характер движения микрочастиц, принцип неопределенности – все это показывает, что состояние электрона в атоме нельзя представить как движение материальной частицы по какой-то орбите.
Квантовая механика заменяет классическое понятие точного нахождения частицы понятием статистической вероятности нахождения электрона в данной точке пространства или в элементе объема dV вокруг ядра.
Строение ядер атомов
Согласно общепринятой в настоящее время теории, ядра
атомов химических элементов состоят из частиц двух видов: протонов и нейтронов, имеющих общее название нуклоны (от латинского nucleus – ядро).
Протоны и нейтроны имеют практически одинаковую массу, равную примерно одной а.е.м., т.е. u (табл. 1).
Таблица 1. Основные характеристики элементарных частиц, входящих в состав атома
Частица |
Символ |
Масса покоя |
Заряд |
||
|
|
|
|
|
|
|
|
Абсолют- |
Относи- |
Электри- |
Относи- |
|
|
ная, кг |
тельная |
ческий, Кл |
тельный |
электрон |
е |
9,109 10-31 |
0,0005 |
1,602 10-19 |
1 |
протон |
р |
1,673 10-27 |
1,0073 |
1,602 10-19 |
1+ |
нейтрон |
n |
1,675 10-27 |
1,0087 |
0 |
0 |
Нейтрон является электронейтральной частицей, а протон имеет элементарный положительный заряд, условно принятый равным 1+.
9
Эти частицы обозначаются следующим образом: протон – 11 p , нейтрон – 01 n . Верхний индекс обозначает относительную
массу, а нижний – относительный электрический заряд.
Как следует из таблицы 2, масса электрона приблизительно в 1840 раз меньше массы протона. Вследствие этого можно считать, что практически вся масса атома сосредоточена в ядре и определяется суммарным числом входящих в его состав протонов и нейтронов. Это число называется иначе массовым или нуклонным числом (А) и оно соответствует его округленной относительной атомной массе (Аr).
Положительный заряд ядра атома (Z), выраженный в относительных единицах, равен числу имеющихся в нем протонов или иначе протонному числу атома. Протонное число для всех атомов одного и того же химического элемента одинаково. Оно соответствует атомному номеру этого элемента и определяет положение элемента в периодической таблице Д.И. Менделеева. В связи с этим атомный номер элемента часто называют его по-
рядковым номером.
Так как атом является электрически нейтральной частицей, то число протонов в его ядре должно соответствовать числу вращающихся вокруг него электронов. Массовое или нуклонное число атома (А) определяется следующим образом:
А = Z + N
где Z – заряд ядра атома или его протонное число; N – число нейтронов в ядре.
При написании ядра атомов химических элементов (Х) часто изображаются следующим образом: AZ X , например 168 O ; 126 С .
Вид атомов с определенными значениями протонного и массового чисел называется нуклидом.
Атомы большинства химических элементов состоят из нескольких видов нуклидов, которые отличаются друг от друга своими массовыми числами. Это вызвано тем, что в ядрах этих атомов при неизменном числе протонов содержится разное число нейтронов. Такие нуклиды называются иначе изотопами (от греческого «изос» – равный, «топос» – место, т.е. «занимающие одно место»). В периодической таблице Д.И. Менделеева изото-
10
