
- •Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
Давление насыщенного пара растворителя над раствором. Закон Рауля
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду (рис. 27), то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости одновременно начнет протекать и обратный процесс – конденсация пара, т.е. переход молекул растворителя обратно в жидкость. Причем конденсация является экзотермическим процессом и сопровождается выделением теплоты.
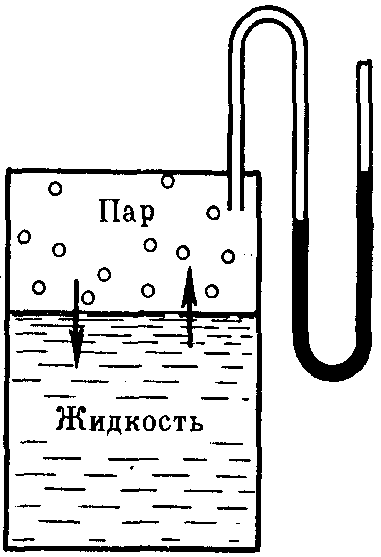
Рис. 27.Равновесие жидкость — пар (схема)
Со временем скорости обоих процессов уравняются и в системе установится динамическое равновесие, при котором число молекул растворителя, испарившихся с поверхности жидкости за единицу времени, будет равно числу молекул, перешедших в жидкость из газообразной среды. Но при этом какое-то постоянное и не меняющееся во времени число молекул растворителя будет находиться над его поверхностью, образуя насыщенный пар. Давление этого пара на жидкость называютдавлением насыщенного пара чистого растворителя (р0).Его можно измерить с помощью манометра (рис. 27).
При неизменной температуре и внешнем давлении р0 остается постоянным и зависит только от природы жидкости и поэтому является одной из ее физических характеристик.
Так, при 293 K(20оС) давление насыщенного пара Н2О равно 2,319 кПа; этилового спирта – 5,85 кПа; диэтилового эфира – 58,93 кПа.
При повышении температуры согласно принципа Ле-Шателье равновесие смещается в сторону эндотермического процесса испарения. В результате чего количество молекул жидкости над ее поверхностью начнет увеличиваться. Это приведет к возрастанию давления насыщенного пара, когда система снова придет в равновесие.
Если растворить небольшое количество какого-нибудь нелетучего вещества1(молекулы которого не могут переходить в газовую фазу) концентрация свободных молекул растворителя в верхнем слое жидкости уменьшится, т.к. часть мест там займут частицы растворенного вещества. Они к тому же будут удерживать вокруг себя (связывать) ближайшие молекулы растворителя, формируя из них сольватные оболочки.
В этом случае равновесие между жидкостью и ее насыщенным паром устанавливается при более низком давлении (р) по сравнению с давлением насыщенного пара над чистым растворителем (р0).
Опытным путем было установлено, что для растворов понижение давления насыщенного пара растворителя (р0 – р = р) не зависит от природы растворенного вещества, а определяется только его концентрацией.
Французский физик Франсуа Рауль установил математическую зависимость между р и мольной долей растворителя, которая называется законом Рауля:
р = р02,
где 2 – мольная доля растворителя в раствор.

Франсуа Мари Рауль (1830 – 1901) – французский химик и физик, член-корреспондент Парижской АН (1890). С 1867 работал в Гренобльском университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882–1888 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон Рауля, применяемый для определения молекулярных масс веществ в растворённом состоянии.
Таким образом, согласно закону Рауля давление насыщенного пара растворителя над раствором прямо пропорционально мольной доле растворителя.
Часто закон Рауля математически записывают по-другому:
![]() или
или
![]() ,
,
где
![]() – относительное понижение
давления насыщенного пара растворителя
над раствором; 1
– мольная доля растворенного вещества;
n1 –
химическое количество (моль) растворенного
вещества; n2
– химическое количество растворителя.
– относительное понижение
давления насыщенного пара растворителя
над раствором; 1
– мольная доля растворенного вещества;
n1 –
химическое количество (моль) растворенного
вещества; n2
– химическое количество растворителя.
В этом случае его формулировка звучит несколько иначе:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
