
- •Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
Механизм образования растворов
Растворы занимают промежуточное положение между механическими смесями веществ и индивидуальными химическими соединениями, обладая определенными свойствами и тех и других систем и в тоже время значительно отличаясь от каждой из них.
Так по сравнению со смесями растворы являются более однородными и в любой своей части обладают одинаковыми физическими свойствами и химическим составом, как и индивидуальные соединения.
В то же время многие вещества в растворах, как и в механических смесях, сохраняют неизменными часть свойств, присущих им в чистом виде. В отличие от индивидуальных соединений растворы обладают переменным составом и отличаются природой связи между своими структурными единицами. Если для химических веществ характерны ковалентные и ионные связи, то в растворах между их компонентами присутствуют более слабые диполь-дипольные, ион-дипольные или ван-дер-ваальсовые взаимодействия, а в некоторых случаях – водородные связи и донорно-акцепторные взаимодействия.
Таким образом, процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом.
Д митрий
Иванович Менделеев
(1834 — 1907).
митрий
Иванович Менделеев
(1834 — 1907).
Поистине великий ученый. Нет, кажется, ни одной области химии, в которую бы он не внес свой вклад. Наиболее известные его работы, кроме периодического закона, это открытие «температуры абсолютного кипения» (критической точки), разработка физико-химической (гидратной) теории растворов, формулировка обобщенного газового закона. Еще одним главным делом своей жизни Д. И. Менделеев считал учебник «Основы химии».
При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя, в результате которого разрушается его исходная структура и происходит образование новой структуры, свойственной раствору. При этом различают физическую и химическую стадии растворения вещества, которые протекают одновременно.
На физической стадии происходит процесс измельчения (диспергирования) растворяемого вещества до отдельных молекул или ионов и их равномерное распределение во всем объеме раствора. Осуществляется она за счет действия молекул растворителя на вещество и протекания процесса диффузии.
На этой стадии энергия всегда затрачивается, т.к. она необходима для разрыва связей в кристаллической решетке твердого вещества или межмолекулярных связей при растворении жидкости.
Покажем механизм этого процесса на примере растворения в Н2О солиKCl, имеющей ионную кристаллическую решетку (рис. 18).
Диполи растворителя ориентируются соответствующим образом относительно ионов кристаллической решетки на ее поверхности и в результате своего теплового движения и колебательного движения ионов последовательно вырывают их из узлов решетки и переводят в раствор.
Чем прочнее связи в кристаллической решетке, тем большее количество энергии нужно затратить на ее разрушение. Межмолекулярные связи в жидкостях, как правило, слабее чем в твердых веществах, поэтому при их растворении энергии затрачива-
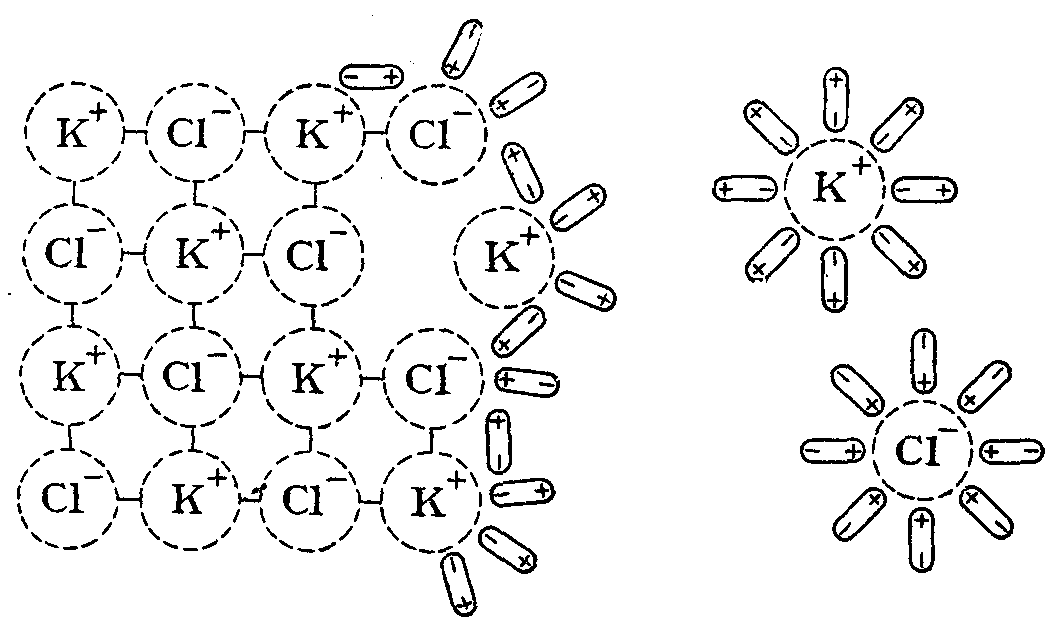
Рис. 18.Механизм растворения ионного соединения (KCl) в воде
ется гораздо меньше. В газах молекулы практически не связаны между собой, поэтому на физической стадии их растворения энергия не расходуется.
На химической стадии растворенияпроисходит взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя и образуются химические соединения:гидраты(если в роли растворителя выступает Н2О) илисольваты(если растворителем выступает любая другая жидкость).
В зависимости от природы растворенного вещества сольваты (гидраты) могут образовываться как в результате физических взаимодействий: ион-дипольного (при растворении веществ с ионной структурой) и диполь-дипольного (при растворении веществ с молекулярной структурой), так и химических.
Химические взаимодействия осуществляются за счет образования донорно-акцепторных связей. При этом ионы растворенного вещества являются акцепторами, а молекулы растворителя (Н2О,NH3) – донорами электронных пар. Образующиеся таким образом гидраты называются иначеаквакомплексами: [Cu(H2O)6]2+, [Al(Н2О)6]3+. Их образование в растворах часто сопровождается изменением окраски. Так растворение безводного медь(II)-сульфата белого цвета приводит к появлению интенсивной голубой окраски. Гидратные оболочки полярных молекул органических соединений появляются в результате образования водородных связей между их функциональными группами и молекулами воды.
Вследствие образования гидратов (сольватов) при растворении многих веществ имеет место контрактация – сжатие объема системы из-за ее самоуплотнения (особенно в случае концентрированных растворов). При этом объем получившегося раствора будет меньше суммы объемов растворителя и растворяемого вещества (если только последнее не является газом).
Образование гидратных (сольватных) оболочек всегда сопровождается выделением энергии. При гидратации ионов количество выделившейся энергии и число удерживаемых молекул воды зависят от величины их заряда и радиуса.
Чем больше заряд иона и меньше его радиус, тем большее количество энергии выделяется и тем более устойчивой будет образовавшаяся гидратная оболочка (рис. 19).
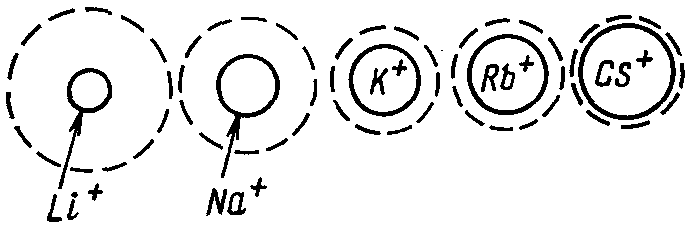
Рис. 19. Зависимость размеров гидратных оболочек ионов от величины их радиуса
Если вещество в растворе находится в виде молекул, то количество выделяемой при гидратации энергии пропорционально полярности его молекул.
В ходе теплового движения частицы растворенного вещества в растворе перемещается вместе со своими гидратными (сольватными) оболочками, которые составляют с ними одно целое.
В большинстве случаев образовавшиеся гидратные (сольватные) оболочки являются непрочными и легко разрушаются уже при слабом нагревании или при выпадении веществ из раствора. Но иногда гидратные соединения настолько устойчивы, что выпадают из раствора в виде кристаллов, которые называются иначе кристаллогидратами, а содержащаяся в них Н2О –кристаллизационной.
В химических формулах кристаллогидратов молекулы Н2О пишутся через точку (табл. 5). Из этих формул видно, сколько молекул Н2О окружают одну молекулу вещества.
Таблица 5.Формулы и тривиальные названия кристаллогидратов
|
Название кристаллогидрата |
Химическая формула |
|
Сода кристаллическая |
Na2CO3· 10 Н2О |
|
Медный купорос |
CuSO4· 5 Н2О |
|
Железный купорос |
FeSO4 · 7 Н2О |
|
Глауберова соль |
Na2SO4 · 10 Н2О |
|
Английская соль |
MgSO4 · 7 Н2О |
|
Гипс |
CaSO4 · 2 Н2О |
|
Алебастр |
CaSO4 · 0,5 Н2О |
При нагревании (иногда достаточно сильном) кристаллогидраты разрушаются, а кристаллизационная Н2О испаряется.
Физическая и химическая стадии процесса растворения протекают одновременно. Суммарный тепловой эффект при растворении вещества определяется соотношением между двумя этими стадиями.
Если на физической стадии энергии затрачивается больше, чем её выделяется на химической стадии, то при растворении такого вещества температура раствора будет понижаться, а энергия, в целом, затрачиваться. Это наблюдается, например, при растворении NaCl,NH4NO3.
Если же на физической стадии энергии расходуется меньше, чем выделяется на химической стадии, то при растворении таких веществ температура раствора, наоборот, будет повышаться, а энергия, в целом, выделяться. Особенно хорошо это наблюдается при растворении в воде NaOH,KOH,H2SO4.
Если на физической стадии затрачивается примерно столько же энергии, сколько выделяется на химической, то температура раствора при растворении такого вещества практически не будет меняться.
При растворении газов теплота всегда выделяется, т.к. на физической стадии энергия не расходуется.
Тепловые эффекты растворения большинства веществ незначительны, поэтому заметного разогревания или охлаждения растворов, как правило, не наблюдается. Однако в некоторых случаях, например, при растворении в Н2О гидроксидов щелочных металлов илиH2SO4, происходит настолько сильное разогревание раствора, что он может даже закипеть. Поэтому при приготовлении водных растворов кислот и щелочей требуется особая осторожность. В частности, при получении разбавленного раствораH2SO4нужно приливать небольшими порциями концентрированную кислоту в Н2О, а не наоборот.
При растворении NaClилиNH4NO3температура раствора может, понизиться до минусовой.
Теплоту, выделяемую или поглощаемую при растворении 1 моля вещества называют его теплотой растворения (Qраств.).
