
- •Методичні вказівки до виконання лабораторних робіт з курсу фізики оптичного зв’язку
- •Обробка результатів вимірювань при виконанні лабораторних робіт з курсу «Фізика оптичного зв’язку»
- •Обчислення похибок при прямих вимірюваннях.
- •Обчислення похибок при непрямих вимірюваннях.
- •Сферична аберація оптичних лінз
- •1. Мета роботи.
- •2. Теоретичні відомості.
- •Сферична аберація.
- •3. Опис вимірювальної установки.
- •4. Контрольні запитання.
- •5. Домашнє завдання.
- •6. Лабораторне завдання.
- •7. Прилади та обладнання.
- •3. Опис вимірювального приладу.
- •4. Контрольні запитання.
- •5. Домашнє завдання.
- •6. Послідовність виконання роботи.
- •7. Прилади та обладнання.
- •3. Контрольні запитання.
- •4. Домашнє завдання.
- •5. Лабораторне завдання.
- •6. Порядок виконання роботи.
- •7. Прилади та обладнання.
- •3. Контрольні запитання.
- •4. Домашнє завдання.
- •5. Лабораторне завдання.
- •6. Послідовність виконання роботи.
- •6. Прилади та обладнання.
- •3. Контрольні запитання.
- •4. Домашнє завдання.
- •5. Лабораторне завдання.
- •6. Порядок виконання роботи.
- •7. Прилади та обладнання.
- •3. Опис вимірювальної установки
- •4. Контрольні запитання
- •5. Домашнє завдання
- •6. Лабораторне завдання
- •7. Прилади та обладнання.
- •3. Теоретичні відомості.
- •4. Контрольні запитання.
- •5. Домашнє завдання.
- •6. Лабораторне завдання.
- •7. Порядок виконання роботи
- •8. Прилади та обладнання.
- •9. Література.
6. Лабораторне завдання
Зібрати на оптичній лаві установку у відповідності з схемою, наведеною на рис. 5.
Ввімкнути джерело живлення і від’юстувати установку так, щоб світловий пучок, який виділений діафрагмою, проходив через поляризатор і аналізатор і попадав на робочу поверхню фотоелемента.
Обертаючи диск поляризатора добитись мінімального показу мікроамперметра. В цьому випадку кут між головними перерізами поляризатора і аналізатора буде відповідати куту α=90˚.
Встановити і закріпити циліндричні чохли Ц1 та Ц2 так, щоб світло від сторонніх джерел не попадало в середину вимірювальної схеми. При цьому стрілка мікроамперметра повинна залишатись на нульовій відмітці.
Повертаючи диск поляризатора, змінюйте кут α в межах від 90° до 0° з кроком 10°. При цьому знімайте покази мікроамперметра, які відповідають цій послідовності.
Обчисліть для кожного положення значення
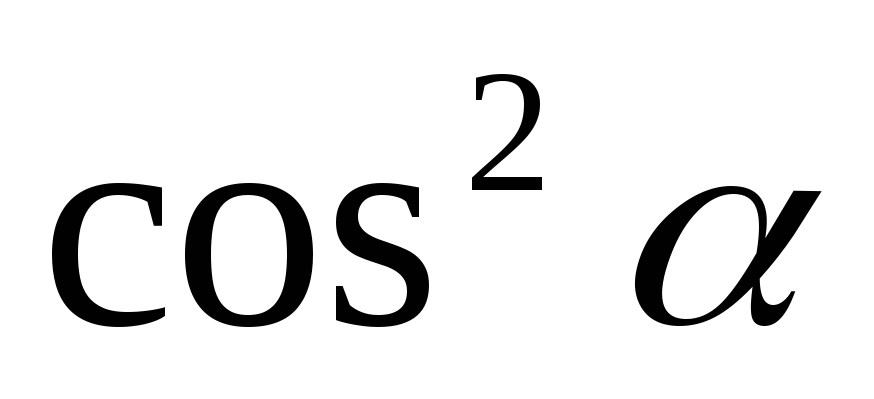 і значення світлового потоку за формулою
(15).
і значення світлового потоку за формулою
(15).Результати вимірювань і обчислень занести в таблицю:
|
α [град] |
90° |
80° |
70° |
60° |
50° |
10° |
30° |
20° |
10° |
0° |
|
cosа |
|
|
|
|
|
|
|
|
|
|
|
cos2а |
|
|
|
|
|
|
|
|
|
|
|
Iексп [мкА] |
|
|
|
|
|
|
|
|
|
|
|
k |
1 |
0.986 |
0.943 |
0.848 |
0.753 |
0.660 |
0.540 |
0.429 |
0.429 |
1 |
|
I=k∙Iексп [мкА] |
|
|
|
|
|
|
|
|
|
|
|
J [Вт/м2] |
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||
7. Прилади та обладнання.
1. Оптична лава.
2. Освітлювач (лампа розжарення)
3. Два поляроїда.
4. Фотоелемент ФЭ-ССУ.
5. Мікроамперметр.
8. Література.
1.Савельев И.В. Курс общей физики. Т.2. М.:Наука. 1979.
Ландсберг Г.С. Оптика. М.:Наука. 1976.
Геворкян Р.Г. Курс физики. М.: Высшая школа. 1979.
Лабораторне заняття № 8
Вивчення лінійчатих спектрів випромінювання
1. Мета роботи
Вивчення спектральних закономірностей випромінювання розрідженими двоатомними газами.
2. Теоретичні відомості.
Атоми усіх хімічних елементів складаються з позитивно заряджених ядер, в яких зосереджена майже вся маса атома, та електронів. Сумарний від’ємний заряд електронів рівний додатному заряду ядра.
Електрони в атомах можуть мати тільки визначенні значення енергії. Ці значення при графічному зображенні позначаються як енергетичні рівні атома. Найнижчий рівень відповідає основному стану атома, а більш високий – збудженому. Кожен енергетичний рівень атома характеризується головним квантовим числом n, яке може приймати значення послідовного ряду чисел:n= 1, 2, 3,…
Випромінювання та поглинання енергії атомами відбувається при їхніх переходах з одного енергетичного рівня на інший, тобто дискретно. Енергія поглинутого або випроміненого кванта при цьому:
![]()
д
При отриманні ззовні енергії (нагрівання, опромінювання, бомбардування частинками тощо) атоми, поглинаючи кванти енергії, переходять у збуджені стани. Потім вони можуть повернутися на більш низькі енергетичні рівні, випускаючи при цьому енергію.
Випромінювання можна розкласти у спектр за допомогою призми або дифракційної гратки. Розжарені тверді та рідкі тіла дають світло, при розкладанні якого отримують суцільнийспектр, що має вигляд кольорової смуги з неперервним переходом одного спектрального кольору в інший (рис. 1).

Рис. 1. Суцільний спектр видимого випромінювання [http://uk.wikipedia.org/wiki/Файл:Spectrum_roygbiv.jpg].
Спектр молекул газу або пару складається з окремих смуг, чітких з одного краю і розмитих з іншого. Такий спектр називається смугастим. Ці смуги утворені великою кількістю близько розташованих вузьких ліній (рис. 2).

Рис. 2. Смугастий спектр азоту[http://uk.wikipedia.org/wiki/Файл:Nitrogen.Spectrum.Vis.jpg].
Гази і пари, що складаються із окремих атомів дають так звані лінійчатіспектри у вигляді окремих ліній.
При проходження білого світла через гази в останніх відбувається поглинання тих довжин хвиль, які присутні в спектрі випромінювання цих газів. Лінійчаті спектри поглинання складаються з окремих темних ліній, розташованих на фоні суцільного спектру. Ці темні лінії відповідають поглинутим довжинам хвиль атомами (рис. 3).
Кожен хімічний елемент має характерний для нього лінійчатий спектр (рис. 4). Тому вивчення спектрів є важливим методом дослідження складу речовини. По яскравості спектральних ліній можна також оцінити відсоткове співвідношення окремих елементів у складі речовини.

Рис. 3. Лінійчатий сонячний спектр поглинання із чіткими фраунгоферовими лініями [http://commons.wikimedia.org/wiki/File:Fraunhofer_lines_DE.svg].

Рис. 4. Лінійчатий спектр випромінювання водню [http://upload.wikimedia.org/wikipedia/commons/4/4c/Emission_spectrum-H.png].
Лінії в спектрі атомів об’єднуються у групи, які називаються спектральними серіями. В одній і тій же серії лінії зближуються в сторону більш коротких довжин хвиль і мають деяку границю, біля якої іони розташовуються дуже щільно аж до злиття одна з одною.
У спектрі атома водню спостерігаються наступні серії ліній:
в ультрафіолетовій частині спектру – серія Лаймана;
у видимій – серія Бальмера;
в інфрачервоній – серії Пашена, Бреккета та Пфунда.
Довжини хвиль спектральних ліній водню обчислюються за формулою:
![]() ,
,
де R= 1,097∙107м-1– стала Рідберга,nтаm– головні квантові числа, що відповідають енергетичним рівням атома, причому завждиn<m.

Так, для серії
Лаймана n=1, аm= 2, 3, 4, …
Бальмера n=2, аm= 3, 4, 5, …
Пашена n=3, аm= 4, 5, 6, …
Бреккета n=4, аm= 5, 6, 7, …
Пфунда n=5, аm= 6, 7, 8, …
Схематично переходи зображені на рис. 5.
Рис. 5.
Відмітимо, що перші чотири лінії бальмерівської серії лежать в області видимого спектру:
|
λ, нм |
вид лінії |
|
|
червона |
|
|
синя |
|
|
фіолетова |
|
|
фіолетова |
