
5. Хімічні властивості.
5.1. Реакція гідрування (приєднання водню) проходить у присутності каталізаторів стереоселективно з утворенням продуктів цис- та транс-приєднання:

5.2. Реакції електрофільного приєднання (АЕ).
5.2.1. Реакції галогенування (приєднання Cl2, Br2) проходять ступінчасто із різною швидкістю, що дозволяє розділити продукти реакції:

В інших умовах (Br2,h)реакція може протікати за радикальним механізмом – АR.
5.2.2. Реакція гідрогалогенування (приєднання H–Hal) проходить повільніше, ніж у ряду алкенів, з дотриманням правила Марковнікова:

Механізм АЕ в ряду алкінів принципово не відрізняється від розглянутого раніше механізма АЕ в ряду алкенів: -комплексонієвий іонкаброкатіонпродукт приєднання.
5.2. Реакції нуклеофільного приєднання (АN).
5.3.1. Реакція гідратації (приєднання води; Кучеров, 1881 р.) проходить дуже легко у присутності каталітичних кількостей HgSO4 в розчині сульфатної кислоти. Із ацетилену утворюється оцтовий альдегід, а із його похідних – відповідні кетони:

Механізм реакції:

Прототропну таутомерію – переміщення протона з утворенням більш стабільних сполук, пояснює правило Ельтекова (1877 р.): ненасичені спирти, що мають безпосередньо при подвійному зв’язку гідроксильну групу, нестійкі і підлягають подальшій ізомеризації – первинні ненасичені спирти до альдегідів, а вторинні – до кетонів.
Інші реакції нуклеофільного приєднання (AN) відбуваються за загальною схемою:

5.3.2. Приєднання спиртів проходить за схемою:

Механізм реакції:
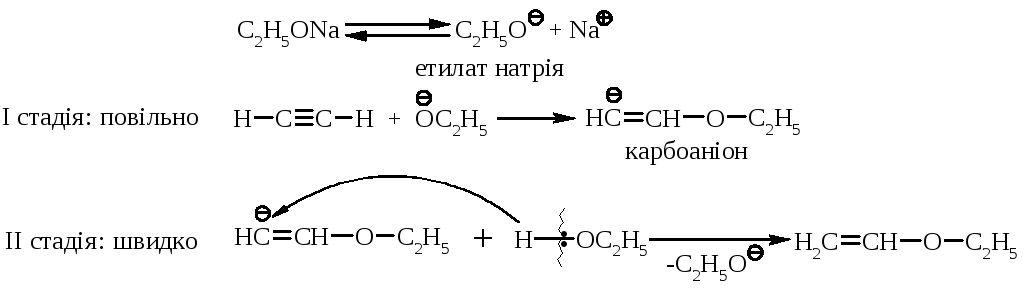
5.4. Приєднання альдегідів та кетонів:

Наведені каталізатори сприяють утворенню карбоаніона НСС–, який атакує електрофільний центр альдегіду або кетону. Реакції мають промислове впровадження та використовуються для синтезу важливих мономерів реакції полімеризації: бутадієну-1,3 та ізопрену.
5.5.Утворення ацетиленідів (кислотні властивості ацетилену).
Алкіни з рухливим (термінальним) атомом гідрогену здатні до дисоціації з утворенням протону:
![]()
що дає змогу віднести їх до слабких С–Н-кислот. Це є результатом високої електронегативності атома карбону Сsp та поляризовності зв’язку С–Н. Його дипольний момент дорівнює 1,05D, тоді як у алкенах він складає лише 0,63D. Для порівняння наведемо значення показника каслотності рКа для деяких сполук в порядку збільшення сили кислот (чим менше значення рКа, тим сильніша кислота):
|
Сполуки |
алкани (R-CH3) |
< |
алкени (R2C=CH2) |
< |
алкіни (R-CCH) |
< |
Н2О |
|
рКа: |
48÷51 |
|
43÷44 |
|
20÷25 |
|
15,74 |
Незважаючи на слабкі кислотні властивості, алкіни реагують із сильними основами з утворенням солей (ацетиленідів):

В сухому стані ацетиленіди важких металів дуже чутливі до удару та тертя і легко вибухають.
Ацетиленіди натрію можна використовувати у синтезі похідних ацетилена:

За такою ж схемою з алкінами взаємодіють і реактиви Гріньяра (магнійорганічні сполуки):

Ця реакція використовується в аналітичній практиці з метою визначення рухливих атомів гідрогену (реакція Церевітинова-Чугаєва).
5.6. Реакції окиснення алкінів відбуваються під дією сильних окисників (KMnO4, O3) в кислому, лужному або нейтральному середовищах:

Дизаміщені похідні алкінів теж окиснюються з розривом потрійного зв’язку:

Цю реакцію алкінів можна використовувати для визначення будови алкіні, аналізуючи карбонові кислоти, які при цьому утворюються.
5.7. Реакції олігомеризації (ди-, три- та тетрамеризація) ацетилену:
|
|
(Ньюленд, 1925 р.), реакція має промислове значення: добування хлоропрену |
|
| |
|
(Зелінський, Казанський, 1927 р.); при використанні каталізаторів Реппе(C6H5)3PNi(CO)3 реакцію проводять при 60-70 °С (Реппе, 1945 р.) |
Крім реакцій олігомеризації, відома реакція каталітичної полімеризації ацетилену:


