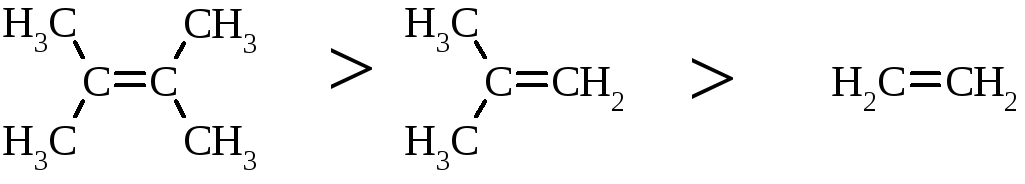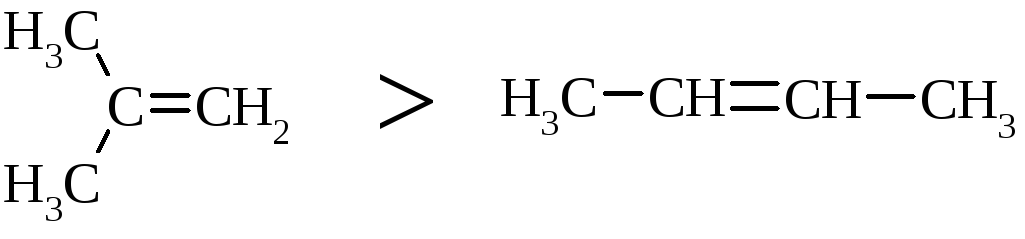3. Фізичні властивості.
У гомологічному ряду алкенів перші представники С2-С4 – гази; С5-С17 – рідини, а С18 – тверді речовини; погано розчинні у воді, але добре розчинні в органічних розчинниках. Із збільшенням молекулярної маси закономірно зростають температури плавлення та кипіння, (табл. 5.1.).
4. Будова алкенів.
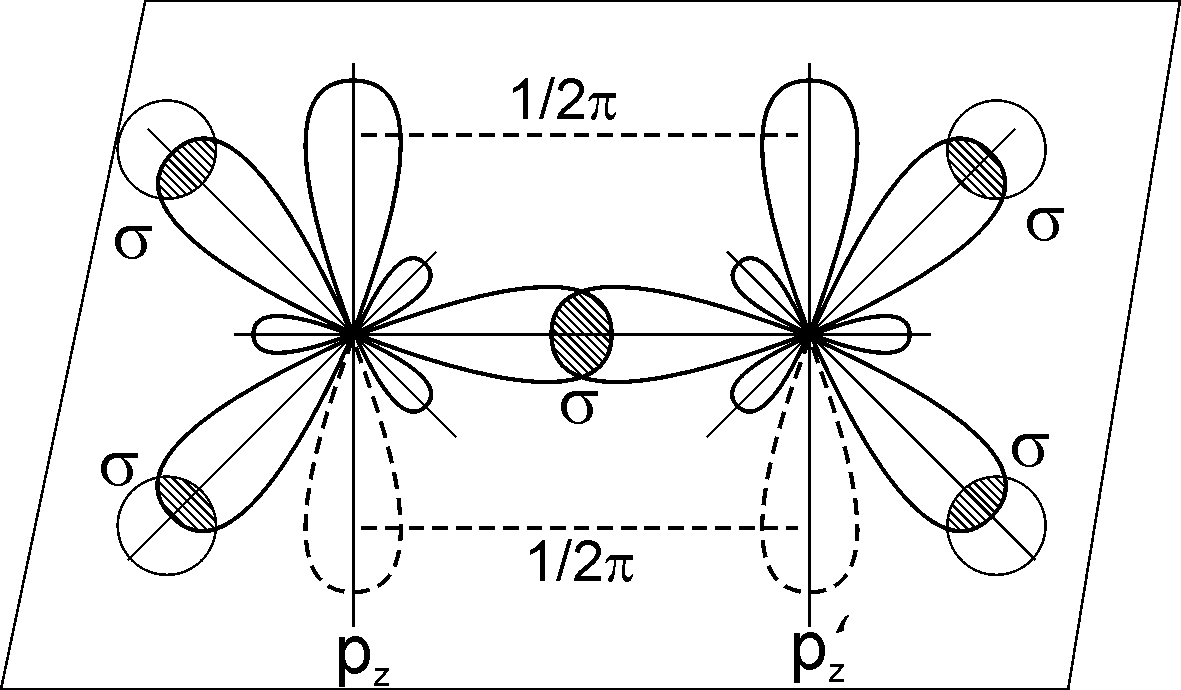
В алкенах атоми карбону біля подвійного зв’язку знаходяться у другому валентному стані (sp2-гібридизація). Орбітальну модель молекули етилену наведено на рис. 6.1.
|
Рис. 6.1. Орбітальна модель молекули етилена (утворення - та -зв’язків). |
-Зв’язок в алкенах утворюється при перекриванні s і гібридизованих sp2-орбіталей або при їх перекриванні між собою; -зв’язок – при бічному перекриванні негібридизованих pz-орбіталей сусідніх атомів карбону. Характеристика
хімічних зв’язків |
досить близькі і коливаються в межах 402-425 кДж/моль, а довжина зв’язку С–Н для метану і етилену, відповідно, складає 0,111 та 0,110 нм. Ці дані свідчать про те, що хімічні перетворення по зв’язку С–Н для алканів і алкенів повинні бути подібними, тому їх ми не будемо розглядати.
Таблиця 6.2.
Характеристика хімічних зв’язків алкенів.
|
Характеристика Зв’язок |
Довжина,l, нм |
Енергія, Е кДж/моль |
Полярність, D |
Поляризовність, RD см3 |
|
С–С |
0,154 |
366 |
0 |
1,296 |
|
С=С |
0,134 |
607 |
0 |
4,170 |
-Зв’язок подвійного зв’язку
 значно слабший за ,
тому реакції, в першу чергу, відбуваються
при його дисоціації, про що переконливо
свідчить розрахунок його енергії:
Е=Е+–Е=607-336=271
кДж/моль.
значно слабший за ,
тому реакції, в першу чергу, відбуваються
при його дисоціації, про що переконливо
свідчить розрахунок його енергії:
Е=Е+–Е=607-336=271
кДж/моль.
5. Хімічні властивості.
Розглядаючи хімічні властивості алкенів, необхідно відзначити загальний принцип систематизації та вивчення органічних сполук: хімічні властивості визначаються наявною функціональною групою та атомами, що її оточують. У випадку алкенів функціональною групою є подвійний зв’язок (потенційний нуклеофільний центр), для якого характерні реакції приєднання, а не реакції заміщення, характерні для раніше розглянутих алканів. Для алкенів також характерні реакції окиснення та полімеризації.
Хімічна активність подвійного
зв’язку  буде
визначатись, перш за все, значною
поляризовністю -зв’язку
(енергія дисоціації
271 кДж/моль) та просторовою доступністю
реакційного центру:
буде
визначатись, перш за все, значною
поляризовністю -зв’язку
(енергія дисоціації
271 кДж/моль) та просторовою доступністю
реакційного центру:
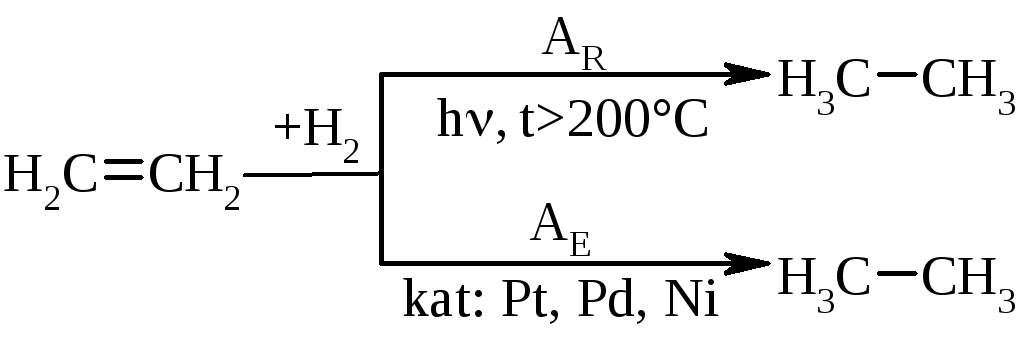
5.1. Гідрування (гідрогенізація) алкенів у більшості випадків відбувається при дії каталізаторів платинової групи (Pt, Pd, Ni):
|
|
В залежності від умов проведення реакція може відбуватись за механізмом радикального (AR) або електрофільного (АЕ) приєднання. |
5.2. Галогенування алкенів проходить з утворенням віцинальних дигалогеналканів:
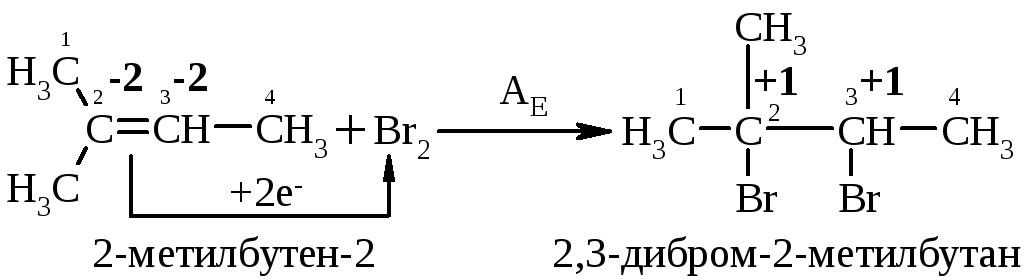
Це – якісна реакція на алкени:бромна вода темно-червоного кольору знебарвлюється у присутності алкену внаслідок утворення дибромгалогеналкану. Реакцію галогенування алкенів можна розглядати як окисно-відновну, в якій алкен окиснюється до дибромгалогеналкану, а молекулярний бром відновлюється до бромід-аніону, що входить до складу 2,2-дибром-2-метилбутану.
Швидкість реакції галогенування залежить від природи галогену: F2 (з вибухом)>Cl2, Br2 (кімнатна температура)>I2 (повільно при освітлені, h), а також від будови алкену:
|
|
|
|
|
Реакції бромування та хлорування відбуваються, як правило, за АЕ-механізмом:


5.3. Приєднання галогеноводнів (гідрогалогенування)до алкенів відбувається дуже легко з утворенням галогеналканів:
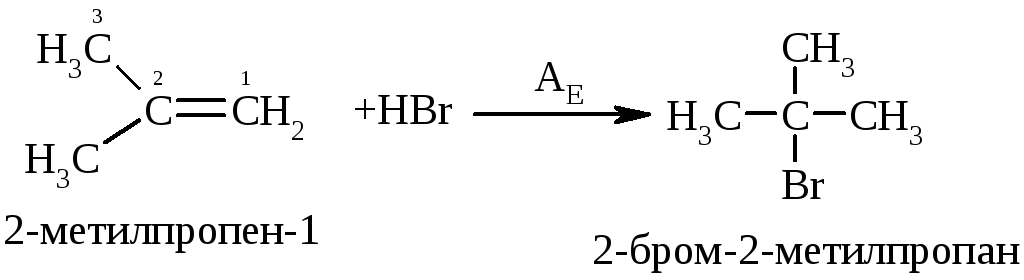
Реакційна здатність галогеноводнів збільшується із збільшенням сили кислот у ряду: HF<HCl<HBr<HI.
Галогеноводні у випадку несиметричних алкенів приєднується за правилом В.В. Марковнікова (1869 р.): атом гідрогену приєднується до більш гідрогенізованого атома карбону (до атома карбону, що має більшу кількість атомів гідрогену). Така регіоселективність визначається поляризацією подвійного зв’язку в алкенах з утворенням на першій стадії перехідного -комплекса:
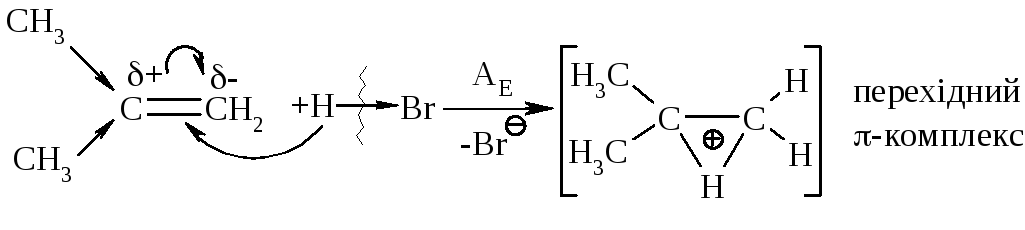

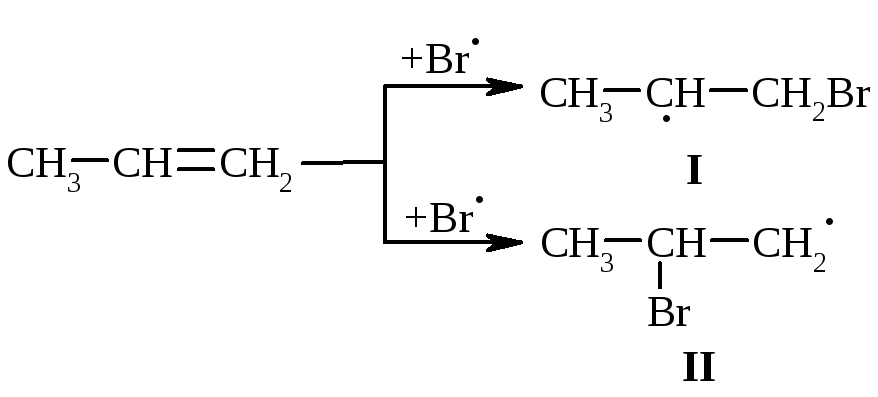
останній перегруповується до карбокатіонів (І) та (ІІ):


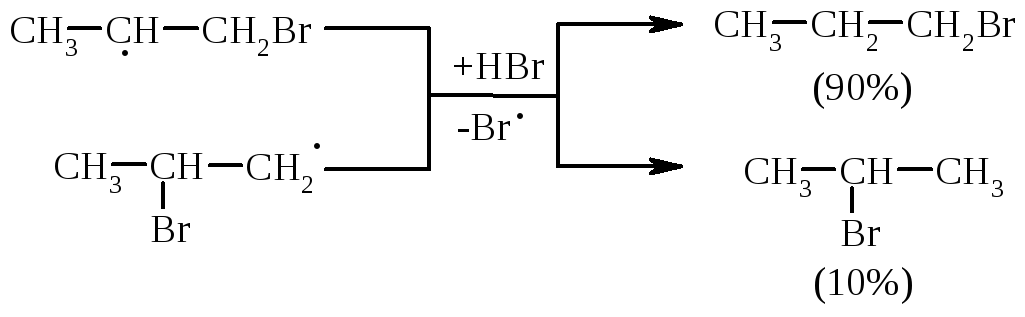
Із двох проміжних карбокатіонів І та ІІ перший є більш стійким, тому і вихід кінцевого бромалкана у цьому випадку є визначальним (90%).
При наявності у реакційному середовищі пероксидів реакція іде не по АЕ механізму, а по радикальному механізму – AR(Хараш, 1933 р.):
|
|
|
|
|
радикал (І) є більш стабільнішим, ніж радикал (ІІ), що є визначальним при утворенні кінцевого 1-бромпропану (90%):
|
Радикали (І) та (ІІ) стабілізуються за рахунок взаємодії із наступною молекулою бромоводню.
Таким чином, наявність в реакційному середовищі пероксидів приводить до зміни механізму реакції та до приєднання галогеноводнів проти правила Марковнікова.
5.4. Приєднання води (гідратація) алкенів відбувається в присутності мінеральних кислот за схемою:
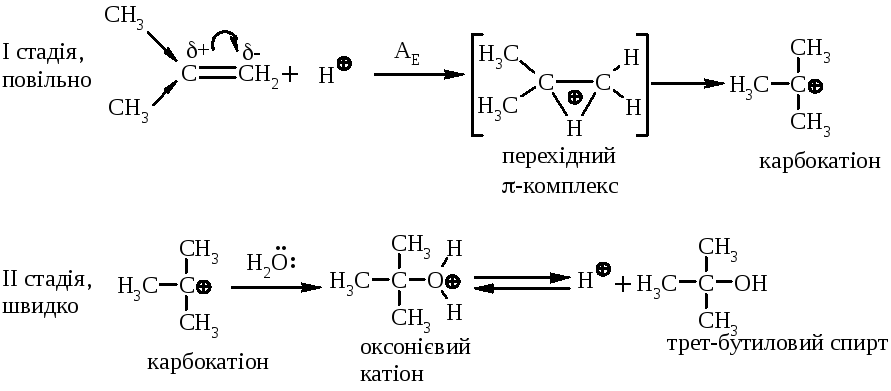

Реакція гідратації відбувається за механізмом АЕ, відповідно із правилом Марковнікова.
5.5. Приєднання сульфатної кислоти проходить за схемою:
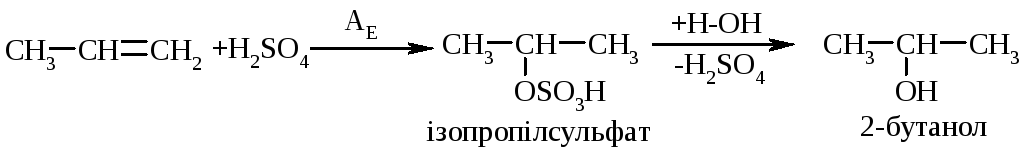
5.6. Гідроформілювання (приєднання синтез-газу: СО+Н2 під дією каталізаторів) відбувається за схемою:

Промисловий метод добування альдегідів, які легко відновлюються до відповідних спиртів, було розроблено в США.
5.7. Окиснення алкенів.
Окиснення відбувається дуже легко, а характер продуктів реакції залежить від природи окисника та умов перебігу реакцій.
5.7.1. Окиснення без розриву подвійного зв’язку в олефінах.
5.7.1.1. Реакція Прилєжаєва (1912 р.):
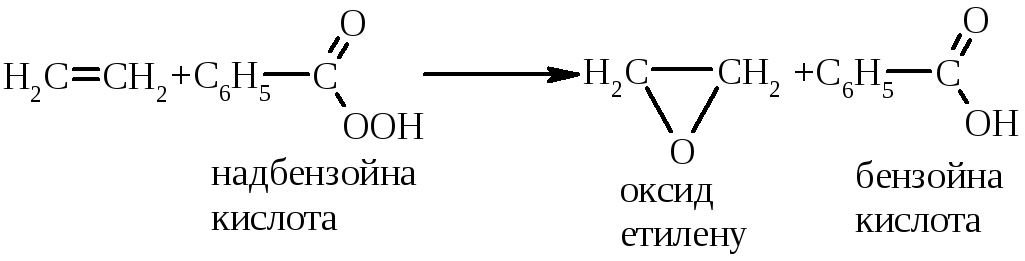
|
|
промисловий метод добування оксиду етилену (оксирану) |
5.7.1.2. Реакція Вагнера (1888 р.):
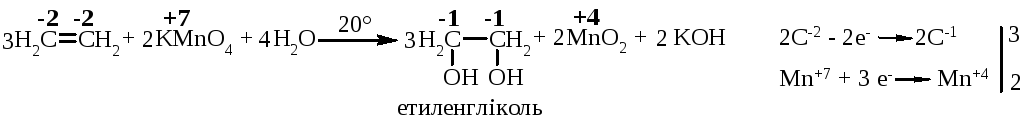
Якщо ввести термін „умовного ступеня окиснення” для атома карбону в органічних сполуках, то у таких реакціях стехіометричні коефіцієнти можна розставляти за допомогою електронного балансу.
5.7.2. Окиснення алкенів із
розривом подвійного зв’язку (реакція
відбувається в жорстких умовах із
використанням сильних неорганічних
окисників: ![]() ↑):
↑):
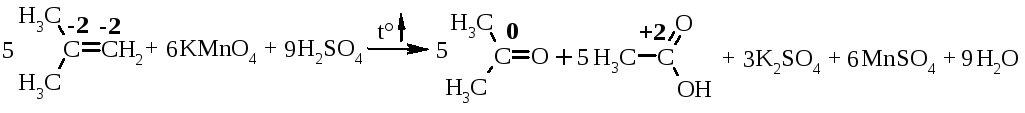

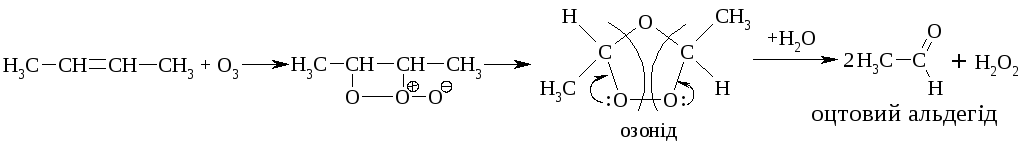
Алкени окиснюються під дією озону (озоноліз):

 в алкенах наведена в табл. 6.2. При цьому
необхідно відмітити, що енергії
дисоціації зв’язку С–Н в алканах і
алкенах
в алкенах наведена в табл. 6.2. При цьому
необхідно відмітити, що енергії
дисоціації зв’язку С–Н в алканах і
алкенах