
- •Дніпропетровський університет імені альфреда нобеля
- •1. Програма дисципліни Розділ 1. Основи загальної, неорганічної та аналітичної хімії
- •Тема 1. Основні закони хімії як базис хімічних методів аналізу
- •Тема 2. Залежність властивостей речовин від будови атомів та природи хімічних зв'язків
- •Тема 3. Класифікація неорганічних сполук. Комплексні сполуки, їх застосування у методах аналізу
- •Тема 4. Молекулярно-іонна рівновага в розчинах
- •Тема 5. Окисно-відновні реакції, їх застосування в одержанні речовин та у методах аналізу
- •Тема 6. Хімія металів
- •Тема 7. Хімія неметалів
- •Тема 8. Основи якісного хімічного аналізу сировини та матеріалів
- •Тема 9. Кількісний аналіз. Метрологія хімічного аналізу
- •Тема 10. Вплив електромагнітного поля на речовину. Оптичні методи дослідження сировини та матеріалів
- •Тема 11. Енергетика хімічних реакцій. Калориметрія
- •Тема 12. Кінетика хімічних реакцій та каталіз. Кінетичні методи дослідження
- •Тема 13. Гетерогенні (фазові) рівноваги. Екстракція
- •Тема 14. Колігативні властивості розчинів. Кондуктометричний та потенціометричний методи дослідження розчинів
- •Тема 15. Поверхневі явища та адсорбція. Хроматографія
- •Тема 16. Дисперсні системи. Колоїдні розчини, їх одержання, властивості, дослідження
- •Тема 17. Мікрогетерогенні системи. Високомолекулярні сполуки (вмс), їх розчини. Гелі та драглі. Напівколоїди
- •Розділ 2. Хімія органічних речовин та методи їх дослідження
- •Тема 18. Особливості, будова і класифікація органічних сполук
- •Тема 19. Вуглеводні
- •Тема 20. Спирти та феноли
- •Тема 21. Карбонільні сполуки (альдегіди і кетони)
- •Тема 22. Карбонові кислоти та їх похідні. Ліпіди
- •Тема 23. Гідроксикислоти
- •Тема 24. Вуглеводи
- •Тема 25. Аміни та амінокислоти. Білки
- •Тема 26. Гетероциклічні сполуки
- •2. Орієнтовний перелік питань для підсумкового контролю і семестр
- •Іі семестр
- •3. Тематика контрольних робіт
- •Контрольна робота № 1
- •Контрольна робота №2
- •4. Рекомендована література
- •Навчальне видання
- •Підписано до друку Формат 60х80/16
- •49000, М. Дніпропетровськ, вул. Набережна Леніна, 18.
Контрольна робота №2
Варіант № 1
Теоретичні питання
1. Квантово-механічне трактування ковалентного зв'язку. Параметри хімічного зв'язку. Направленість та насиченість ковалентних зв'язків. Гібридизація атомних орбіталей і просторова конфігурація молекул. σ-, π- та δ- зв’язки. Полярний і неполярний тип зв'язку. Донорно-акцепторний і водневий зв'язки. Характерні особливості іонного зв'язку: ненасиченість і ненапрямленість. Металічний зв'язок. Зв'язок між будовою речовин та їх фізичними властивостями.
2.Основи хімічного аналізу сировини та матеріалів. Ідентифікація індивідуальних хімічних сполук та аналіз сировини і матеріалів. Вимоги до реакцій у якісному і кількісному аналізі.
3. Предмет і основні поняття органічної хімії. Класифікація органічних сполук за напрямком та механізмом. Функціональні групи
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) 2,2 -диметил-2-гексен;
б) 2,3,4 -триметилоктан;
в) пропаналь-1.
2. Написати ізомери н-гептану, вказати назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
С2Н2 → СН3ОН → С5Н5ОН → СН3СООН → СН3СООСН3.
4. Який об’єм водню виділяється при взаємодії етилену з атомарним киснем, що виділився з перманганату калію масою 15,8 г?
5. Вивести формулу речовини, що містить вуглець (масова частка 81,8%) та водень (18,2 %).
6. При згорянні речовини масою 5,64 г одержали Н2О масою 3,84 г та СО2 масою 15,94 г. Крім С та Н у складі речовини знаходиться азот (15,38 %). Визначити емпіричну формулу речовини. До якого класу органічних сполук вона належить?
7. Дано три органічні речовини: етиловий спирт, оцтовий альдегід та оцтова кислота. За допомогою якісних хімічних реакцій визначити кожну сполуку. Обґрунтуйте відповідь, складіть рівняння реакцій.
Методичні вказівки
1. У відповідях на запитання 1-3 треба навести:
- пояснення причин утворення хімічних зв'язків, сутність ковалентних зв’язків, гібридизації атомних орбіталів і залежність просторової конфігурації молекул від типу хімічних зв'язків; характерні особливості σ-, π- та δ- зв'язків: зв'язок між будовою речовин та їх фізичними властивостями;
- суть хімічного аналізу сировини та матеріалів, методи ідентифікації індивідуальних хімічних сполук та аналіз сировини і матеріалів. Визначити вимоги до реакцій у якісному і кількісному аналізі;
- визначити поняття "органічної хімії" та "органічної речовини"; навести класифікацію органічних сполук за напрямком, механізмом та присутністю функціональних груп.
2. Алгоритм розв'язання задач може бути таким:
- спочатку треба уважно прочитати умову задачі і намагатися зрозуміти її суть;
- записати скорочено умову і вимогу задачі, використовуючи при цьому загальновживані позначення величин;
- проаналізувати умову задачі, встановити логічні зв'язки між даними величинами і шуканою;
- виконати розрахунки в тих одиницях вимірювання, які задані умовою задачі;
- записати повну відповідь.
Варіант № 2
Теоретичні питання
1. Протолітична теорія кислот і основ.
2. Об'ємний аналіз. Метод нейтралізації. Розрахунки в титриметрії. Визначення твердості води.
3. Вуглеводні. Алкани. Гомологічний ряд, номенклатура та ізомерія насичених вуглеводнів. Знаходження у природі. Способи одержання. Фізичні та хімічні властивості алканів. Поняття про ланцюгові реакції. Нафта, її склад та шляхи переробки. Крекінг.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) 3-метил-бутен-1;
б) 2,2,4,4-тетрометилпентан;
в) 2,4,4-триметилгексанова кислота.
2. Написати ізомери н-бутану, вказати назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
О
СН2 = СН2 СН3 – С – ОС2Н5 С2Н5ОН СН2 = СН2
4. Визначити молекулярну формулу речовини, що вміщує вуглець (иасова частка 83,72 %) та водень (16,28 %), якщо молекулярна маса речовини дорівнює 86.
5. Як визначити гліцерин і глюкозу за якісною реакцією з розчином Сu(ОН)2. Обґрунтувати відповідь, навести рівняння реакції.
6. Напишіть рівняння реакцій, за допомогою яких можливо з целюлози одержати:
а) етанол;
б) оцтово-етиловий ефір;
в) триацетат целюлози.
7. Який об’єм водню буде витрачено на відновлення глюкози масою 36 г та скільки грамів шестиатомного спирту (сорбіту) при цьому може бути одержано?
Методичні вказівки
У відповідях на запитання 1-3 треба навести:
- пояснення теорії Льюіса – Бренстеда, визначити поняття кислоти та основи;
- сутність об'ємного аналізу, методу нейтралізації. Пояснити проведення розрахунків у титриметрії та визначення твердості води. Описати способи усунення твердості води;
- визначити поняття вуглеводні, алкани, гомологічний ряд;
- пояснити номенклатуру та ізомерію насичених вуглеводнів;
- описати знаходження алканів у природі, способи одержання, фізичні та хімічні властивості;
- розкрити поняття про ланцюгові реакції.
Варіант № 3
Теоретичні питання
1. Комплексні сполуки. Комплексонометрія. Індикатори комп-лексонометрії.
2 Алкени. Загальна формула. Структурна і просторова ізомерія. Номенклатура. Знаходження у природі та способи синтезу. Фізичні та хімічні властивості. Реакції електрофільного приєднання та їх механізм. Приєднання галогенів, галогеноводнів, води, сірчаної кислоти. Сучасне трактування правила Марковникова. Окислення олефінів.
3. Електричні та оптичні властивості молекул. Поляризація та молекулярна рефракція. Діелькометрія і рефрактометрія.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) 2,5-диметил-3-гептан;
б) 2 метил-бутен-2;
в) 2,2-диметилпропанова кислота.
2. Напишіть ізомери н-пентану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
СаС2 С2Н6 СН3СОН СН3СООН СН3СООС2Н5
4. Один літр газу при нормальних умовах (н.у.) має масу 2,58 г. Визначити його відносну молекулярну масу та густину за повітрям.
5. Дано три органічні сполуки: пропаналь, гліцерин, оцтовоетиловий ефір. Визначити кожну сполуку за допомогою якісних реакцій.
6. Глюкоза масою 9 г реагує у лужному середовищі з гідроксидом міді(ІІ) за наступною реакцією:
О

С
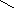 6Н7О(ОН)5
+ Сu(ОН)2
С6Н7О(ОН)3
Сu
+ 2 Н2О
6Н7О(ОН)5
+ Сu(ОН)2
С6Н7О(ОН)3
Сu
+ 2 Н2О
О
Скільки грамів глюконату міді при цьому може бути одержано?
7. Який об’єм водню за нормальних умов потрібен для перетворення триоометану масою 13,26 кг у твердий жир, якщо виробничі залишки водню складають 15 %?
Методичні вказівки
У відповідях на запитання 1-3 треба:
- навести пояснення будови комплексних сполук, проведення комплексонометріі. Описати індикатори комплексонометрії;
- навести визначення етиленових вуглеводнів, їх номенклатуру, особливості ізомерії, знаходження у природі, фізичні та хімічні властивості та способи синтезу;
- визначити електричні та оптичні властивості молекул, їх поляризацію та використання молекулярної рефракції для установлення будови молекул.
Варіант № 4
Теоретичні питання
1. Гравіметричний аналіз. Аргентометрія. Сутність, позитивні і негативні сторони вагового методу та сфери його застосування. Техніка роботи, обладнання та обчислення у гравіметрії. Методи Мора та Фольгарда.
2. Алкіни. Загальна формула, номенклатура. Гомологічні ряди, ізомерія. Фізичні та хімічні властивості. Промислові методи одержання ацетиленових вуглеводнів. Приєднання водню, галогенів, галогеноводнів, води, спиртів, карбонових кислот, ціановодневих кислот. Механізм реакцій електрофільного і нуклеофільного приєднання. Ацетилен і полімери на його основі.
3. Фотометрія та емісійна спектроскопія. Молекулярна спектроскопія як метод дослідження сировини та матеріалів.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) 2,4-диметил-3,3-диетилпентан;
б) 2,2,4,4-тетраметил-3,5-диетилгептанова кислота;
в) α-аміномасляна кислота.
2. Напишіть ізомери н-гексану, вкажіть назви хімічних сполук..
3. За допомогою яких реакцій можна здійснити наступні перетворення:
СН4 С2Н6 С2Н4 СН3СОН С2Н5ОН СН3СООН
4. Написати формулу гомолога метану, при згорянні якого виділяється у 5 разів більше диоксиду вуглецю.
5. Дано три органічні сполуки: етиловий спирт, оцтовий альдегід та оцтова кислота. Визначити кожну сполуку за допомогою якісних реакцій.
6. Утворення глюкози в процесі фотосинтезу можна представити у вигляді наступних рівнянь:
6 СО2 + 6 Н2О С6Н12О6 + 6 О2 + 2692 кДж
Кожен квадратний сантиметр земної поверхні за хвилину одержує приблизно 2 Дж сонячної енергії. Скільки часу потрібно, щоб в 10 листочках з’явилась глюкоза масою 0,9 г, якщо площа кожного листочка складає 10 см2, а сонячна енергія використовується тільки на 10 %?
7. Скільки грамів кислоти та спирту одержано в результаті реакції гідролізу метилпропіонату масою 80 г?
Методичні вказівки
У відповідях на запитання 1-3 треба:
- дати пояснення основ гравіметричного аналізу та аргентометрії. Висвітити сутність, позитивні і негативні сторони вагового методу. Описати сутність методів Мора та Фольгарда;
- навести визначення ацетиленових вуглеводнів, їх загальну формулу та номенклатуру. Пояснити особливості ізомерії, фізичних та хімічних властивостей. Розкрити механізм реакцій електрофільного і нуклеофільного приєднання;
- визначити сутність фотометрії та емісійної спектроскопії. Викласти основу молекулярної спектроскопії як метод дослідження сировини та матеріалів.
Варіант № 5
Теоретичні питання
1. Хімічна кінетика. Швидкість реакцій та фактори, що її визначають. Закон діючих мас та константа швидкості реакції. Теорія активних зіткнень молекул. Енергія активації. Каталіз.
2. Алкадієни. Три типи дієнових вуглеводнів. Номенклатура. Спряжені системи, ефект спряження. Способи одержання дивінілу та ізопрену. Фізичні та хімічні властивості.
3. Поверхневі явища та адсорбція на рідких та твердих поверхнях. Поверхневий натяг, поверхневоактивні речовини. Рівняння адсорбції Гіббса. Ізотерма адсорбції.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) метилетилацетилен;
б) 3,4-диметил-пентен-1;
в) 3,5-дипропіланілін.
2. Напишіть ізомери н-гептану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
СаС2 С2Н2 С2Н4 С2Н5ОН СН3 – С = О
О

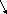 О Н
О Н
С2Н3 – С – Н С2Н4 – С – Н
4. Напишіть формулу гомолога метану, якщо відомо, що маса 5,6 л його за нормальних умов (н.у.) дорівнює 11 г.
5. Дано три органічні сполуки: етан, етилен, ацетилен. Визначити кожну речовину за допомогою якісних реакцій.
6. Скільки літрів етилового спирту (густиною 0,79) з масовою часткою С2Н5ОН 95 % буде отримано при спиртовому бродінні глюкози масою 36 кг?
7. Скільки мл 2 М розчину аОН треба витратити на реакцію гідролізу триотеорату, щоб одержати стеарат натрія масою 15,3 г?
Методичні вказівки
У відповідях на запитання 1-3 треба:
- навести пояснення основ хімічної кінетики та факторів, що впливають на швидкість хімічних реакцій. Описати закон діючих мас та константу швидкості реакції. Визначити сутність теорії активних зіткнень молекул та енергії активації реакції;
- навести визначення алкадієнів, їх типи. Пояснити номенклатуру та особливість властивостей сполучених систем. Описати способи одержання дивінілу та ізопрену, їх фізичні та хімічні властивості;
- визначити сутність поверхневих явищ та адсорбції на рідких та твердих поверхнях. Пояснити рівняння адсорбції Гіббса, ізотерм адсорбції.
Варіант № 6
Теоретичні питання
1. Основи хімічної термодинаміки. Термодинамічний метод дослідження. Перший початок термодинаміки. Термодинамічні функції стану. Внутрішня енергія та ентальпія. Термохімія. Закон Гесса. Хімічна рівновага.
2. Арени. Поняття про ароматичність. Джерела одержання, застосування. Формула Кекуле. Сучасні уявлення про будову бензолу. Гомологічний ряд бензолу. Номенклатура, ізомерія. Методи одержання бензолу та його гомологів. Фізичні та хімічні властивості. Реакції електрофільного заміщення і їх механізм. Правила заміщення у бензольному ядрі.
3. Гетерогенні системи. Рівновага в гетерогенних системах. Правило фаз Гіббса.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) триметилетилен;
б) 2,5-диметил-5-етил-3-ізопропілгептан;
в) -аміномасляна кислота.
2. Напишіть ізомери н-пентану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
СН4 С2Н2 С6Н6 С6Н5Сl С6Н5ОН
4. Скільки грамів метилхлориду отримали при хлоруванні метану об’ємом 10 л при н.у.?
5. Дано три органічні сполуки: глюкоза, цукроза, крохмаль. Визначити кожну речовину за допомогою якісних реакцій.
6. Скільки грамів метилформіату можна одержати з 40 г спирту з масовою часткою 96 % та кислоти масою 60 г з масовою часткою 40 %, якщо вихід його дорівнює 90 % від теоретичного?
7. Через 3 М розчин оцтової кислоти, об’ємом 3 л, пропустили аміак, об’ємом 44,8 л. Скільки грамів карбонату кальцію може вступити в реакцію з розчином кислоти після пропускання через нього аміаку?
Методичні вказівки
У відповідях на запитання 1-3 треба:
- пояснити основи хімічної термодинаміки та термодинамічного методу дослідження. Визначити термодинамічні функції стану, внутрішню енергію та ентальпію;
- навести визначення аренів, розкрити поняття про ароматичність та сучасні уявлення про будову бензолу. Описати правила заміщення у бензольному ядрі;
- визначити сутність гетерогенних систем, рівноваги у гетерогенних системах.
Варіант № 7
Теоретичні питання
1. Електрохімія. Стандартні електроди, рівняння Нернста. ЕРС електрохімічного елемента Потенціометрія і полярографія.
2. Альдегіди і кетони. Будова, ізомерія і номенклатура. Фізичні і хімічні властивості. Реакції з ціановодневою кислотою, магнійгалогеналкілами, гіпосульфатом натрію, аміаком, гідроксил аміном, гідразином, утворення ацеталів і напівацеталів. Полімеризація альдегідів. Альдольна і кротонова конденсації. Реакція срібного дзеркала.
3. Напівколоїди та розчини високомолекулярних сполук. Агрегатний стан полімерів. Набухання, осмотичний тиск, в'язкість. Визначення молекулярної маси.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) тетраметилметан;
б) 4-метилпентен-1;
в) аміно оцтова кислота.
2. Назвіть ізомери н-гептану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
СаС2 С2Н2 С2Н4 С2Н6 С2Н5Сl С2Н5ОН
4. Визначити вміст вуглецю в 1 м3 природного газу, що вміщує метан (92%), етан (4 %) та неорганічні домішки.
5. Дано три органічні сполуки: гліцерин, анілін, мурашина кислота. Визначити кожну речовину за допомогою якісних (або характерних) реакцій.
6. Визначити масу технічної оцтової кислоти з масовою часткою домішок 10 %, що необхідно для одержання оцтового ангідриду масою 10,2 г.
7. Яка маса оксиду срібла (І), що вміщує 5 % домішок, потрібна для окиснення глюкози кількістю речовини 0,5 моль до глюконової кислоти?
Методичні вказівки
У відповідях на запитання 1-3 треба:
- пояснити основи електрохімії. У чому сутність стандартних електродів, рівняння Нернста, потенціометрії та полярографії?
- визначити альдегіди і кетони. Опишіть їх будову, ізомерію та номенклатуру, схожість та різницю між фізичними і хімічними властивостями;
- визначити сутність напівколоїдів та розчинів високомолекулярних сполук, явища набухання, осмотичного тиску та в'язкості.
Варіант № 8
Теоретичні питання
1. Дисперсні системи. Особливості колоїдного стану речовини. Діаліз, електродіаліз, ультрафільтрація. Правило Пєскова-Фаянса.
2. Карбонові кислоти та їх похідні. Класифікація, номенклатура та ізомерія. Способи одержання, фізичні та хімічні властивості. Галогенангідриди, аміди, нітрили.
3. Оптичні методи дослідження колоїдних систем. Молекулярно-кінетичні властивості колоїдних систем. Седиментаційний аналіз.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) диметилпропілізопропілметан;
б) 3-метил-5-пропіл-3-бутил-4-карбоксідекан;
в) 2-метилпропаналь.
2. Напишіть ізомери н-гексану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
С СН4 СН3Сl С2Н4 С2Н5ОН
4. Визначіть молекулярну формулу газоподібної сполуки, якщо її густина за повітрям дорівнює двом, а масова частка вуглецю 82,76 % та водню 17,24 %.
5. Який об’єм аміаку потрібен для перетворення бромоцтової кислоти масою 27,8 г у гліцин, якщо витрати аміаку дорівнюють 5 %?
6. Напишіть рівняння реакції повного окиснення глюкози. Визначте об’єм оксиду вуглецю (ІV), що зявиться при повному окисленні глюкози кількістю речовини 2 моль.
7. Скільки грамів етилброміду одержано при нагріванні етилового спирту у розчині бромоводневої кислоти (густиною 1,2) об’ємом 120 мл з масовою часткою НВr 40 %?
Методичні вказівки
У відповідях на запитання 1-3 треба:
- дати визначення дисперсних систем, пояснити особливості колоїдного стану речовини, пояснити сутність діалізу, електродіалізу та ультрафільтрації;
- дати визначення карбонових кислот та їх похідних. Описати їх класифікацію, номенклатуру та ізомерію. Розкрити особливість фізичних та хімічних властивостей;
- визначити сутність оптичних методів дослідження колоїдних систем та седиментаційного аналізу.
Варіант № 9
Теоретичні питання
1. Мікрогетерогенні системи. Класифікація, одержання, властивості, стійкість.
2. Вуглеводи. Класифікація, знаходження у природі. Моносахариди. Стереохімія моноз. Таутомерія і явище мутаротації. Пентози, гексози. Полісахариди.
3. Математична обробка результатів аналізу.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) метилетилпропілбутилметан;
б) 2-метил-3-пропіл-4-карбоксінонан;
в) 2-амінобутан.
2. Напишіть ізомери н-пектану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
С СН4 СН3Сl С3Н8 С3Н7Вr
4. Виведіть молекулярну формулу речовини, яка вміщує вуглець (масова частка 85,7 %) та водень (14,3 %), густина за воднем дорівнює 21.
5. Скільки грамів аніліну необхідно взяти для нейтралізації розчину хлоридоводневої кислоти (густиною 1,19) об’ємом 7,7 мл з масовою часткою НСl 40 %?
6. Який об’єм повітря (кисню 21 %) необхідно витратити на спалювання етилового спирту (густиною 0,8) з масовою часткою С2Н5ОН 96 % об’ємом 500 мл та скільки літрів СО2 при цьому виділиться?
7. Скільки необхідно взяти розчину С2Н5ОН (густиною 0,8) з масовою часткою С2Н5ОН 96 % для одержання оцтової кислоти масою 30 кг?
Методичні вказівки
У відповідях на запитання 1-3 необхідно:
- дати визначення мікрогетерогенних систем, пояснити особливості їх стану та стійкості;
- дати визначення вуглеводів, описати їх класифікацію, знаходження у природі. Поясніть особливість будови моносахаридів та стереохімії моноз. Описати їх класифікацію та номенклатуру. Розкрити особливість фізичних та хімічних властивостей пентоз, гексоз та полісахаридів;
- визначити сутність математичної обробки результатів аналізу. Описати класифікацію помилок вимірювання, визначення точності вимірювання та точності розрахунків.
Варіант № 10
Теоретичні питання
1. Гелі та драглі. Структурно-механічні властивості. Механізм утворення. Класифікація.
2. Полімери. Поняття про високомолекулярні сполуки. Методи синтезу (полімеризація, співполімеризація, конденсація). Фізико-хімічні властивості полімерів. Натуральний та синтетичний каучук.
3. Коагуляція та стабілізація колоїдних систем. Кінетична та агрегативна стійкість дисперсних систем. Теорія Дерягіна та Ландау.
Задачі
1. Напишіть формули органічних сполук за їх назвою:
а) диметилбутилізобутилметан;
б) 2-метил-3-етил-4-нітродекан;
в) п-нітроанілін.
2. Напишіть ізомери н-бутану, вкажіть назви хімічних сполук.
3. За допомогою яких реакцій можна здійснити наступні перетворення:
СН4 СН3Сl С2Н6 С2Н5Сl C3Н8
4. При спалюванні газоподібної сполуки вуглеводню одержали диоксид вуглецю масою 3,3 г та води масою 2,02 г. Густина його за повітрям становить 1,04. Вивести структурну формулу вуглеводню.
5. Скільки тон спирту з масовою часткою 96 % можна одержати прямою гідралізацією етилену масою 1 т?
6. Скільки тон цукрового буряку з масовою часткою цукру 20 % буде взято для гідролізу, щоб отримати глюкозу масою 1 т?
7. Яка маса аніліну може бути отримана при пропусканні водню крізь розчин нітробензолу, що одержаний при взаємодії заліза з 0,5 М розчином хлоридоводневої кислоти об’ємом 200 мл?
Методичні вказівки
У відповідях на запитання 1-3 необхідно:
- дати визначення гелів та драглів, описати механізм утворення та структурно-механічні властивості;
- дати визначення полімерів, високомолекулярних сполук. Описати їх методи синтезу та особливості фізико-хімічних властивостей полімерів;
- визначити сутність процесів коагуляції та стабілізації колоїдних систем, описати їх кінетичну та агрегативну стійкість.
