
- •Часть I
- •Тема 3. Химическая термодинамика и кинетика.
- •Основные понятия и определения.
- •Первый закон термодинамики
- •Изменение энтальпии в различных химических и физико-химических процессах.
- •Второй закон термодинамики.
- •Абсолютная энтропия идеального кристалла при ок равна нулю.
- •Энергия Гиббса.
- •Анализ уравнения Гиббса.
- •Основные понятия.
- •Закон действия масс
- •Зависимость скорости от температуры.
- •2.3 Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Принцип Ле-Шателье. Фазовые равновесия. Правило фаз. Химическое равновесие.
- •Химическая кинетика. Химическое равновесие. Правило Ле Шателье-Брауна.
- •Фазовые равновесия.
- •Правило фаз.
- •Катализ Общие понятия.
- •Фотохимические реакции.
- •Тема 4. Растворы
- •Классификация дисперсных систем.
- •Общие свойства растворов.
- •Растворимость
- •Энергетика процесса растворения.
- •4.2Два вида электролитов: сильные и слабые электролиты. Электролитическая диссоциация в водных растворах. Ионное произведение воды. Водородный показатель. Электролиты и неэлектролиты.
- •Водородный показатель, или pH раствора.
- •Тема 5. Окислительно-восстановительные и электрохимические процессы.
- •5.1.Электрохимические процессы. Равновесие на границе металл-раствор. Электродный потенциал. Уравнение Нернста. Водородный электрод. Ряд напряжений. Гальванический элемент. Электродвижущая сила.
- •Электроны от перешли к ионам восстановили их в свободный металл и в растворе остались ионы железа.
- •Термодинамика гальванического элемента
- •Уравнение Нернста для определения потенциала при любых условиях
- •5.2. Электрохимические источники тока.
- •Химические цепи.
- •Свинцовый аккумулятор
- •Щелочной аккумулятор:
- •Топливные элементы.
- •Тема 2. Строение вещества
- •Валентность.
- •Тема 6. Химическая идентификация и анализ вещества.
- •6.1 Химическая идентификация вещества. Идентификация катионов и анионов. Количественный анализ: гравиметрический, титриметрический анализ.
- •Химическая идентификация вещества
- •Количественный анализ.
- •6.2 Инструментальные методы анализа.
- •Тема 7.Свойства металлов и их соединений
- •7.1. Физические и химические свойства металлов. Получение металлов. Металлические сплавы и композиты.
- •Тема 8 Полимерные материалы и их применение
- •8.1 Методы получения полимеров: полимеризация, поликонденсация. Свойства полимеров. Применение полимеров и олигомеров.
- •Тема 9. Заключительная лекция.
- •9.1. Экологические проблемы общества. Охрана воздушного и водного бассейна. Предельно допустимые нормы содержания вредных веществ в биосфере. Очистка сточных вод.
- •Классификация сточных вод и примесей в них.
- •Методы и оборудование для очистки сточных вод.
- •Биологическая очистка сточных вод.
- •Проверка воды на содержание газов. Дегазация.
- •Умягчение воды.
- •Методы опреснения воды
- •Электродиализ
- •Метод обратного осмоса
- •Опреснение воды вымораживанием
- •Метод опреснения воды основанный на явлении гидратации
- •Метод солнечной дистилляции
- •Список литературы
Фазовые равновесия.
Р авновесие
процесса перехода одной фазы в другую
без изменения химического состава
называется фазовым равновесием. Примерами
фазового равновесия могут быть следующие
процессы:
авновесие
процесса перехода одной фазы в другую
без изменения химического состава
называется фазовым равновесием. Примерами
фазового равновесия могут быть следующие
процессы:

испарение


Для фазового равновесия соблюдается принцип Ле Шателье.
При повышении температуры равновесие смещается в сторону эндотермического процесса, например, плавления и испарения. С увеличением давления равновесие смещается в сторону процессов, при которых газ или пар превращаются в жидкое или твёрдое состояние.
Правило фаз.
Сформулировано Дж. Гиббсом. Число степеней свободы C, фазФ, независимых компонентовКи внешних условийн, влияющих на равновесие, взаимосвязаны соотношением:
C + Ф = К + н
Механизм химической реакций. Цепные реакции. Фотохимические процессы. Гомогенный и гетерогенный катализ. Автокатализ. Ферментативный катализ. Каталитические яды. Колебательные реакции.
Энергия активации. Энергетический профиль реакции.
Реакции происходят в результате непосредственного столкновения молекул. Однако не все столкновения приводят к химическому взаимодействию. Образованию новых веществ способствуют только молекулы, обладающие достаточным запасом энергии. Такие молекулы называются активными молекулами. Та минимальная энергия, достаточная для начала химической реакции называется энергией активации и выражается в ккал или кДж. Чем меньше энергия активации, тем быстрее идет реакция.
В реакциях, где энергия активации больше, чем 150 кДж при t=25°С скорость очень мала или практически эти реакции не протекают. В реакциях, где энергия активации меньше 60 кДж, скорость очень большая (взрыв).
Величина энергии активации Еа зависит от природы реагирующих элементов и служит характеристикой каждой реакции.

Рис. 2.6
Энергетическая диаграмма хода реакции с образованием
активированного комплекса.
Чтобы реагирующие вещества А и В образовали продукты реакции С и Д они должны преодолеть энергетический барьер МL. На это затрачивается энергия активации Еа. При этом в ходе реакции из частиц реализующих веществ, образуется промежуточная неустойчивая группировка - активированный комплекс (рис.2.6).
Этот комплекс распадается с образованием конечных продуктов, причем выделяется такое количество энергии, которое позволяет конечным продуктам спуститься до уровня средней энергии конечных продуктов.
Т.о. изменение продуктов можно выразить в виде схем для эндотермической и экзотермической реакции (рис.2.7, 2.8).
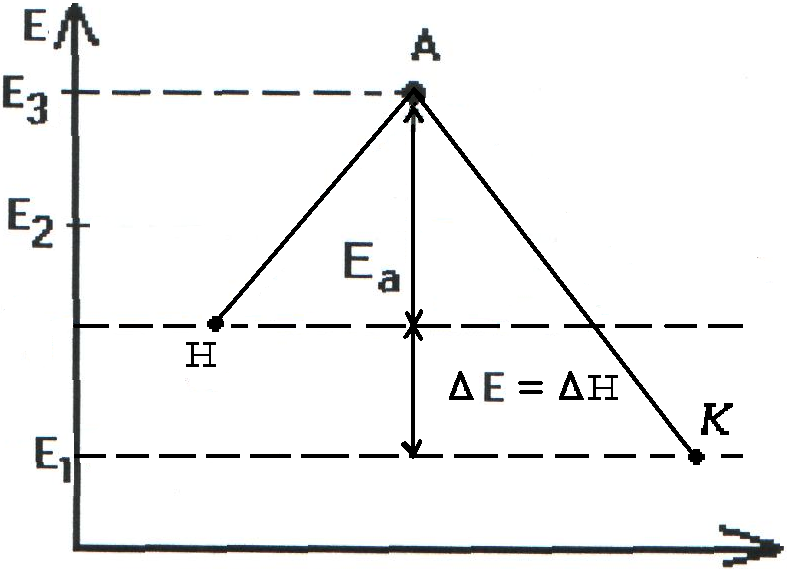
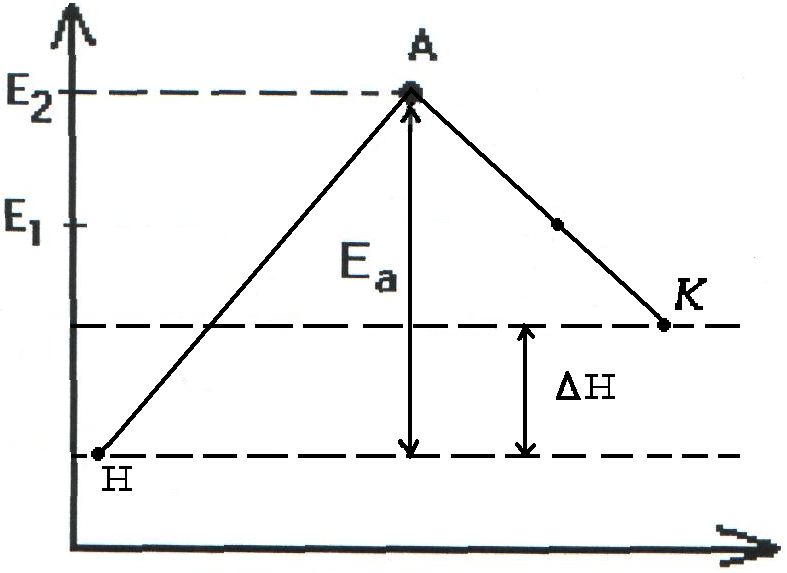
схема протекания
экзотермической
реакции
схема протекания
эндотермической
реакции
Рис. 2.7
Рис. 2.8
О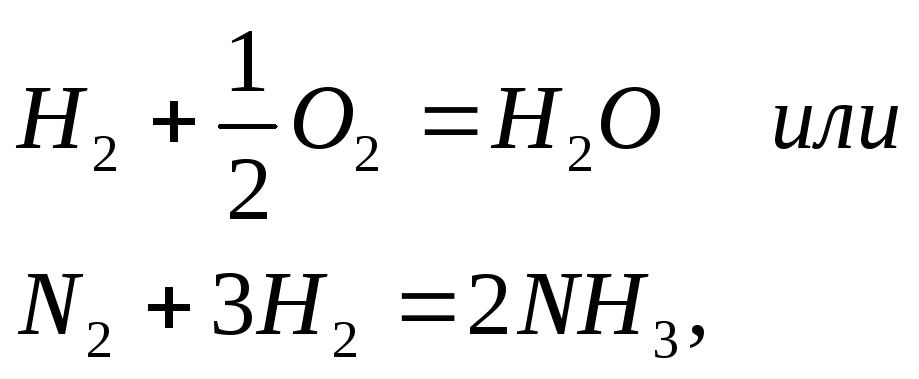 бычно
реакции между веществами с прочными
ковалентными связями характеризуются
большими значениями Еа и идут медленно.
Это относится ко многим взаимодействиям,
как
бычно
реакции между веществами с прочными
ковалентными связями характеризуются
большими значениями Еа и идут медленно.
Это относится ко многим взаимодействиям,
как
скорость которых при стандартных условиях равна 0.
М![]() алыми
значениями Еа и очень большими
скоростями характеризуются ионные
взаимодействия в растворах
алыми
значениями Еа и очень большими
скоростями характеризуются ионные
взаимодействия в растворах
