
Работа выхода и красная граница фотоэффекта
-
Металл
Авых
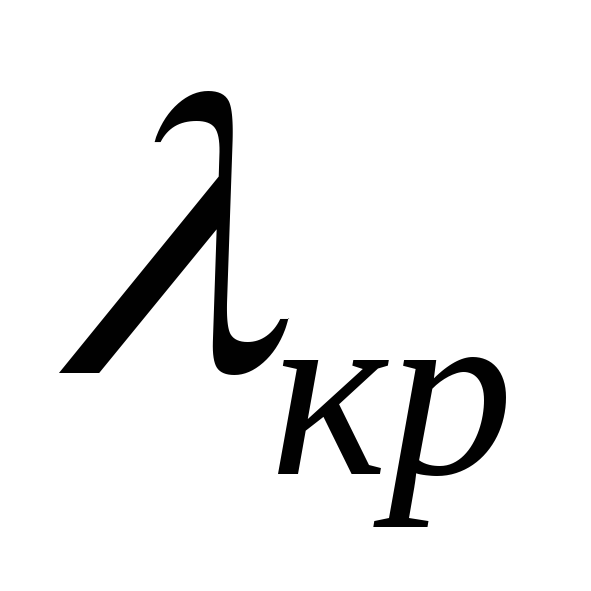

Cs
K
Na
Li
Al, Zn
W, Cu
Ag
Ni
Pt
1,9
2,0
2,27
2,4
3,74
4,5
4,74
4,84
5,3
660
620
550
517
330
275
260
256
234
Давление света. В опытах П.Н. Лебедева показано, что свет оказывает давление на поверхность. Значение давления можно определить по формуле
![]()
где N– число
фотонов, падающих в единицу времени на
единицу площади поверхности,![]() – энергия одного фотона,c– скорость
света,
– энергия одного фотона,c– скорость
света,![]() – коэффициент отражения поверхности.
Для зеркальной поверхности
– коэффициент отражения поверхности.
Для зеркальной поверхности![]() для абсолютно черной
для абсолютно черной![]() ;
поэтому давление света на зеркальную
поверхность вдвое больше, чем на абсолютно
черную.
;
поэтому давление света на зеркальную
поверхность вдвое больше, чем на абсолютно
черную.
Отметим, что
величина
![]() есть плотность потока энергии излучения
(энергия, переносимая через единицу
площади в единицу времени).
есть плотность потока энергии излучения
(энергия, переносимая через единицу
площади в единицу времени).
3. Эффект Комптона
Эффект Комптона.
Существо фотоэффекта заключается во
взаимодействии фотона сосвязаннымэлектроном, находящимся в поле ионов
кристаллической решетки. В противоположность
этомуэффект Комптонадемонстрирует
рассеяние (столкновение, взаимодействие)
фотона насвободном электроне. При
этом оказывается, что длина волны
рассеянного фотона![]() (после столкновения) существенно зависит
от угла рассеяния
(после столкновения) существенно зависит
от угла рассеяния![]() (рис. 2.3). Иначе говоря, фотоны, рассеянные
под разными углами, имеют разную длину
волны:
(рис. 2.3). Иначе говоря, фотоны, рассеянные
под разными углами, имеют разную длину
волны:
![]() (4)
(4)
где ![]()
где
![]() –комптоновскаядлина волны
электрона,
–комптоновскаядлина волны
электрона,![]() – длина волны падающего фотона,
– длина волны падающего фотона,![]() – масса покоя электрона. Если рассеяние
происходит на других свободных частицах,
например протонах или нейтронах, то
вместо
– масса покоя электрона. Если рассеяние
происходит на других свободных частицах,
например протонах или нейтронах, то
вместо![]() надо подставить массу соответствующих
частиц. При этом говорят о комптоновской
длине волны протона, нейтрона и т.д.
надо подставить массу соответствующих
частиц. При этом говорят о комптоновской
длине волны протона, нейтрона и т.д.
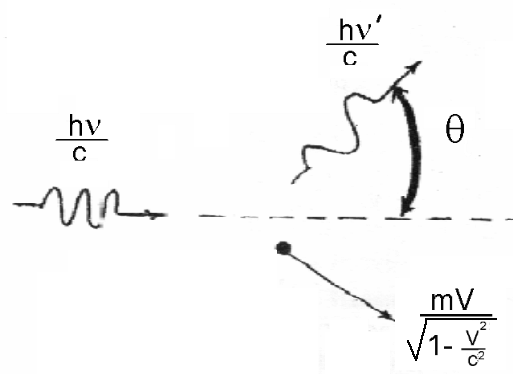
Рис. 4. Эффект Комптона
Соотношение (4) получено на основе законов сохранения импульса и энергии для системы “фотон – свободный электрон”. В эффекте Комптона проявляются квантовые,корпускулярныесвойства излучения.
4. Теория Бора
Спектры атомов. Совокупность длин волн, на которых излучает и поглощает данный атом, называетсяспектром. Атомы могут излучать, если привести их ввозбужденноесостояние путем нагрева или пропускания электрического тока. Опыт показывает, что возбужденные атомные пары излучают светтолько строго определенного набора частот. При наблюдении излучения с помощью спектроскопа возникает картина, состоящая из совокупности тонких линий. Такой спектр называетсялинейчатым. На рис. 5 показан спектр атома водорода.

Рис. 5. Линейчатый спектр атома водорода и экспериментальная схема его получения
Атом водорода: классические представления. У атома водорода существует только один электрон, вращающийся вокруг ядра и, следовательно, обладающий центростремительным ускорением. По классическим представлениям любая ускоренная заряженная частица (в том числе электрон), должна излучать электромагнитные волны в окружающее пространство. Значит, электрон в атоме должен терять энергию на излучение. В свою очередь, уменьшение энергии электрона должно привести к уменьшению его скорости, радиуса орбиты и частоты излучения. В итоге мы приходим к выводу о том, что электрон в атоме должен упасть на ядро, излучив весь спектр электромагнитного излучения. Это противоречит опытным данным, в соответствии с которыми атом устойчив, а излучение возбужденного атома – линейчатое (рис. 5).
Постулаты Бора.Выход из сложившегося противоречия нашел Н.Бор, который предложил свою полуклассическую (отчасти квантовую) теорию атома водорода, основанную на сформулированных им трех постулатах.
Электрон в атоме водорода вращается вокруг ядра по стационарным орбитам, находясь на которых электрон не излучает.
Электрон излучает (или поглощает) при переходе с одной орбиты на другую. Энергия излучаемого (поглощаемого) фотона равна разности энергий электрона на орбитах:
![]() (5)
(5)
При переходе из
состояния с большей энергией в состояние
с меньшей энергией (![]() )
фотон излучается, в противном случае
(
)
фотон излучается, в противном случае
(![]() )
- поглощается.
)
- поглощается.
Момент количества движения (момент импульса) электрона в атоме водорода квантован (принимает строго определенные значения):
![]() (6)
(6)
где
n
– главное
квантовое число,
![]() – постоянная Планка (читается: "аш
перечеркнутое").
– постоянная Планка (читается: "аш
перечеркнутое").
Теория Бора водородоподобных атомов. Водородоподобным называется атом с зарядом ядра +Ze, имеющий один внешний электрон -e, который вращается вокруг ядра по стационарной орбите радиусаr(например, ионы He+, Li2+). Полная энергия электрона в таком атоме представляет собой сумму кинетической и потенциальной энергии
![]() (7)
(7)
Потенциальная энергия здесь отрицательна, что отражает факт притяжения электрона к ядру. Применим второй закон Ньютона к ускоренно движущемуся электрону:
![]() (8)
(8)
где
![]() – кулоновская сила притяжения электрона
к ядру и
– кулоновская сила притяжения электрона
к ядру и![]() – центростремительное ускорение
электрона на орбите радиусаr.
С
учетом этого из (8) получаем выражение
для радиуса
– центростремительное ускорение
электрона на орбите радиусаr.
С
учетом этого из (8) получаем выражение
для радиуса
![]() ,
(9)
,
(9)
для кинетической энергии
![]() (10)
(10)
и для полной энергии (в соответствии с (7))
![]() (11)
(11)
Полная энергия электрона в атоме отрицательна. С увеличением радиуса орбиты энергия возрастает и в то же время стремится к нулю. Нулевая энергия электрона означает отсутствие его связи с ядром, при этом электрон находится в свободном состоянии.
При выводе полученных формул утверждения о квантовании состояний электрона не использовались. Воспользуемся третьим постулатом Бора для вычисления возможных радиусов орбит. Подставляя скорость из (6) в (9), получим
![]() (12)
(12)
где n=1, 2, 3... – номер орбиты. Следовательно, электрон в атоме может находиться на круговых орбитах строго определенного радиуса (3.8), поскольку все другие орбиты запрещены третьим постулатом Бора.
Радиус первой
орбиты атома водорода (Z=1,n=1)
равен![]() называетсяпервым боровским радиусом.
Для остальных орбит имеет место
соотношение
называетсяпервым боровским радиусом.
Для остальных орбит имеет место
соотношение
![]() (13)
(13)
В частности, радиус второй орбиты равен 4r1, третьей 9r1и т.д. (рис. 6).
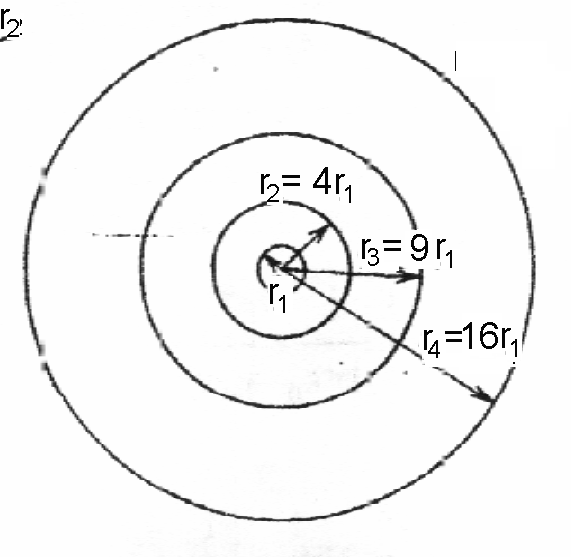
Рис. 6. Боровские орбиты электрона в водородоподобном атоме
Подстановка (12) в (110 позволяет найти полную энергию электрона
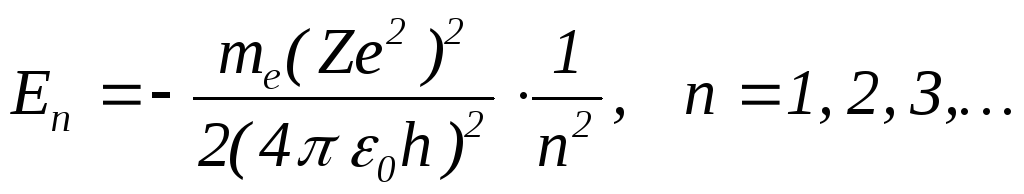 (14)
(14)
Полная энергия электрона (так же как радиус круговой орбиты и момент импульса) может принимать лишь строго определенные значения En, называемымиуровнями энергиив атоме. УровеньE1с наибольшей (по абсолютной величине) энергией называетсяосновным. Остальные уровни называютсявозбужденными. Для водорода (Z=1)E1= -13,6 эВ. В связи с этим вместо (14) удобно пользоваться формулой
![]() (15)
(15)
Структура энергетических уровней атома водорода показана на рис. 7.
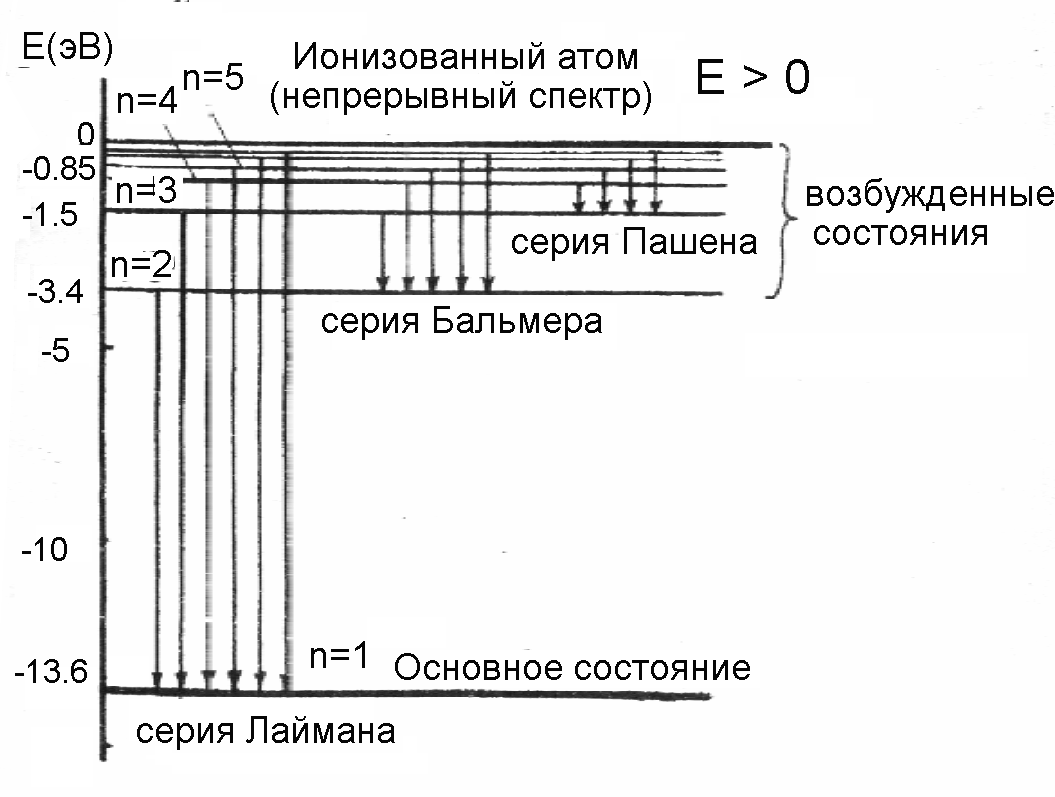
Рис. 7. Структура энергетических уровней атома водорода
Напомним, что значение энергии E=0соответствует отрыву электрона от ядра атома. Поэтому для отрыва электрона, находящегося в основном состоянии, необходимо затратить энергию, равную13,6 эВ. Эта энергия называетсяэнергией ионизацииводорода. ДиапазонE > 0соответствует свободному электрону.
Спектр излучения атома водорода. Рассмотрим структуру энергетических уровней атома водорода (рис.7). Электрон, находящийся в возбужденном состоянии (на возбужденном уровне), в некоторый момент может перейти на уровень с меньшей энергией (совершить “квантовый скачок”), излучив фотон с частотой, соответствующей разности энергий уровней. Если анализировать излучение с помощью спектроскопа, то оказывается, что при этом высвечиваются отдельныесерии линий, каждая из которых порождается переходом со своего энергетического уровня. Согласно второму постулату (5), при переходе с уровняmна уровеньnиспускается квант (Em>En) с частотой
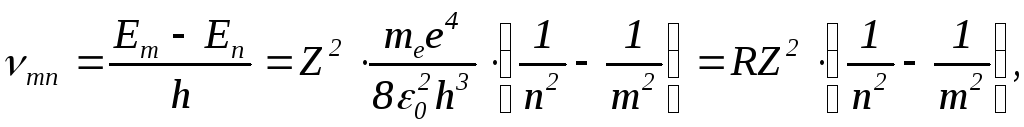 (16)
(16)
где R = 3,29·1015 с-1 – постоянная Ридберга. Формула (16) с высокой точностью подтверждается результатами наблюдений, что подтверждает правильность теории Бора для водородоподобных атомов. Подставляя в (16) m = 1 и n = 1 ,2 ,3, ..., получим группу линий серии Лаймана. При подстановке m = 2, 3, 4, 5 и 6, получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри. В видимой области спектра расположена только серия Бальмера.
Ограниченность теории Бора. По своей сути теория Бора была классической, т.к. опиралась в основном на классическую механику. Поэтому ей присущи определенные недостатки, заключающиеся в том, что теория Бора не смогла объяснить распределение интенсивностивнутрилиний спектра. Теория Бора хорошо описывает спектр только атома водорода и водородоподобных ионов (т.е. ионов, имеющих всего один валентный электрон), в то время как для других атомов теория расходится с экспериментом и поэтому является непригодной.
Теория Бора стала важным шагом на пути построения последовательной квантовой теории, которая смогла устранить указанные недостатки.
