
- •Министерство образования и науки Российской Федерации
- •Редкие элементы ia подгруппы. Общая характеристика элементов
- •Свойства элементов iа подгруппы
- •2. Литий
- •2.1. Химия лития
- •2.1.1. Соединения лития с кислородом
- •Свойства гидроксидов щелочных металлов
- •2.1.2. Галогениды лития
- •Свойства галогенидов лития
- •2.1.3. Соединения лития с другими элементами
- •2.1.4. Сплавы лития с металлами
- •2.2. Важнейшие области применения лития и его соединений
- •2.3. Геохимия лития и сырьевые источники
- •2.3.1. Минералы лития
- •2.3.2. Извлечение лития из солевых растворов
- •Характеристика лгмс наиболее известных месторождений мира
- •2.4. Технология переработки литиевого сырья
- •2.4.1. Обогащение литиевого рудного сырья
- •2.4.2. Общие вопросы технологии лития
- •2.4.3. Переработка сподумена
- •2.4.4. Переработка лепидолита
- •2.4.5. Переработка карбоната лития на гидроксид и хлорид
- •2.5. Получение металлического лития
- •Рекомендуемая литература
2.1.1. Соединения лития с кислородом
Оксид лития Li2O– бесцветное кристаллическое вещество, имеющее кубическую гранецентрированную решетку типа флюорита, CaF2(a = 4,628 Ǻ, Z = 4); плотность 2,013 г/см3(25 ºC), температура плавления 1427 ºC, кипения – около 2000 ºC; термически устойчивое соединение, выше 1000 ºC начинается сублимация. Оксид лития получается при непосредственном окислении металлического лития при температуре выше 200 ºC, а также разложением карбоната Li2CO3, нитрата LiNO3, гидроксида LiOH в токе сухого водорода выше 800 ºC. Существует также пероксид лития, Li2O2, который получают косвенным путем по реакции пероксида водорода со спиртовым раствором LiOH; образующийся гидрат пероксида лития разрушают нагреванием в вакууме:
2
300ºC
2LiOOH + 3H2O → Li2O2 + 4H2O + ½O2 (3)
Выше 350 ºC пероксид лития распадается на оксид и воду.
Оксид лития, Li2O, легко, но менее энергично, чем оксиды других щелочных элементов, взаимодействует с водой с образованием гидроксида, LiOH; реакция сопровождается сильным разогреванием; LiOH поглощает CO2из воздуха, образуя карбонат, Li2CO3. Оксид лития разрушает большинство даже коррозионно устойчивых материалов. Ниже 1000 ºС устойчивы против Li2O никель Ni; золото Au; и платина Pt; выше 1000 ºС – сплав платины с 40 % родия.
Оксид лития с оксидами переходных элементов IV и V-ой групп периодической системы образует многочисленные соединения, из которых наибольший интерес представляют ниобат и танталат лития, LiNbO3и LiTaO3. Эти соединения относятся к группе сегнетоэлектриков с общей формулой ABO3и обладают комплексом разнообразных свойств. Интересны в практическом плане соединения лития и алюминия. Из водных щелочных растворов выделяется плохо растворимый алюминат лития LiAlO2. Изучение системы Li2O – Al2O3– H2O (50ºС) показало, что равновесной твердой фазой является фаза переменного состава (1-x)Li2O∙Al2O3∙nH2O, x=0,12–0,21; n=8. Алюминат лития используется для выделения лития из разбавленных растворов.
Гидроксид лития LiOH – бесцветное вещество, кристаллизуется в тетрагональной сингонии (a = 3,549 Ǻ; c = 4,334 Ǻ); плотность (25 ºС) – 2,54 г/см3. Температура плавления 473 ºС, температура кипения 924 ºС (разлагается) (табл. 2).
Таблица 2
Свойства гидроксидов щелочных металлов
|
Гидроксид |
T пл., ºС |
T кип., ºС |
Растворимость в воде, г /100 г H2O |
ΔH | |
|
15 ºС |
100 ºС | ||||
|
LiOH |
473 |
924* |
12 |
18 |
- 484,7 |
|
NaOH |
323 |
1378 |
42 |
337 |
- 426,3 |
|
KOH |
405 |
1320 |
107 |
179 |
- 424,7 |
|
RbOH |
385 |
1200 |
180 |
980 |
- 418,4 |
|
CsOH |
343 |
1100 |
386 |
очень высокая |
- 417,1 |
П
>600ºC
2LiOH → Li2O + H2O (4)
Для LiOH характерна более низкая по сравнению с гидроксидами других щелочных элементов растворимость в воде, которая увеличивается с повышением температуры (рис. 1), из водных растворов выделяется в виде моногидрата, LiOH∙H2O, который теряет кристаллизационную воду только выше 600 ºС. Гидрат гидроксида лития LiOH∙H2O в твердом виде состоит из димеров Li2(OH)2, связанных в цепочки мостиковыми молекулами воды (рис. 2). Сходные димеры преобладают и в парах LiOH при 800 ºС. При обычной температуре гидроксид лития и его концентрированные растворы разрушают стекло и фарфор, в расплавленном состоянии разрушают все металлы, кроме Au, Ag и Ni. Гидроксид лития образуется при непосредственном взаимодействии металлического лития или его оксида с водой, а также при гидролизе сульфида, нитрида, фосфидов и других соединений лития.
Рис. 1. Политерма
растворимости гидроксида лития в воде
гидроксида
лития в воде
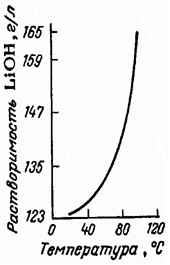
Рис.
2. Строение LiOH
∙ H2O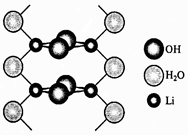
На практике для получения LiOH используют несколько методов.
1. Методы, основанные на реакциях обмена в растворе:
Li2SO4 + Ca(OH)2 → 2LiOH + CaSO4 (5)
Li2SO4 + Ba(OH)2 → 2LiOH + BaSO4 (6)
Электролиз LiCl. Раствор LiCl подвергают электролизу в ванне с ртутным катодом; при этом на нем образуется амальгама лития, LiHg. При разложении амальгамы водой получают раствор LiOH.
Обменное разложение гашеной известью в растворе:
Li2CO3 + Ca(OH)2 → 2LiOH + CaCO3 (7)
Этот метод имеет промышленное значение.
Сульфат лития, Li2SO4,– бесцветное кристаллическое вещество, существует в трех модификациях: моноклинная α-модификация (a = 8,44; b = 4,95; c = 8,24 Ǻ, β = 107º 54') устойчива до 500 ºC; выше 500 ºC переходит в гексагональную β-модификацию, которая при 575 ºС переходит в кубическую γ-модификацию, существующую до температуры плавления. Плотность α-Li2SO4(25 ºC) – 2,22 г/см3.
Э нтальпия
образования ΔH = –1434 кДж/моль; Li2SO4хорошо растворяется в воде (рис. 3), выше
0 ºC имеет отрицательный коэффициент
растворимости, из водных растворов
выделяется в виде моногидрата, Li2SO4∙H2O,
который обезвоживается при 500ºC.
нтальпия
образования ΔH = –1434 кДж/моль; Li2SO4хорошо растворяется в воде (рис. 3), выше
0 ºC имеет отрицательный коэффициент
растворимости, из водных растворов
выделяется в виде моногидрата, Li2SO4∙H2O,
который обезвоживается при 500ºC.
В
Рис.3.
Политерма растворимости Li2SO4
в воде
В органических растворителях Li2SO4не растворяется, образует двойные соединения с сульфатами других щелочных металлов (MLiSO4; Na3Li(SO4)2∙6H2O и др.). В отличие от сульфатов других щелочных металлов в обычных температурных условиях не образует квасцов. Алюмо-литиевые квасцы (LiAl(SO4)2∙12H2O) существуют только в узкой области концентраций компонентов в системе Li2SO4– Al2(SO4)3– H2O при –2 ºC (и ниже).
Сульфат лития можно получить при взаимодействии H2SO4с литием, Li2O или LiOH, но обычно его получают при взаимодействии Li2CO3с H2SO4. Для лития известны также гидросульфаты и пиросульфат.
Нитрат лития, LiNO3,– бесцветное прозрачное кристаллическое вещество гексагональной сингонии (a = 4,674; c = 15,199 Ǻ), плотность 2,36 г/см3 (20 ºC), Т пл. = 254 ºC, энтальпия образования ΔH = – 428 кДж/моль, при 600 ºC начинает разлагаться с выделением кислорода и оксидов азота.
Нитрат лития гигроскопичен, хорошо растворяется в воде, растворимость резко увеличивается с повышением температуры (рис.4), образует пересыщенные растворы.
Рис.4.
Политерма растворимости LiNO3
в воде
В водном растворе LiNO3сильно диссоциирован, степень диссоциации в 0,1 М растворе 64 %, в 0,001 М растворе – 97,5 %. Из водных растворов ниже 30 ºC кристаллизуется LiNO3∙3H2O, при более высокой температуре – LiNO3.
Получают нитрат лития взаимодействием LiOH (Li2CO3) с разбавленной HNO3с последующим упариванием раствора и нагреванием остатка в вакууме при 200 ºC.
Ортофосфат лития, Li3PO4, – бесцветное кристаллическое вещество ромбической сингонии, плотность – 2,41 г/см3(20 ºC); термически устойчив, не плавится и не разлагается до температуры красного каления, Тпл1220 ºC. Ортофосфат лития – наименее растворимая соль лития. В 100 г воды растворяется 0,022 г при 0 ºC и 0,034 г при 18 ºC. В присутствии аммиака растворимость Li3PO4уменьшается, а в присутствии аммонийных солей (NH4Cl) – увеличивается. Из водных растворов при обычной температуре осаждается Li3PO4∙2H2O, который после сушки при 60ºC переходит в полугидрат (Li3PO4∙0,5H2O), а выше 120ºC полностью обезвоживается. Li3PO4легко разлагается сильными кислотами, труднее – уксусной.
Li3PO4образует двойные соли с фосфатами других щелочных металлов и аммония, обычно лучше растворимые в воде, чем Li3PO4. Для получения ортофосфата лития используют нейтрализацию H3PO4избытком LiOH, однако при этом, помимо Li3PO4, образуется основной фосфат лития 2Li3PO4∙LiOH, поэтому применяют осаждение Li3PO4из раствора соли лития Na2HPO4в слабощелочном растворе:
3LiX + Na2HPO4 + NaOH = Li3PO4 + 3NaX + H2O (8)
Добавление NaOH обязательно, иначе образуется растворимый Li2HPO4, что ведет к потерям лития.
Незначительная растворимость Li3PO4в воде используется в аналитической химии для отделения лития от других щелочных металлов и его количественного определения. В технологических схемах применяется осаждение Li3PO4для доизвлечения лития из различных маточных растворов (содержащих натрий и калий), после первичного извлечения лития в виде Li2CO3. Для перевода Li3PO4в растворимые соединения используют взаимодействие Li3PO4с CaCl2в расплаве при 850 ºC:
2Li3PO4 + 3CaCl2 = 6LiCl + Ca3(PO4)2 (9)
Карбонат лития, Li2CO3, – бесцветное мелкокристаллическое вещество, кристаллизуется в моноклинной сингонии (a = 8,39; b = 5,00; c = 6,21 Ǻ, β = 114,5º), плотность 2,11 г/см3(0 ºC); энтальпия образования ΔH = – 1078,70 кДж/моль; Т пл. 732 ºC. Карбонат лития – термически неустойчивое соединение, уже при температуре плавления заметно диссоциирует:
Li2CO3→Li2O + CO2. (10)
Давление CO2становится равным атмосферному при 1270 ºC; карбонат лития менее стоек, чем карбонаты натрия и калия, термическая диссоциация ускоряется в вакууме и в присутствии углерода вследствие восстановления CO2до CO и смещения равновесия реакции влево. Оксид лития в расплаве Li2CO3очень агрессивен – разрушает корунд, алунд, диоксид циркония и платину. По ряду свойств карбонат лития сходен с карбонатом кальция.
Р астворимость
Li2CO3мала, она значительно
ниже
астворимость
Li2CO3мала, она значительно
ниже
растворимости к
Рис.5.
Политерма растворимости Li2CO3
в воде
При 20 ºC она составляет 1,33 г /100 г H2O. С повышением температуры, как видно из рис. 5, растворимость понижается, т.е. карбонат лития имеет отрицательный температурный коэффициент растворимости. Кристаллогидратов карбонат лития не образует, в водных растворах заметен гидролиз, который усиливается при кипячении. Карбонаты щелочных металлов не образуют с Li2CO3соединений, они понижают растворимость Li2CO3, что объясняется действием одноименного иона. При пропускании CO2через водную суспензию Li2CO3карбонат лития растворяется вследствие образования более растворимого гидрокарбоната:
Li2CO3+ CO2+ H2O→2LiHCO3(11)
Гидрокарбонат лития разлагается при нагревании, выделяя Li2CO3.
Чистый карбонат лития можно получить, пропуская CO2в раствор LiOH. В промышленности его получают при действии поташом (K2CO3) или содой (Na2CO3) на растворы солей лития вблизи температуры кипения (90ºC).
Карбонат лития – важнейшее промышленное соединение лития, т.к. многие технологические схемы переработки литийсодержащего сырья заканчиваются осаждением Li2CO3. Кроме того, карбонат лития – источник получения другого технически важного соединения лития – LiOH и многочисленных солей лития.
