
Звягина Учебное пособие
.pdf
1.В этом процессе не образуется Н2О2, в отличие от прямого дезаминирования, а образуется Н2О и НАДН2.
2.Непрямое окислительное дезаминирование обеспечивает гораздо более быстрое дезаминирование (благодаря высокой активности фермента глутамат-ДГ и трансаминазы);
3.Скорость этого процесса можно регулировать.
Пути образования и обезвреживания аммиака. Биосинтез мочевины: химизм и биологическая роль.
Аммиак образуется в ходе следующих процессов:
1.Дезаминирования аминокислот
2.Дезаминирования биогенных аминов (гистамин, серотонин и др.)
3.Дезаминирования пуриновых оснований (аденина и гуанина)
4.Распада пиримидиновых оснований (урацила, тимина, цитозина)
5.Дезаминирования амидов аминокислот (аспарагина и глутамина)
Аммиак – очень токсичное соединение, особенно для нервных клеток, поэтому в тканях существуют механизмы его обезвреживания: 1) синтез мочевины – основной путь обезвреживания аммиака; 2) образования амидов аминокислот (глутамина и аспарагина); 3) восстановительное аминирование; 4) образование аммонийных солей.
Синтез мочевины. Печень — единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, являются главным местом ее синтеза. 3 молекулы АТФ расходуется на синтез каждой молекулы мочевины.
Синтез карбамоилфосфата (происходит в митохондриях):
|
|
|
|
O O |
|
|||
|
|
|
|
|
|
|
|
|
HCO – + NH + |
+ 2АТФ + H |
O |
H N–C–O–P–O – |
+ 2 АДФ + Фн |
||||
3 |
4 |
2 |
|
2 |
|
|
|
|
|
|
|
|
|
O– |
|
||
Синтез мочевины представляет собой циклический процесс, в который вступают предварительно синтезированный карбамоилфосфат и каталитическую роль играет орнитин.
121

Орнитиновый цикл мочевинообразования:
Мочевина
Карбамоилфосфат
Орнитин
Орнитин-карбамоил
трансфераза
Аргиназа
 Фн
Фн
Н2О
Аргинин |
Цитруллин |
Аспартат + АТФ
Фумарат
Аргинино-сукцинат Аргининосинтетаза
сукцинатлиаза
Аргининосукцинат 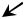
 АМФ + ФФн
АМФ + ФФн
Мочевина - это нетоксичное вещество, которое легко выводится из организма с мочой. Накопление мочевины в крови выше нормы происходит только при нарушениях функции почек.
Синтез мочевины происходит только в печени, а аммиак образуется в разных тканях. Образование глутамина и аспарагина считают своеобразной транспортной формой аммиака.
Глутаминовая кислота + АТФ +NН3→ Глутамин + АДФ +Н3РО4
Реакция катализируется глутаминсинтетазой. Особенно важна данная реакция обезвреживания аммиака в нервной ткани (очень чувствительной к токсическому влиянию аммиака). Со значительной скоростью протекает она и в мышечной ткани.
Декарбоксилирование аминокислот и образование биогенных аминов (гистамина, серотонина, ГАМК, таурина), их биологическая роль. Антигистаминные препараты.
Биологическое значение реакций декарбоксилирования аминокислот.
1. Реакции необратимы - приводят к необратимому распаду аминокислот.
122

2.Образуется значительное количество СО2 - конечного продукта метаболизма, который выводится из организма.
3.Синтезируются амины, которые обладают высокой биологической активностью. Поэтому такие амины называют биологически активными или биогенными аминами. Они являются медиаторами, с помощью которых сигнал передается от одной клетки к другой и от одной молекулы к другой.
1.Синтез гистамина
Реакция катализируется ферментом – гистидиндекарбоксилазой.
Гистамин является медиатором и содержится в нервных и тучных клетках. Обладает сильным сосудорасширяющим действием. Особенно много его выделяется в очаге воспаления. Гистамин играет важную роль в проявлении аллергических реакций.
Известно 2 типа рецепторов к гистамину: H1 и H2.
Биологическая роль гистамина:
-расширение капилляров и повышение сосудистой проницаемости;
-понижение артериального давления;
-повышение тонуса (спазм) гладких мышц - в том числе гладкой мускулатуры бронхов;
-усиление секреции желудочного сока;
Некоторые из этих эффектов позволяют гистамину принимать участие в формировании аллергических проявлений.
Антигистаминные препараты применяются с целью предотвратить образование гистамина и обладают противовоспалительным и антиаллергическим действием. По механизму действия некоторые из них являются ингибиторами гистидиндекарбоксилазы, а другие конкурируют с гистамином за взаимодействие с рецепторами клеток.
Например, лекарственный препарат циметидин и его аналоги блокируют Н2-рецепторы и таким образом понижают секрецию желудочного сока. Применяются при лечении язвенной болезни желудка.
Блокаторы Н1-рецепторов используются в основном как противо-
аллергические средства - димедрол, тавегил, супрастин, пипольфен,
цетрин, ксизал. Некоторые из этих препаратов вызывают сонливость.
123

2. Синтез серотонина
|
триптофанмонооксигеназа |
|
|
1. |
Триптофан |
5-окситриптофан |
|
|
О2 Н2О2 |
|
|
|
CO2 |
|
|
|
HO |
HO |
|
|
CH2 —CH—COOH |
CH2 —CH2 |
|
|
NH2 |
NH |
2 |
|
NH |
NH |
|
|
5-Окситриптофан |
Серотонин |
|
Декарбоксилаза (ПАЛФ)
Биологическая роль серотонина:
1.Центральное действие (ЦНС) — повышение аппетита, регуляция памяти, настроения, поведения, функций сердечно-сосудистой и эндокринной систем.
2.Периферическое действие — активирует перистальтику, повышает агрегацию тромбоцитов, проницаемость мелких сосудов.
3.Синтез γ-аминомасляной кислоты (ГАМК):
Реакция катализируется ферментом – глутаматдекарбоксилазой. ГАМК является медиатором тормозных импульсов в нервной системе. ГАМК и ее аналоги применяются в медицине как нейротропные средства для лечения эпилепсии и других заболеваний.
4. Образование таурина
Таурин синтезируется из цистеина, путем декарбоксилирования производных цистеина – цистеиновой и цистеинсульфиновой кислот:
Цистеин → Цистеинсульфиновая к-та → Цистеиновая к-та →Таурин
Таурин необходим для синтеза желчных кислот в печени, кроме того очень важен в клетках как антиоксидант.
124

5. Креатин подвергается фосфорилированию с участием АТФ, в результате образуется соединение с макроэргической связью - креатинфосфат. Это обратимая реакция, которая катализируется ферментом креатинфосфокиназой (КФК).
Эта реакция интенсивно идет в мышцах, особенно, в сердечной мышце, и в ткани мозга. Креатинфосфат активно синтезируется в покое и распадается при
мышечной работе. Это наиболее быстрый способ регенерации АТФ. Креатин, образовавшийся из креатинфосфата, распадается до креатинина, который является конечным продуктом и выводится с мочой. В сутки выводится 1-2 грамма креатинина. Это количество креатинина прямо пропорционально мышечной массе, поэтому у мужчин креатинина в моче больше, чем у женщин. Креатинин не реабсорбируется из первичной мочи, поэтому его количество во вторичной моче характеризует объем клубочковой фильтрации.
При поражении мышечных клеток и нарушении ткани мозга креатинфосфокиназа появляется в крови, это является диагностиче-
ским признаком. Известно, что КФК имеет три изофермента - кардиальный, церебральный и мышечный, появление их в крови позволяет определить поражение соответствующего органа. Появление в крови кардиального изофермента является ранним диагностическим признаком инфаркта миокарда.
Инактивация биогенных аминов
Если биогенные амины обладают высокой биологической активностью, то они должны быстро разрушаться после выполнения своей функции.
125

Одним из механизмов обезвреживания биогенных аминов является их окислительное дезаминирование с образованием альдегидов и выделением аммиака:
R-СН2-NН2 + Н2О  R-СНО + NН3 + Н2О2 О2
R-СНО + NН3 + Н2О2 О2
Данные реакции катализируются моноамин- и диаминоксидазами (МАО и ДАО). Коферментом МАО является ФАД, а ДАО – ПАЛФ. Моноаминоксидазы инактивируют первичные, вторичные и третичные амины, а диаминоксидазы – гистамин, путресцин и др. МАО в клетке больше, чем ДАО.
Продукты дезаминирования биогенных аминов (альдегиды) окисляются при действии фермента альдегиддегидрогеназы до органических кислот:
R-СНО + Н2О  R- СООН НАД+ НАДН2
R- СООН НАД+ НАДН2
Некоторые ингибиторы моноаминоксигеназы (МАО) используются как лекарственные средства для лечения депрессии (антидепрессанты), сопровождающейся нарушением психики и мышления: нила-
мид, пиразидол, инказан и др.
Заменимые и незаменимые аминокислоты. Биосинтез заменимых аминокислот из промежуточных продуктов распада углеводов, из метаболитов цикла Кребса, из незаменимых аминокислот.
Человек и животные способны синтезировать только 10 из 20 аминокислот, необходимых для синтеза белка – это заменимые аминокислоты. Те аминокислоты, которые не могут синтезироваться в нашем организме и должны поступать с пищей называются незаменимыми. Для человека их 8 (валин, лейцин, изолейцин, метионин, треонин, триптофан, лизин, фенилаланин). Аминокислоты, которые могут синтезироваться в организме, но в недостаточном количестве называются полузаменимыми, их 3 (тирозин, гистидин, аргинин).
Пути биосинтеза заменимых аминокислот разнообразны, но при этом они обладают одним важным свойством: углеродный скелет аминокислот образуется из промежуточных метаболитов гликолиза, пентозофосфатного пути, цикла трикарбоновых кислот. Приня-
то выделять три основных пути биосинтеза аминокислот:
Прямое аминирование кетокислот (А);
Реакции трансаминирования (ТА);
Ферментативные взаимопревращения отдельных аминокислот.
126

Предшественник |
|
глутамин |
ТА |
А |
|
2 – оксоглутарат |
глутамат |
пролин |
ТА |
А |
|
Оксалоацетат  аспартат
аспартат  аспарагин
аспарагин
ТА |
|
|
Пируват |
аланин |
|
|
|
глицин |
|
ТА |
|
3-фосфоглицерат |
серин |
цистеин |
Фенилаланин |
тирозин |
|
(незаменимая |
(полузаменимая |
|
аминокислота) |
аминокислота) |
|
Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина и меланина, их биологическая роль.
Аминокислота фенилаланин может в результате окисления присоединять две ОН-группы в кольце (фермент – монооксигеназа) и превращаться в диоксифенилаланин (ДОФА). Из него под действием декарбоксилазы образуется дофамин. Дофамин является предшественником катехоламинов - норадреналина и адреналина.
а – тирозин-3-монооксигеназа
127

б – ДОФА-декарбоксилаза в – 3-дофаминмонооксигеназа
г - фенилэтаноламинметилтрансфераза
Биологическая роль катехоламинов: увеличивают потребление кислорода клетками, органами и организмом; повышают активность ферментов цикла Кребса, дыхательной цепи; стимулируют синтез АТФ; повышают АД.
Нарушения обмена фенилаланина и тирозина. Фенилкетонурия (биохимический дефект, проявления, диагностика и лечение), алкаптонурия, альбинизм.
1.Фенилкетонурия – молекулярная болезнь, связанная с дефектом фермента фенилаланингидроксилазы (фенилаланинмонооксигеназы), превращающий фенилаланин в тирозин.
Следствие – накопление в крови и моче фенилаланина и продуктов его превращений: фенилпирувата, фениллактата и фенилацетата, которые токсичны для клеток мозга. В результате у детей развивается тяжелое отставание умственного развития (фенилпировиноградная олигофрения).
2.Альбинизм – молекулярная болезнь, связанная с дефектом фермента - тирозиназы, в результате нарушено превращение тирозина в диоксифенилаланин (ДОФА) и ДОФА-хинон в меланоцитах. Это приводит к нарушению биосинтеза пигмента меланина (пигмент чер-
Меланоциты |
Тирозин |
Надпочечники |
Дигидроксифенилаланин (ДОФА) |
ДОФА |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тирозиназа |
ДОФ-амин |
|
|
|
|
|||
|
|
|
|
||
|
|
|
|||
ДОФА-хинон |
Норадреналин |
||||
|
|
|
|||
|
|
|
|
||
ДОФА-хром |
Адреналин |
||||
|
|
|
|||
|
|
|
|
||
Меланин |
|
|
|||
ного цвета). |
|
|
|||
Характерные признаки: слабая пигментация кожи и волос; красные зрачки глаз, так как нет пигментов в радужной оболочке и просвечивают кровеносные сосуды глазного дна.
128
3. Алкаптонурия. Тирозин, подвергаясь дальнейшим превращениям в организме, образует гомогентизиновую кислоту. В норме ее окисляет фермент оксидаза, содержащийся, главным образом, в печени. При алкаптонурии этот фермент не синтезируется, нарушено окисление гомогентизиновой кислоты в тканях, вследствие чего содержание ее в жидкостях организма и выделение с мочой повышается. В присутствии кислорода гомогентизиновая кислота полимеризуется с образованием пигмента черного цвета – алкаптона.
Характерные признаки: общая пигментация соединительной ткани (охроноз); темная моча, темные пятна на коже.
Характеристика биосинтеза и распада пуриновых и пиримидиновых нуклеотидов, нуклеозидов, оснований. Источники образования пуриновых и пиримидиновых оснований. Реутилизация аденина и гуанина в процессе биосинтеза нуклеотидов. Гиперурикемия и подагра. Аллопуринол как конкурентный ингибитор ксантиноксидазы.
Катаболизм нуклеиновых кислот
Начинается с гидролиза 3',5'-фосфодиэфирной связи под действием ферментов нуклеаз:
-ДНКазы - расщепляют ДНК
-РНКазы - расщепляют РНК Среди ДНКаз и РНКаз различают:
-экзонуклеазы (5' и 3');
-эндонуклеазы - специфичны к мононуклеотидной последовательности, есть высокоспецифичные: рестриктазы - используются в генной инженерии.
Далее происходит отщепление фосфата от мононуклеотида с участием ферментов нуклеотидаз с образованием нуклеозидов.
Нуклеозид может расщепляться путем гидролиза под действием фермента нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз - при этом нуклеозид расщепляется на азотистое основание и фосфорибозу.
129

Катаболизм пуриновых азотистых оснований
Распад начинается с отщепления аминогруппы (ее отщепление также возможно в составе ДНК).
Фермент аденозиндезаминаза иногда образуется в дефектной мутантной форме, что приводит к врожденному иммунодефициту, так как нуклеотиды являются регуляторами функций лейкоцитов. При СПИДе активность этого фермента также значительно снижена.
Образовавшийся инозин подвергается фосфоролизу, и далее гипоксантин подвергается двукратному окислению путем отнятия водорода с одновременным присоединением воды. Эти две одинаковые реакции катализирует один и тот же фермент – ксантиноксидаза
(рис.16).
Конечный продукт: мочевая кислота – вещество пуриновой при-
роды. Мочевая кислота является одним из нормальных компонентов мочи. Концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0,12-0,40 ммоль/л. Однако повышенное содержание мочевой кислоты в крови (гиперурикемия) небезопасно. Сама мочевая кислота и, особенно, ее соли ураты (натриевые соли мочевой кислоты) плохо растворимы в воде. Даже при незначительном повышении концентрации они начинают выпадать в осадок и кристаллизоваться, образуя камни. Кристаллы воспринимаются организмом как чужеродный объект.В суставах они фагоцитируются макрофагами, сами клетки при этом разрушаются, из них освобождаются гидролитические ферменты. Это приводит к воспалительной реакции, сопровождающейся сильнейшими болями в суставах. Такое заболевание называется подагра.
130
