
Звягина Учебное пособие
.pdfдии:
1.Образование фермент-субстратного комплекса. Эта стадия непродолжительная по времени и зависит от концентрации субстрата.
2.Превращение первичного фермент-субстратного комплекса в один или несколько активированных фермент-субстратных комплексов. На этой стадии происходит расшатывание связей субстрата, их разрыв или образование новых связей. Это самая длительная стадия.
3.Отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду. Это также быстрая фаза.
`Ферменты имеют разную специфичность по отношению к субтратам.
1.Стереохимическая субстратная специфичность – фермент катализирует превращение только одного из возможных стереоизомеров субстрата.
2.Абсолютная субстратная специфичность – фермент катали-
зирует превращение только (абсолютно) одного субстрата.
3.Абсолютная групповая субстратная специфичность – фер-
мент катализирует превращение только (абсолютно) одной сходной группы субстратов.
4.Относительная групповая субстратная специфичность –
фермент действует на определенные связи субстратов.
5.Относительная субстратная специфичность – фермент ка-
тализирует превращение различных групп веществ. Это самый широкий вид специфичности.
Существуют две модели, объясняющие специфичность: модель Фишера — «ключ – замок» и модель Кошланда — индуцированного соответствия. Согласно первой гипотезе, в основе специфичности лежит строгое пространственное соответствие субстрата и фермента: как «ключ и замок», активный центр при этом рассматривается как стабильная, жесткая структура. После взаимодействия субстрата («ключ») с активным центром («замок») происходят химические превращения субстрата в продукт. Согласно гипотезе Кошленда конформация фермента и его активного центра может изменяться при присоединении субстрата, что обеспечивает более высокую эффективность ферментативной реакции. Гипотеза «индуцированного соответствия» экспериментально подтверждена.
Кинетика ферментативных реакций. Зависимость скорости реакции от концентрации субстрата и фермента, pH среды, температуры. Константа Михаэлиса (Кm) и ее определение.
41
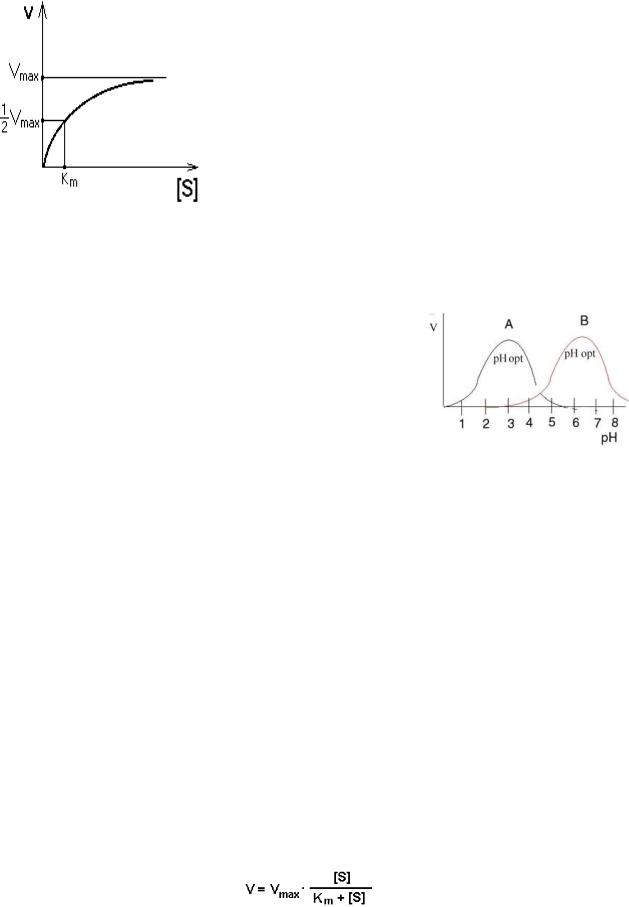
Кинетика действия ферментов – это раздел энзимологии, изучающий зависимость скорости реакции от определенных факторов. Скорость ферментативной реакции определяется количеством вещества, которое превращается в единицу времени.
Зависимость скорости реакции от рН среды и температуры.
Для каждого фермента существует свой оптимум рН, при котором скорость реакции максимальна (например, для фермента А оптимум рН равен 3, для фермента В – 6,5). Отклонение рН в ту или иную сторону ведет к снижению скорости ферментативной реакции.
Для большинства ферментов оптимум рН близок к нейтральным значениям.
Скорость всех химических реакций увеличивается при повышении температуры.
Однако при нагревании выше 400 многие ферменты подвергаются денатурации (ферменты по своей природе являются белками) и теряют свою активность, что приводит к снижению скорости реакции. Оптимальные значения температуры для большинства ферментов находятся в пределах 20 – 400.
Зависимость скорости реакции от концентрации фермента и субстрата. Чем больше концентрация фермента, тем выше скорость реакции. Зависимость носит линейный характер.
Влияние концентрации субстрата
При постоянной концентрации фермента начальная скорость реакции растет пропорционально увеличению концентрации субстрата (реакция первого порядка для низких концентраций субстрата).
При высоких концентрациях скорость реакции достигает своего максимального значения (Vmax) и не зависит от концентрации субстрата (реакция нулевого порядка).
Эта кривая описывается уравнением Михаэлиса-Ментен:
Км — это константа Михаэлиса. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату. Если Км высокая, то
42
это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно.
Таким образом, при низких концентрациях субстрата скорость биохимической реакции прямо пропорциональна концентрации субстрата. При высоких концентрациях субстрата скорость биохимической реакции становится максимальной.
Скорость ферментативной реакции можно увеличивать (активировать) или уменьшать (ингибировать).
Регуляция активности ферментов. Активирование и ингибирование ферментов.
Активация ферментативной реакции может происходить с помощью веществ, влияющих на активный центр фермента (ионы металлов и коферменты) и модификаций (изменений), не затрагивающих активный центр. К таким модификациям относится:
1.частичный протеолиз
2.ассоциация – диссоциация
3.фосфорилирование – дефосфорилирование
Частичный протеолиз. Некоторые ферменты синтезируются в клетке в неактивной форме – профермента. Активация профермента заключается в формировании активного центра, которое происходит в результате отщепления участка полипептидной цепи (частичного протеолиза). Путем частичного протеолиза активируются пищеварительные ферменты, например, пепсиноген (неактивный) после отщепления ингибирующего пептида переходит в пепсин (активная форма фермента).
Ассоциация – диссоциация. Некоторые ферменты могут изменять свою активность за счет ассоциации – диссоциации (расщепленияобъединения) субъединиц, входящих в их состав. Например, неактивный фермент протеинкиназа состоит из 4 субъединиц двух типов: каталитического и регуляторного, при активации – происходит диссоциация (расщепление) фермента на 2 части по 2 субъединицы в каждой. Функцию фосфорилирования выполняет активная каталитическая часть фермента.
Фосфорилирование-дефосфорилирование. Присоединение остат-
ков фосфорной кислоты к ферменту – фосфорилирование - происходит под действием фермента протеинкиназы. Отщепление от ферментов остатков фосфорной кислоты (дефосфорилирование) осуществляют ферменты – протеинфосфатазы. При фосфорилирова-
43
нии одни ферменты переходят в активное состояние, другие – теряют свою активность. Регулируются эти процессы гормонами. Например, гормон глюкогон вызывает фосфорилирование фермента гликогенфосфорилазы, переводя его в активную форму. При этом ускоряется распад гликогена и увеличивается содержание глюкозы.
Ингибирование ферментов может происходить путем:
1.конкурентного ингибирования. Ингибитор похож по строению на субстрат, он способен присоединяться к активному центру фермента и препятствует субстратам взаимодействовать с ферментами.
2.неконкурентного ингибирования. Ингибитор присоединяется
кферменту и блокирует его активный центр. Фермент при этом не способен присоединить или активировать субстрат.
3.бесконкурентного ингибирования. Ингибитор присоединяется только к комплексу "субстрат-фермент" и мешает продуктам реакции отсоединяться от фермента.
4.субстратного ингибирования. Ингибитором является избыток субстрата. Несколько молекул субстрата одновременно присоединяются к одному активному центру и препятствуют протеканию реакции.
Регуляция действия ферментов. Чаще всего в живой клетке регу-
ляция активности ферментов происходит двумя путями: аллостерической регуляции или путем фосфорилирования-дефосфорилирования. Аллостерическая регуляция ферментов происходит при связывании активатора или ингибитора с аллостерическим центром фермента. Например, фермент гексокиназа катализирует превращение глюкозы в глюкозо-6-фосфат. Избыток глюкозо-6-фосфата присоединяется к аллостерическому центру фермента и уменьшает его активность, снижая потребление глюкозы клеткой.
Единицы активности:
Катал — это количество фермента, которое обеспечивает превращение 1 моля субстрата за 1 секунду.
Стандартная единица (U) — это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 U = 16,67 нкатал (нанокатал).
В медицине активность ферментов выражают чаще всего в единицах активности на 1 л биологической жидкости. Единица удельной активности – моль субстрата/час·литр.
Удельная активность — выражается в единицах активности, рассчитанной на 1 мг белка.
44

Множественные формы ферментов
Это ферменты, которые катализируют одинаковые реакции, но отличаются по физико-химическим свойствам. По происхождению можно выделить две группы таких ферментов: а) изоферменты — это ферменты, в которых различия генетически определены; б) множественные формы, образующиеся в результате модификации молекул фермента после его синтеза.
Классификация изоферментов: а) по органной локализации — ферменты гликолиза в мышцах и цитоплазме; б) по внутриклеточной локализации — малатдегидрогеназа митохондриальная и цитоплазматическая; в) изоферменты, образующиеся в результате мутаций структурных генов; г) гибридные формы, образующиеся путем нековалентного связывания нескольких разных по структуре полипептидных цепей.
Так, ЛДГ состоит из 4-х цепей 2-х видов — H и M. Из них возможно образование пяти изоферментов — Н4, Н3М, Н2М2, МН3 и М4. Н4 и Н3М преобладают в миокарде, а М4 — в печени.
Практическое значение ферментов, использование их в медицине и народном хозяйстве.
Ферменты широко применяются в медицине и народном хозяйстве.
Медицина: Ферменты определяют в крови для диагностики заболеваний, например, при инфаркте миокарда повышается активность креатинкиназы (КК), аспартатаминотрасферазы (АСТ), изоферментов 1 и 2 лактатдегидрогеназы (ЛДГ1, ЛДГ2).
Ферменты могут использоваться в качестве лекарственных препаратов: с целью заместительной терапии, при их недостаточности применяется пепсин, а также комплексные препараты, содержащие ферменты поджелудочной железы – фестал, мезим и др. При тромбозах используют фибринолизин, стрептолиазу. Фермент гиалуронидазу (лидазу), расщепляющий гиалуроновую кислоту используют при рассасывании рубцов, шрамов.
Ферменты широко используются в качестве аналитических реагентов в химических лабораториях.
Промышленность:
Фермент амилаза используется для улучшения вкуса и мягкости
45

хлеба. Различные протеиназы добавляют в стиральные порошки для усиления моющего эффекта.
Классификация и номенклатура ферментов.
Все ферменты разделены на 6 классов, каждый из которых имеет свой порядковый номер, строго закрепленный за ним!
1.Оксидоредуктазы
2.Трансферазы
3.Гидролазы
4.Лиазы
5.Изомеразы
6.Лигазы (Синтетазы)
Название фермента формируется из следующих частей:
1.название субстрата с которым он взаимодействует
2.характер катализируемой реакции
3.наименование класса ферментов (но это необязательно)
4.суффикс -аза-
Пируват(субстрат) – декарбоксилирование (тип реакции) –
аза(окончание) - пируватдекарбоксилаза, сукцинат(1) – дегидрогенизация(2) – аза(4)
I. Оксидоредуктазы. Катализируют реакции окисления - восстановления.
1.Дегидрогеназы отщепляют от одного субстрата атомы водорода и
переносят их на другие субстраты, чаще всего это коферменты НАД+, НАДФ+, ФАД, ФМН. Коферменты присоединяют к себе
протоны и переходят в восстановленную форму (НАДН2, НАДФН2, ФАДН2). Например,
2.Оксидазы - катализирует перенос водорода на кислород с образованием воды или Н2О2. Ф. Цитохромоксидаза дыхательной цепи.
3.Пероксидазы и каталазы - катализируют разложение перекиси водорода, которая образуется в ходе метаболических реакций.
46

4. Оксигеназы - катализируют реакции присоединения кислорода к субстрату.
Рабочее название фермента - фенилаланин-4-монооксигеназа или фенилаланин-гидроксилаза, т.к. кислород встраивается в субстрат в виде гидроксильной группы 5. Редуктазы – катализируют реакции восстановления субстрата. До-
нором водорода в большинстве случаев является НАДФН2. Рабочее название образуется как: акцептор - редуктаза.
II. Трансферазы - катализируют перенос различных радикалов от молекулы донора к молекуле акцептору. Название ферментов, как пра-
вило, образуется по схеме акцептор-транспортируемая группа-
трансфераза. Если переносится метильная группа, то к названию акцептора добавляется метилтрансфераза, аминогруппа – амино-
трансфераза; ацильная группа - ацилтрансфераза. Например, норадреналинметилтрансфераза.
К классу трансфераз относятся также киназы (фосфотрансферазы), которые катализируют перенос остатка фосфорной кислоты от АТФ. Процесс присоединения остатков фосфорной кислоты к субстрату носит название фосфорилирование.
Например, протеин + АТФ → Фосфопротеин + АДФ Фермент: протеинкиназа
III. Гидролазы - катализируют реакции гидролиза, т.е. расщепление веществ с присоединением воды по месту разрыва связи. В результате реакции образуется два продукта реакции. К этому классу относятся преимущественно пищеварительные ферменты, они являются простыми ферментами, т.е не содержат в своем составе небелковой части. Название ферментов образуется путем добавления к названию субстрата суффикса –аза или полного термина гидролаза
R1-R2 +H2O = R1H + R2OH
К гидролазам относят также:
47

1.Эстеразы - расщепляют эфирные связи, например: ацетилхолин эстераза.
2.Гликозидазы - расщепляют гликозидные связи в молекулах поли-
иолигосахаридов, например, амилаза
3.Пептидазы - катализируют гидролиз пептидных связей, например: карбоксипептидаза, химотрипсин, трипсин.
4.Фосфатазы – отщепляют остаток фосфорной кислоты от субстрата, например, щелочная фосфатаза.
IV. Лиазы – катализируют все реакции негидролитического расщепления веществ и образования новых связей без участия энергии АТФ. Коферменты чаще всего - тиаминпирофосфат (В1) и пиридоксальфосфат (В6).
1. Разрыв связи С-С. Чаще всего при этом выделяется СО2 и ферменты называются декарбоксилазами, например: гистидиндекарбоксила-
за.
2.Разрыв связи С-О, при этом присоединяется или удаляется Н2О
(гидратазы-дегидратазы), например, фумаратгидратаза
3.Разрыв связи С-N.
4.Разрыв связи С-S.
V. Изомеразы - катализируют реакции изомеризации или взаимопревращения изомеров. Название ферментов складывается в зависимости от типа реакции изомеризации: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы. Например:
глюкозо-6-фосфатизомераза
Глюкозо-6-фосфат→фруктозо-6-фосфат
VI. Лигазы катализируют реакции синтеза более сложных веществ из простых. Такие реакции идут с затратой энергии АТФ. К названию
48

таких ферментов прибавляют «синтетаза», например, сукцинил-КоА-
синтетаза
I.Вопросы для самоподготовки:
1.Что такое ферменты? Дайте общие представления о катализе.
2.Назовите сходство и различие между ферментами и неферментными катализаторами.
3.Расскажите о структурно-функциональной организации ферментов. Что такое коферменты? Каковы их функции?
4.Механизм действия ферментов. Стадия ферментативного катализа.
5.Специфичность ферментов, ее виды (с примерами) и теории, их объясняющие.
6.Множественные молекулярные формы ферментов. Изоферменты, их характеристика.
7.Кинетика ферментативных реакций. Зависимость скорости реакции от концентрации субстрата и фермента, pH среды, температуры. Константа Михаэлиса (Кm) и ее определение.
8.Какие основные виды ингибирования ферментов вам известны?
9. Как можно регулировать действия ферментов? Физиологическое значение регуляции действия ферментов.
10.Методы определения и единицы активности ферментов.
11.Использование ферментов в медицине и фармации.
12.Напишите химическое строение НАД+, НАДФ+, ФМН, ФАД (примеры ферментативных реакций, в которых участвуют эти коферменты).
13.Назовите основные классы ферментов и дайте им краткую характеристику.
II. Тестовые вопросы для самоконтроля:
1. Участок в пространственной структуре фермента, с которым связываются не похожие на субстрат вещества и изменяют активность фермента, называется ...
а) аллостерический центр б) каталитический участок в) активный центр
49
г) контактный участок
2.Линейный характер имеет зависимость скорости ферментативной реакции от …
а) количества фермента б) количества субстрата в) рН среды г) температуры
3.Оптимальные значения температуры для большинства ферментов
находятся в пределах ...
а) 0 - 200 б) 20 – 400 в) 60 - 800 г) 80 - 1000
4.Сложные ферменты в отличие от простых … а) имеют активный центр б) содержат в своем составе кофактор в) являются белками
г) способны катализировать превращение субстрата
5.Функциональными группами активного центра простого фермента являются …
а) ионы металлов б) боковые радикалы аминокислот
в) витаминные коферменты г) аллостерические эффекторы
6.Каталитический участок активного центра фермента …
а) связывает и удерживает субстрат б) осуществляет превращение субстрата в) может отсутствовать
г) имеет одинаковое строение для всех ферментов
7.Наиболее продолжительная по времени стадия...
а) диффузии субстрата к ферменту б) преобразования субстрат-ферментного комплекса
б) связывания субстрата с ферментом б) диффузии продуктов реакции в окружающую среду
8.Торможение ферментативной реакции, вызванное избытком субстрата, называют … ингибированием
а) конкурентным б) неконкурентным
в) бесконкурентным
50
