
Nikolls_-_Ot_neyrona_k_mozgu
.pdf
Глава 1. Передача информации и структурная организация мозга |
33 |
гичные гены у мышей и человека (известные как small eye и aniridia) похожи по структуре. Если гомологичный ген eyeless млекопитающих искусственно встроен и экспрессируется у мушки, то у этого животного развиваются дополнительные (мушиные по структуре) глаза на усиках, крыльях и ногах (рис. 1.16). Это позволяет предположить, что этот ген одинаково управляет образованием глаза у мухи или мыши, несмотря на полностью различные структуру и свойства глаз насекомых и млекопитающих.
§ 5. Регенерация нервной системы после травмы
Нервная система не только устанавливает связи во время развития, но может восстанавливать некоторые связи после повреждения (ваш компьютер этого делать не может). Например, аксоны в руке могут прорастать после повреждения и устанавливать связи; рука опять может двигаться и ощущать прикосновения. Аналогично, у лягушки, рыбы или беспозвоночного животного вслед за разрушениями в нервной системе наблюдается регенерация аксонов и восстановление функции. После перерезки оптического нерва у лягушки или рыбы волокна опять прорастают и животное может видеть. Однако, эта способность не присуща центральной нервной системе взрослых позвоночных животных — у них регенерация не происходит. Молекулярные сигналы, которые блокируют регенерацию, и их
биологическое значение для функционирования нервной системы неизвестны.
Выводы
·Нейроны связаны друг с другом строго определенным способом.
·Информация от клетки к клетке передается через синапсы.
·В относительно простых системах, таких как сетчатка глаза, можно проследить все связи и понять значение межклеточных сигналов.
·Нервные клетки мозга являются материальными элементами восприятия.
·Сигналы в нейронах высоко стереотипны и одинаковы для всех животных.
·Потенциалы действия без потерь могут проходить большие расстояния.
·Локальные градуальные потенциалы зависят от пассивных электрических свойств нейронов и распространяются только на короткие расстояния.
·Особое строение нервных клеток требует специализированного механизма аксонального транспорта белков и органелл от и к телу клетки.
·Во время индивидуального развития нейроны мигрируют к окончательному месторасположению и устанавливают связи с мишенями.
·Молекулярные сигналы управляют ростом аксонов.
Цитированная литература
1. Ramon у Cajal, S. [1909-1911] 1995. Histology of the Nervous System, 2 vols. Translated by Neely Swanson and Larry Swanson. Oxford University
Press, New York.
2.Helmholtz, H. von. 1889. Popular Scientific Lectures. Longmans, London.
3.Hodgkin, A. L. 1964. The Conduction of the Nervous Impulse. Liverpool University Press, Liverpool, England.
4.Adrian, E. D. 1946. The Physical Background of Perception. Clarendon. Oxford, England.
5. Katz, B. 1966. Nerve, Muscle, and Synapse. McGraw-Hill, New York
6.Sherrington, C. S. 1906. The fntegrative Action of the Nervous System. Reprint, Yale University Press, New Haven, CT, 1966.
7.Kuffler, S. W. 1953. /. Neurophysiol. 16: 37-68.
8.Hubel, D.H., and Wiesel, T.N. 1977. Proc. R.Soc. Land. В 198: 1-59.
9.Haider, G., Callaerts, P.. and Gehring. W.J. 1995. Science 267: 1788-1792.

Раздел II. ПЕРЕДАЧА ИНФОРМАЦИИ В НЕРВНОЙ СИСТЕМЕ
Глава 2. Ионные каналы и нейрональная сигнализация
Электрические сигналы, обеспечивающие функционирование нервных клеток, опосредованы потоком ионов через водопроницаемые поры клеточной мембраны. Эти поры, образованные трансмембранными белками, называются ионными каналами. К настоящему времени разработаны высокочувствительные методы, позволяющие зарегистрировать и измерить ионные токи, протекающие через одиночные ионные каналы. В этой главе будут обсуждаться такие функциональные свойства ионных каналов, как их специфичность для того или иного иона. Кроме того, будет рассмотрена регуляция ионных каналов, приводящая к генерации необходимого типа нервного импульса.
Некоторые ионные каналы избирательно проницаемы только для катионов, тогда как другие проводят только анионы. Катионные каналы могут быть высоко избирательными по отношению к одному иону, например натрию. Ионные каналы совершают переходы между открытым и закрытым состоянием и имеют, как правило, характерное время открытого состояния. Их вклад в ионный ток через клеточную мембрану определяется относительным количеством времени, которое они находятся в открытом состоянии.
Открытие канала регулируется различными механизмами. Некоторые из этих механизмов физические, такие как растяжение мембраны или изменения мембранного потенциала. Другие механизмы химические, включающие связывание активных молекул (лигандов) с активным центром, который располагается либо с внеклеточной, либо с внутриклеточной стороны канала.
Важным свойством каналов, в дополнение к кинетике открытия и закрытия, является способность открытого канала проводить ионный ток. Один из способов, которым ионы могут проникать через открытый канал, является простая диффузия. Другой способ — взаимодействие ионов с внутриканальными центрами связывания и перескакивание внутри водной поры от одного центра к другому. В любом случае движение иона через канал является пассивным и определяется градиентом концентрации и градиентом электрического потенциала на мембране.
Количество тока, проходящего через открытый канал по электрическому градиенту, зависит от проницаемости канала для данного типа ионов. Величина тока также зависит от концентрации ионов в устьях канала. Эти два фактора, проницаемость и концентрация, определяют проводимость канала.
Глава 2. Ионные каналы и нейрональная сигнализация |
35 |
В первой главе указывалось, что передача информации в нервной системе осуществляется двумя типами электрических сигналов: местными потенциалами, локализованными в специализированных участках нейрона, и потенциалами действия, которые передаются по всей протяженности нервной клетки. Эти сигналы меняют стабильный электрический потенциал клеточной мембраны, называемый мембранным потенциалом покоя. В покое, в зависимости от типа нейрона, мембранный потенциал имеет величину от -30 мВ до -100 мВ. Отрицательный знак потенциала означает, что внутриклеточный заряд мембраны отрицателен по отношению к внеклеточной среде.
Передача импульса в нервной системе опосредуется изменениями мембранного потенциала. В сенсорных нейронах адекватный стимул, такой как прикосновение, звук, свет, вызывает локальную деполяризацию (делая мембранный потенциал менее негативным) или гиперполяризацию (мембранный потенциал становится более негативным). Подобным же образом нейротрансмиттеры в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой.
Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение положительно заряженных ионов натрия снижает общий отрицательный заряд мембраны или, другими словами, вызывает деполяризацию. Наоборот, результатом движения положительно заряженных ионов калия из клетки является рост общего отрицательного заряда, то есть гиперполяризация. Гиперполяризация может быть обусловлена также движением внутрь клетки отрицательно заряженных ионов хлора.
Как движутся ионы через клеточную мембрану и чем их движение регулируется? Главным путем для быстрого перемещения ионов внутрь клетки и из нее являются ионные каналы. Ионные каналы представляют собой встроенные в мембрану молекулы белка, которые образуют поры, проницаемые для ионов. Ионные токи регулируются через открытие и закрытие этих ионных каналов. Знание механизмов работы ионных каналов позволяет понять, как генерируются электрические сигналы.
§ 1. Свойства ионных каналов Клеточная мембрана нервной клетки
Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковых
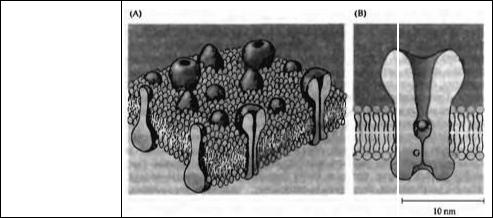
Рис. 2.1. Клеточная мембрана и ионный канал. (А) Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковых молекул. Пронизывающие мембрану (трансмембранные) белки образуют ионные каналы. (В) Схематичное представление ионного канала с центральной водной порой и воротным механизмом (G).
Fig. 2.1. Cell Membrane and Ion Channel. (A) The cell membrane is composed of a lipid bilayer embedded with proteins. Some of the proteins traverse the lipid layer, and some of these membrane-spanning proteins form membrane channels. (B) This schematic representation shows a membrane channel in cross section, with a central water-filled pore and channel "gate" (G). The gate opens and closes irregularly; the probability of opening may be regulated by the membrane potential by the binding of a ligand to the channel or by other biophysical or biochemical conditions. A sodium ion, surrounded by a single shell of water molecules, is shown to scale in the pore for size comparison.
36 |
Раздел П. Передача информации в нервной системе |
молекул. Как показано на рис. 2.1 А, молекулы липидов организованы в двухслойную мембрану (бислой) толщиной около 6 нм. Полярные гидрофильные головки липидов обращены к поверхностям мембраны, а гидрофобные хвосты вытянуты к середине бислоя. Липиды плохо пропускают воду и практически непроницаемы для ионов. Белковые молекулы частично погружены в слой липидов, либо с внеклеточной, либо с цитоплазматической стороны. Некоторые белки целиком пронизывают мембрану. Именно пронизывающие мембрану (трансмембранные) белки образуют ионные каналы. Основные ионы, участвующие в генерации электрических сигналов, такие как калий, натрий, кальций или хлор, движутся через ионные каналы пассивно благодаря градиенту концентраций и электрическому потенциалу мембраны.
Другие трансмембранные белки служат в качестве насосов и переносчиков, обеспечивающих транспорт веществ через клеточную мембрану против электрохимических градиентов. Транспортные механизмы поддерживают ионный состав цитоплазмы, удаляя или возвращая те ионы, которые прошли клеточную мембрану по их электрохимическим градиентам. Они также выполняют важную функцию переноса через клеточные мембраны субстратов метаболических реакций, таких как глюкоза и аминокислоты. Свойства транспортных молекул обсуждаются в главе 4.
Как выглядят ионные каналы?
Молекулярное строение ионных каналов и их внутримембранное устройство обсуждаются в деталях в главе 3. В контексте данной главы полезно, однако, дать несколько общих характеристик физическим свойствам ионных каналов. Трансмембранный ионный канал имеет центральную водную пору, сообщающуюся как с внеклеточным, так и с внутриклеточным пространством (рис. 2.1В). С обеих сторон канала пора расширяется, образуя устья. Узкая внутримембранная часть ионного канала формирует ворота, которые могут открываться и закрываться, регулируя прохождение ионов.
Размер белка ионного канала варьирует в значительной степени в зависимости от типа канала. Некоторые ионные каналы имеют дополнительные структуры (и связанные с ними новые свойства). На рис. 2.1В представлен типичный канал средних размеров. Для сопоставления размеров иона и ионного канала на рисунке изображен гидратированный ион натрия.
Избирательность каналов
Мембранные каналы отличаются по своей избирательности: некоторые проницаемы для катионов, другие для анионов. Некоторые катионные каналы являются селективными по отношению только к одному виду иона. Например, некоторые каналы проницаемы исключительно для ионов натрия, другие для ионов калия, прочие для ионов кальция. Однако существуют относительно неселективные катионные каналы, позволяющие проходить даже небольшим органическим катионам. Анионные каналы, связанные с передачей электрического импульса, обладают низкой специфичностью. Однако они, как правило, называются «хлорными каналами», потому что ион хлора является наиболее распространенным подвижным анионом в биологических жидкостях. Вдобавок, некоторые каналы (называемые коннексонами) соединяют соседние клетки и проницаемы как для многих неорганических ионов, так и для некоторых мелких органических молекул. Коннексоны обсуждаются в главе
7.
Открытое и закрытое состояния
Хотя для простоты мы часто представляем белковые молекулы как статические структуры, они таковыми вовсе не являются. Из-за своей тепловой энергии все большие молекулы внутренне нестабильны. При комнатной температуре химические связи растягиваются и ослабляются, то есть постоянно колеблются по отношению к устойчивому состоянию. Несмотря на то, что эти индивидуальные движения составляют величину только около 10–12 м (с частотой, достигающей 1013 Гц), такие атомные колебания могут приводить в итоге к гораздо более значительным и более медленным изменениям в структуре молекул. Это происходит потому, что многочисленные быстрые движения атомов периодически создают условия для взаимодействия функциональных групп белка, несмотря на наличие взаимных отталкивающих сил. Взаимодействия функциональных групп приводят к кинетическим переходам белка, которые, раз возникнув, могут длиться многие миллисекунды или даже секунды. Известным примером может служить молекула гемоглобина. Центры связывания кислорода заключены внутри макромолекулы этого белка,
Глава 2. Ионные каналы и нейрональная сигнализация |
37 |
и к ним нет постоянного свободного доступа. Связывание кислорода может быть достигнуто только за счет транзиторного доступа молекул газа к центрам связывания на молекуле тема. Таким образом, молекула гемоглобина «дышит», периодически становясь доступной для связывания кислорода, иначе данный белок был бы не способен выполнять предназначенную функцию по переносу газов 1).
Для ионных каналов функционально важными являются переходы между открытым и закрытым состояниями. Эти переходы совершаются практически моментально. С другой стороны, при системном изучении поведения любого ионного канала мы обнаружим, что время открытого состояния варьирует случайным образом. Иногда канал открыт только одну миллисекунду или даже меньше, хотя в следующий раз он может быть открыт на гораздо более продолжительное время (рис. 2.4). Тем не менее, каждый канал имеет характерное среднее время открытого состояния (т), и все вариации происходят вокруг этого среднего показателя.
Некоторые ионные каналы открываются достаточно часто даже в покое. Иными словами, вероятность нахождения таких каналов в открытом состоянии в неактивированной клетке относительно высока. Большинство таких ионных каналов проницаемо для калия или хлора. Они важны для генерации мембранного потенциала покоя. Остальные ионные каналы при этом закрыты, то есть вероятность нахождения их в открытом состоянии очень низка. Активация этих каналов адекватным стимулом резко увеличивает вероятность открытия. Этот же стимул может деактивировать ионные каналы, бывшие активными в покое. Важно помнить, что активация или деактивация канала означает возрастание или снижение вероятности открытия канала, но не увеличение или уменьшение времени открытого состояния (т) канала.
Помимо активации и деактивации, ионный ток через каналы регулируется двумя другими факторами. Первый фактор заключается в том, что ионный канал переходит в новое конформационное состояние, в котором обычный активирующий стимул не способен вызвать открытие канала. Для ионных каналов, активируемых деполяризацией, такое состояние называется инактивацией. Для каналов, отвечающих на химические стимулы, это состояние известно как десенситнзация. Второй механизм — блок открытого канала. Такое случается, когда, например, крупная молекула (такая как токсин) связывается с ионным каналом и физически закупоривает пору. Другим примером может служить блокирование некоторых катионных каналов ионами магния. В этом случае ионы магния сами не проникают через ионный канал, но связываются с каналом в области его устья и тем самым мешают проникновению других катионов.
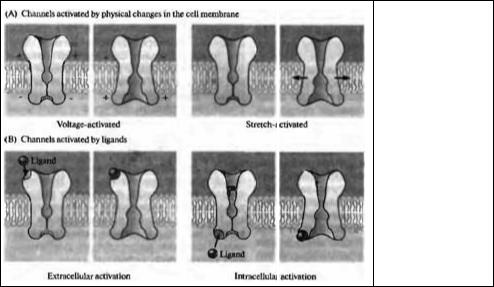
Способы активации
Рис. 2.2 суммирует представления о способах активации ионных каналов. Некоторые каналы специфически отвечают на физические изменения в клеточной мембране нейрона. Наиболее яркими представителями этой группы являются потенциал-активируемые каналы. Примером может служить чувствительный к потенциалу натриевый канал, который отвечает за регенеративную деполяризацию, лежащую в основе генерации потенциала действия (глава 6). К этой группе относятся также механочувствительные ионные каналы, которые отвечают на механическое воздействие на клеточную мембрану. Рецепторы растяжения, содержащие ионные каналы такого рода, найдены в механорецепторах кожи (глава 17).
Другие ионные каналы открываются тогда, когда химические агенты активируют связывающие центры на молекуле канала. Такие лнганд-актнвнруемые ионные каналы подразделяются на две подгруппы, в зависимости от того, являются ли активные центры внутриклеточными или внеклеточными. Каналом, отвечающим на внеклеточную активацию, является катионный канал постсинаптической мембраны в скелетной мышце. Этот канал активируется нейротрансмиттером ацетилхолином, освобождающимся из двигательного нервного окончания (глава 9). Открытие ацетилхолин-активируемого ионного канала позволяет ионам натрия войти в клетку, вызывая деполяризацию мышечного волокна.
Лиганд-активируемые каналы, отвечающие на внутриклеточные стимулы, включают каналы, чувствительные к местным изменениям концентрации специфических ионов. Например, кальций-активируемые калиевые каналы активируются локальным повышением концентрации внутриклеточного кальция. Такие каналы играют важную роль в реполяризации клеточной мембраны во время завершения потенциала действия. Помимо ионов кальция, типичными представителями лигандов, активирующих ионные каналы с ци-
38 |
Раздел П. Передача информации в нервной системе |
Рис. 2.2. Способы активации ионных каналов. (А) Ионные каналы, активируемые изменением мембранного потенциала или
растяжением мембраны. (В) Ионные каналы, активируемые химическими агентами, либо с внеклеточной, либо с внутриклеточной стороны.
Fig. 2.2. Modes of Channel Activation. The probability of channel opening is influenced by a variety of stimuli. (A) Some channels respond to changes in the physical state of the membrane, specifically changes in membrane potential (voltage-activated) and mechanical distortion (stretch-activated). (B) Ligand activated channels respond to chemical agonists, which attach to binding sites on the channel protein. Neurotransmitters, such as glycine and acetylcholine, act on extracellular binding sites. Included among a wide variety of intracellular ligands are calcium ions, subunits of G proteins, and cyclic nucleotides.
топлазматической стороны мембраны, являются циклические нуклеотиды. Циклический ГМФ, например, отвечает за активацию натриевых каналов в палочках сетчатки. Такой тип канала играет принципиальную роль в работе зрительного анализатора (глава 19).
Эта классификация не является достаточно строгой. Например, кальций-активируемые калиевые каналы чувствительны также к изменению потенциала, а некоторые потенциалактивируемые ионные каналы чувствительны к внутриклеточным лигандам.
§ 2. Измерение токов одиночного канала
Пэтч-кламп метод
Для измерения ионных токов через одиночные каналы первоначально был предложен непрямой метод анализа мембранного шума 2· 3). Затем был разработан способ прямой регистрации одиночных ионных каналов с помощью метода, который называется пэтчкламп (patch-clamp 4· 5)). В совокупности эти подходы дали прямые ответы на вопросы, касающиеся функции ионных каналов, как то: какой заряд проходит через одиночный канал? как долго канал остается открытым? как время нахождения ионного канала в открытом или закрытом состоянии зависит от мембранного потенциала?
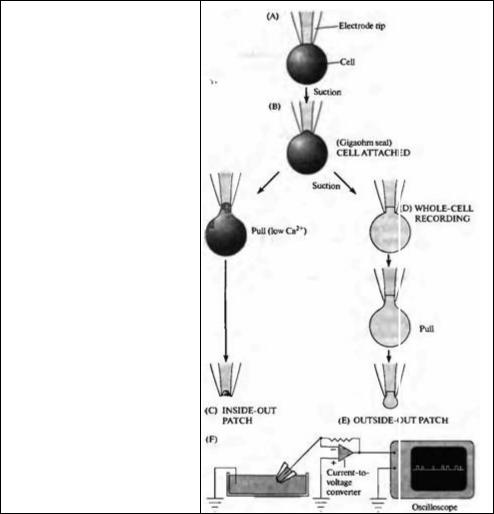
Пэтч-кламп метод, предложенный Э. Неером, Б. Сакманном и их коллегами, значительно углубил наши знания о функционировании ионных каналов. Для пэтч-кламп регистрации необходимо, чтобы кончик стеклянной пипетки с внутренним диаметром около 1 мкм плотно контактировал с мембраной исследуемой клетки. При удачном подведении, благодаря легкому присасыванию, между клеточной мембраной и стеклом пипетки (рис. 2.3А—В) создается сопротивление больше 109 Ом (отсюда возник термин «гигаомный контакт», gigaohm seal). Когда пипетка соединена с соответствующим усилителем, можно зарегистрировать небольшие токи, проходя-щие через участок мембраны, находящейся внутри кончика пипетки (рис. 2.3F). Такая конфигурация пэтч-кламп метода называется cell attached (контакт с клеткой). Высокоомный контакт гарантирует, что ионные токи, проводимые этим участком клеточной мембраны, проходят преимущественно через
Глава 2. Ионные каналы υ нейрональная сигнализация |
39 |
Рис. 2.3. Регистрация ионных токов методом пэтч-кламп. Электрод образует плотный контакт с мембраной (А), который благодаря легкому понижению давления превращается в гигаомный контакт (В). Оттягивание мембраны с последующим отрывом ее фрагмента приводит к конфигурации inside-out (С). Другой вариант основан на последовательном образовании конфигурации whole cell, и затем — outsideout (E).
Fig. 2.3. Patch Clamp Recording. (A-E) Patch configurations, represented schematically. The electrode forms a seal on contact with the cell membrane (A), which is converted to a gigaohm seal by gentle suction (B) Records may then be made from the patch of membrane within the electrode tip (cellattached patch). Pulling away from the cell results in the formation of a cell-free vesicle, whose outer membrane can then be ruptured to form an inside-out patch (C). Alternatively, the membrane within the electrode tip may be ruptured by further suction to obtain a wholecell recording (D) or, by pulling, to obtain an outside-out patch (E). (F) Recording arrangement. The patch electrode is connected to an amplifier that converts channel currents to voltage signals. The signals are then displayed on an oscilloscope trace or computer screen so that amplitudes and durations of single-channel currents can be measured. (A-E after Hamill et al., 1981.)
усилительную аппаратуру, а не теряются в месте контакта пэтч-пипетки с клеткой. При использовании пэтч-кламп метода регистрируемые события состоят из прямоугольных токовых сигналов, отражающих процессы открытия и закрытия одиночных ионных каналов. Таким образом, мы в реальном времени можем наблюдать активность одиночных белковых молекул мембраны.
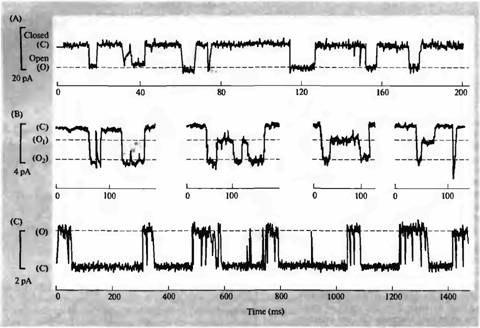
В простом случае токи одиночных каналов появляются нерегулярно и с различной продолжительностью, но с постоянной амплитудой (рис. 2.4А). В некоторых случаях, однако, картина токов может быть более сложной. Некоторые ионные каналы, например, в открытом состоянии могут иметь более чем один уровень проводимости, как это показано на рис. 2.4В. Кроме того, ионные каналы могут проявлять комплексную кинетику. Например, ток через одиночный ионный канал может выглядеть не как простой прямоугольник, а как «вспышка» открытий канала (рис.2.4С).
Таким образом, пэтч-кламп метод предоставляет новые уникальные возможности для изучения поведения ионных каналов. Во-первых, изоляция маленького участка мембраны позволяет наблюдать активность всего нескольких ионных каналов, а не тысяч, которые активируются в целой клетке. Во-вторых, высокое сопротивление контакта дает возможность регистрировать даже крайне
40 |
Раздел П. Передача информации в нервной системе |
|
|
|
|
Рис. 2.4. Примеры одиночных ионных каналов, зарегистрированных методом пэтч-кламл.
Fig. 2.4. Examples of Patch Clamp Recordings. (A) Glutamate-activated channel currents recorded in a cell-attached patch from locust muscle occur irregularly, with a single amplitude and varied open times. Downward deflections indicate current flowing into the cell. (B) Acetylcholine-activated currents from single channels in an outside-out patch from cultured embryonic rat muscle reach a maximum amplitude of about 3 pA and relax to a substate current of about 1,5 pA. Downward deflections indicate inward current. (C) Pulses of outward current through glycine activated chloride channels in an outside-out patch from cultured chick spinal cord cells are interrupted by fast closing and reopening transitions to produce bursts. (A after Cull-Candy, Miledi, and Parker, 1980; В after Hamill and Sakmann, 1981; С from A. I. McNiven and A. R. Martin, unpublished.)
малые токи. В результате мы имеем возможность точного измерения амплитуд токов одиночных ионных каналов и можем провести анализ кинетики каналов.
Конфигурации пэтч-кламп метода
Пэтч-кламп метод позволяет осуществлять также регистрацию ионных каналов и в других конфигурациях. Достигнув контакта в конфигурации cell attached, можно, отводя электрод, оттянуть участок мембраны для формирования inside-out (внутренняя сторона наружу) конфигурации (рис. 2.3С). В последнем случае цитоплазматическая сторона мембраны будет обрашена к перфузионному раствору. С другой стороны, с помощью небольшого дополнительного присасывания можно прорвать участок мембраны, расположенный внутри регистрирующего электрода, обеспечив контакт последнего с цитоплазмой клетки (рис. 2.3D). В этих условиях будут регистрироваться токи в конфигурации whole-cell (целая клетка). Наконец, после получения конфигурации «целая клетка», можно оттянуть электрод от клетки, сформировав из мембраны сначала тонкую перемычку, а затем, после отделения этого участка, получить конфигурацию outside-out (наружная сторона наружу; рис. 2.3Е). Каждая из этих конфигураций имеет свои преимущества, их использование зависит от типа изучаемого ионного канала и той информации, которую мы хотим получить в данном эксперименте. Например, для аппликации веществ на внешнюю сторону мембраны предпочтительной является конфигурация outside-out.
Пэтч-кламп конфигурация «целая клетка» предполагает обмен между цитоплазмой
Глава 2. Ионные каналы и нейрональная сигнализация |
41 |
клетки и раствором, заполняющим регистрирующую пипетку. Этот обмен, называемый иногда «диализ», может быть использован для намеренной замены внутриклеточного состава ионов на те, которые находятся в пипетке. С другой стороны (особенно в тех случаях, когда клетка мала), необходимо учитывать, что важные цитоплазматические компоненты могут быть потеряны из-за их быстрого перехода во внутрипипеточный раствор. Такой потери можно избежать, используя так называемый перфорированный пэтч-кламп метод 6). В этом случае для формирования начальной cell attached конфигурации используется пипетка, заполненная веществом, способным формировать мембранные поры (например антибиотик нистатин). По прошествии некоторого времени в изолированном с помощью электрода участке мембраны образуются проницаемые для электролитов поры, позволяющие регистрировать ионные токи в конфигурации «целая клетка».
Внутриклеточная микроэлектродная регистрация
До разработки пэтч-кламп метода свойства ионных каналов в клеточных мембранах исследовались в экспериментах, в которых для измерения мембранного потенциала или мембранного тока использовались стеклянные микроэлектроды. Использование Лингом и Джерардом 7) в 1949 году стеклянных микроэлектродов для внутриклеточной регистрации ионных токов в живых клетках было не менее важным событием, чем введение пэтч-кламп метода три десятилетия спустя. Этот метод обеспечивал точное измерение мембранного потенциала покоя клетки, потенциала действия, а также ответов на синаптическую активацию мышечных волокон и нейронов (глава 1).
Метод внутриклеточной регистрации проиллюстрирован на рис. 2.5А. Острая стеклянная микропипетка, диаметр кончика которой не превышает 0,5 мкм, заполненная концентрированным солевым раствором (например, 3 M KC1), служит электродом и присоединяется к вольтметру для записи потенциала. Момент прокалывания пипеткой клеточной мембраны, приводящий к проникновению ее в клеточную цитоплазму, проявляется мгновенным появлением потенциала, соответствующего мембранному потенциалу покоя. При удачном проникновении в клетку мембрана обхватывает внешнюю поверхность пипетки, благодаря чему цитоплазма остается изолированной от внеклеточной жидкости.
Внутриклеточная регистрация шума ионных каналов
В начале 1970-х годов, используя нервно-мышечный синапс лягушки, Катц и Миледи предприняли оригинальные эксперименты, в которых метод внутриклеточной микроэлектродной регистрации использовался для изучения характеристик «шумов», продуцируемых медиатором ацетилхолином (АХ). В таком синапсе АХ, освобождаюшийся из моторного нервного окончания, открывает хемовозбудимые ионные каналы постсинаптической мембраны. Вход катионов в волокно через открытые ионные каналы вызывает деполяризацию мембраны (глава 9). Когда Катц и Миледи локально апплицировали экзогенный АХ на область синапса, они обнаружили, что вызванная деполяризация сопровождалась электрическим «шумом». Во время стабильной деполяризации быстрые колебания потенциала были гораздо больше колебаний изолинии в покое. Они предположили, что возрастание электрического шума в присутствии АХ было связано с хаотичным открытием и закрытием АХ-активируемых ионных каналов. Иными словами, аппликация АХ приводила к открытию большого числа ионных каналов, и число это случайно колебалось в зависимости от числа взаимодействий АХ с рецепторами.
Используя известную из физики технику анализа шума, Катц и Миледи смогли получить информацию о среднестатистическом поведении отдельного ионного канала, активируемого АХ. Позднее подобные эксперименты были проведены на том же объекте Anderson и Stevens 3). В отличие от предшественников, эти исследователи измеряли мембранный ток, вызванный АХ, что позволило установить величину и продолжительность ионных токов через одиночный канал (рис. 2.5В).
Принципы анализа шума достаточно просты: во-первых, если токи одиночного канала являются большими, суммарный шум также будет большим. Во-вторых, ионные каналы, открывающиеся на относительно длительное время, будут продуцировать низкочастотный шум; наоборот, каналы, открывающиеся на короткое время, будут продуцировать высокочастотный шум. Исследование амплитудно-временных характеристик шумов, ак-
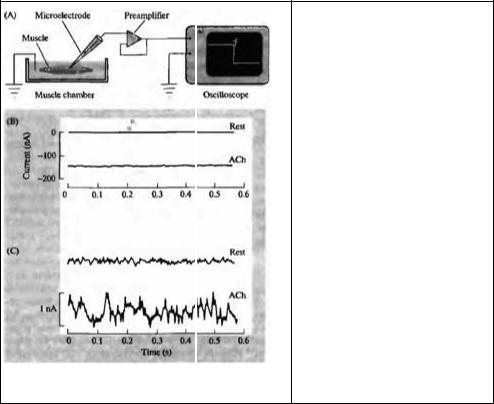
42 |
Раздел II. Передача информации в нервной системе |
Рис. 2.5. Внутриклеточное отведение электрического «шума», производимого функционированием ионных каналов. (А) Схема установки для регистрации мембранного потенциала. (В) Внутриклеточная регистрация эффекта ацетилхолина. (С) При большем усилении виден ацетилхолиновый «шум».
Fig. 2.5. Intracel ular Recording of Channel Noise. (A) Arrangement for recording membrane potentials of muscle fibers with a microelectrode. The electrode is connected to a preamplifier, and the signals are displayed on an oscilloscope or computer screen.
Penetration of the electrode into a fiber is marked by the sudden appearance of the resting potential (downward deflection on the screen). After penetration, changes in potential due to channel activation can be measured. (B) Intracellular records of the effect of acetylcholine (ACh). In this experiment additional circuitry was used to record membrane current (rather than membrane potential). At rest (upper trace), there is no current across the membrane; application of ACh produces about 130 nA of inward current
(lower trace). (C) Traces in В shown at greater amplification. The baseline shows little fluctuation at rest; the inward current produced by ACh shows relatively large fluctuations ("noise"), due to random opening and closing of ACh-activated channels. Analysis of the increased noise yields values for the singlechannel current and the mean open time of the channels. (B and С after Anderson and
Stevens, 1973.)
тивированных АХ в нервно-мышечном синапсе, показало, что через одиночный открытый ионный канал проходит около 10 миллионов ионов в секунду. Кроме того, выяснилось, что значение среднего открытого времени (τ) ионного канала составляет от 1 до 2 мс.
Несмотря на широкое вытеснение пэтч-кламп методом, анализ шума до сих пор используется для изучения ионных каналов в клетках, которые не поддаются исследованию с помощью пэтч-клампа, например, в некоторых областях центральной нервной системы 8). Кроме того, анализ шума является сравнительно быстрым методом для получения информации о свойствах большой популяции каналов и используется в комбинации с пэтч-кламп регистрацией от целой клетки для идентификации типов каналов. Тем не менее, надо понимать, что с помощью анализа шума невозможно получить детальную информацию о поведении одиночного канала, особенно в каналах со сложной кинетикой или при наличии нескольких уровней проводимости канала.
Проводимость каналов
Кинетическое поведение канала, то есть время его нахождения в закрытом и открытом состояниях, может предоставить информацию о механизмах открытия и закрытия канала, а также о константах скоростей этих процессов. С другой стороны, величина тока, проходящего через ионный канал, является прямым отражением того, как быстро проникающие ионы движутся через канал. Ток ионов зависит не только от свойств канала, но также от трансмембранного потенциала. Пример такого рода показан на рис. 2.6. На этом рисунке изображен фрагмент мембраны, который содержит один спонтанно активный ионный канал, проницаемый для калия. Растворы, как в пипетке, так и в ванночке для объекта, содержат одинаковую (150 ммоль) концентрацию ионов калия. Ионы калия через открытый канал могут двигаться в обоих направлениях. Однако поскольку концентрации ионов по обе стороны мембраны идентичны, а трансмембранный потенциал отсутствует, то нет никакого движения ионов ни в одном
