
Вьюник. Лекция № 4
.pdf
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Поняття про ентропiю
Ентропiйний та ентальпiйний фактори процесу
Ентропiйний та ентальпiйний фактори процесу: З розгляду ΔH та ΔS процесiв витiкає , що в хiмiчних процесах одночасно дiє двi тенденцiї:
1 Тенденцiя частинок об‘єднуватися в бiльш складнi агрегати, що зменшує H;
i
2Тенденцiя частинок роз‘єднатися (дезагрегацiя) стремлiння до неупорядкованого розмiщення частинок, що збiльшує ентропiю.
Система переходить в стан з найменшою енергiєю лише тодi, коли ΔS = 0; Якщо ж ΔH= 0, то система переходить в найбiльш неупорядкований стан.
11/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Поняття про ентропiю
Ентропiйний та ентальпiйний фактори процесу
Для кiлькiсного спiвставлення цих протилежно дiючих факторiв необхiдно їх величини виразити в однакових одини-
цях |
ΔH |
або T·ΔS, переводячи T·ΔS в Кдж/моль або |
ΔH |
|
|
||
T |
T |
в Дж/моль. Вибiр T·ΔS є бiльш обгрунтованим, так як обидва спiвмножники виражають стремлiння до безладу.
Рiвнiсть ентропiйного та ентальпiйного факторiв вiдповiдає рiвновазi. ΔH = T·ΔS (a).
Рiвняння (а) є умовою рiвноваги та характеризує такий стан даної системи, коли швидкостi перебiгаючих в нiй протилежних процесiв стають рiвними(−→V = ←V−).
12/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Поняття про ентропiю
Ентропiйний та ентальпiйний фактори процесу
Наприклад: H2O при T = 100◦C та тисковi 1 атм. (кипить). Плавлення кристалiв, сублимацiя, полiморфнi перетворення, рiвновага мiж насиченим розчином i кристалами, хiмiчнi рiвноваги.
Рiвняння (а) це умова рiвноваги, характеризує такий стан системи коли швидкостi перебiгаючих протилежних процесiв рiвнi.
13/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
Поняття про вiльну енергiю системи та про її змiну в фiзико-хiмiчних процесах.
Вiдомо, що в механiцi велику роль вiдiграє принцип стремлiння до мiнiмуму потенцiальної енергiї.
Тенденцiя до перемiщення тiла зверху вниз визначається рiзницею його рiвнiв в початковому та кiнцевому положеннях i не залежить вiд траєкторiї падiння. Рух припиняється, коли гравiтацiйний потенцiал досягає мiнiмуму настає рiвновага.
Збиток гравiтацiйного потенцiалу дорiвнює роботi падiння тiла.
14/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
В хiмiчних процесах є також свiй потенцiал. Подiбно механiчному (гравiтацiйному) потенцiалу вiн зменшується (спадає) в самодовiльних процесах.
Оскiльки ми розгядаємо процеси при сталих Р, Т, то потенцiал, який є рушiйною силою хiмiчних процесiв, логiчно назвати iзобарно-iзотермiчним, позначають G. Hа честь американського вченого Гiббса прийнято називати ще енергiєю Гiббса.
Цю величину називають ще вiльною енергiєю при P = CONST, вiльною ентальпiєю.
15/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
Збиток цього потенцiалу не залежить вiд шляху процесу та дорiвнює максимальнiй роботi реакцiї за виключенням роботи проти зовнiшнього тиску −ΔG = A′max.
A = A′ + 12 PDV, A′ = A − 12 PDV
Це робота переходу системи з даного стану (1) до рiвноважного (2). Умовою принципової можливостi процесу є нерiвнiсть ΔGP,T < 0.
Чим бiльше збиток (−ΔG), тим > хiмiчна спорiдненнiсть, тим бiльше вiддалена система вiд стану рiвноваги.
Якщо розглядаєма (якась) реакцiя протiкає в прямому напрямку, то в зворотньому напрямку вона при даних P i T неможлива, так як для протилежного процесу ΔGP,T > 0iндикатор принципової неможливостi процесу.
16/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
Люба реакцiя може протiкати самодовiльно тiльки в напрямку, який наближує систему до рiвноваги.
Якщо в системi наступила iстинна рiвновага, то подальша змiна ΔG не буде вiдбуватися, тобто ΔGP,T = 0.
Мiрою хiмiчноi спорiдненностi є збиток (G), тобто (−ΔG). ΔG рушiйна сила процесу. Чим менша ΔG, тим дальше система вiд стану рiвноваги i тим бiльша її реакцiйна здатнiсть.
17/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
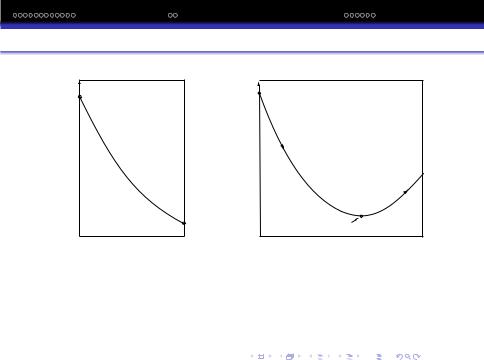
G |
G |
p,T = const |
p,T = const |
A |
ΔG<0
ΔG=0  C
C
 B
B
ΔG>0
Вихідні |
Продукти |
Вихідні |
Рівноважний |
Продукти |
речовини |
реакції |
речовини |
склад |
реакції |
2KCLO3 = 2KCL + 3O2
Залежнiсть енергiї Гiббса вiд складу системи для екзотермiчної реакiї.
18/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
Обчислення змiни енергiї Гiббса
Для обчислення змiни енергiї Гiббса реакцiї використовують метод подiбний до способу розрахунку ΔH та ΔS, заснований на законi Гесса (наслiдок). При цьому ΔG простої речовини приймається рiвною 0.
Оскiльки ΔG не залежить вiд того шляху, по якому протiкає реакцiя, ця величина не дає нiякої iнформацiї про сам процес, про його швидкiсть i т.iнш.
Слiд пiдкреслити, що мiж принциповою можливiстю процесу та його практичною реалiзацiєю нерiдко дистанцiя величезного розмiру.
Нерiдко супроти розрахункiв реакцiю провести неможливо: ΔG> 0 : NO2 , Cl2O, H2S.
Цi сполуки кiнетично стабiльнi, не розпадаються.
19/26
Ентропiя |
Енергiя Гiббса |
Можливiсть та напрямок процесiв |
Енергiя Гiббса
Рiвняння Гiббса-Гельмгольца
Величина ΔG зв‘язана з ΔH та ΔS важливим спiввiдношенням:
ΔG = ΔH −T ·ΔS
G = H − T ·S.
Це рiвняння Гiббса-Гельмгольца.
Розмiрнiсть енергiї Гiббса: [Кдж/моль]
20/26
