
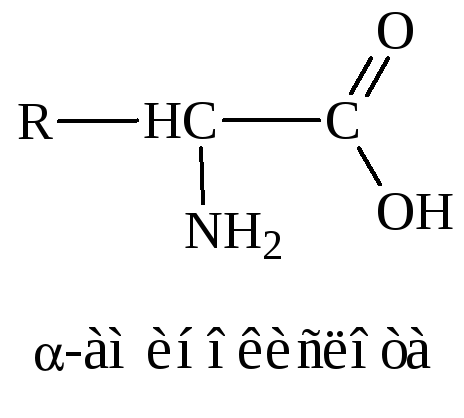
Физико-химические свойства аминокислот.
Кислотно-основные свойства аминокислот связаны с наличием в их структуре двух ионизируемых групп-карбоксильной и аминогруппы, поэтому амнокислоты могут проявлять свойства как кислот, так и оснований, т.е. они являются амфотерными соединениями. В кристаллическом состоянии и в водных растворах -аминокислоты существуют в виде биполярных ионов.
Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп.
Рассмотрим со свойствами аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп.
– Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.

рН среды, при которой амфотерное соединение – аминокислота, наименее или в равной мере диссоциирует по обоим направлениям, называется изоэлектрической точкой.
Такое значение рН называют изоэлектрической точкой и обозначают рНиэт или рI. Для моноаминомонокарбоновых кислот изоэлектрическая точка рассчитывается как среднее арифметическое двух значений рК. Например для аланина она равна:
рI = ½ (рК1 + рК2) = ½ (2,34 + 9,69) = 6,02
При значении рН, превышающем изоэлектрическую точку, аминокислота заряжается отрицательно, а при значении рН ниже рI аминокислота несет суммарный положительный заряд. Например, при рН = 1,0 все молекулы аланина существуют в форме ионов

с суммарным зарядом +1. При рН = 2,34, когда имеется смесь равных количеств ионов

суммарный заряд = +0,5. Аналогичным образом можно предсказать знак и величину суммарного заряда для любой другой аминокислоты при любом значении рН.
В изоэлектрической точке аминокислота существует в виде биполярного иона (в целом электрически нейтрального соединения), поэтому в изоэлектрической точке водные растворы аминокислот неэлектропроводны. Кислотно-основные свойства аминокислот используются для разделения и последующей идентификации аминокислот методами электрофореза и ионообменной хроматографии. Оба эти метода основаны на различиях в знаке и величине суммарного электрического заряда при данном значении рН.
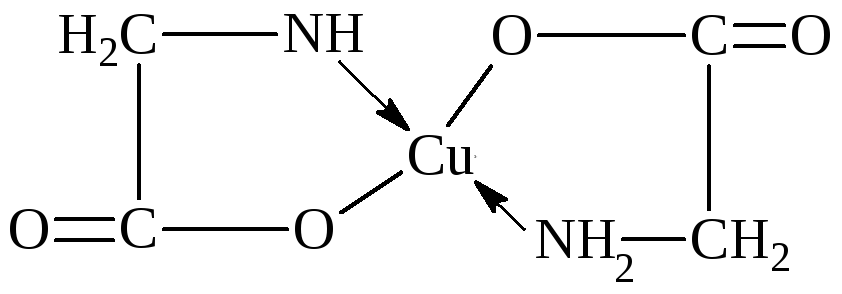
– С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями
– Химическое поведение аминокислот в значительной мере определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот.
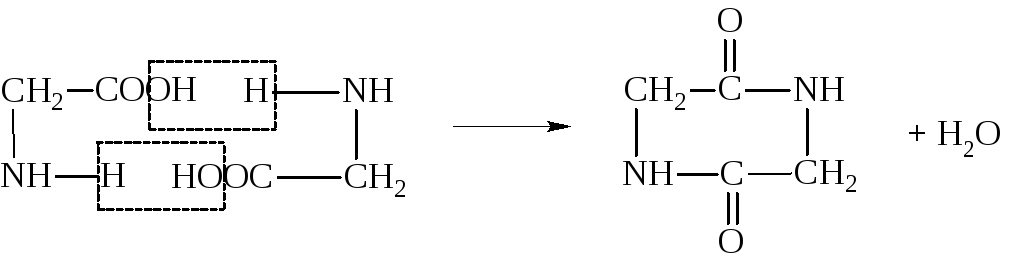
α-Аминокислоты при нагревании легко отщепляют воду и дают дикетопиперазины.
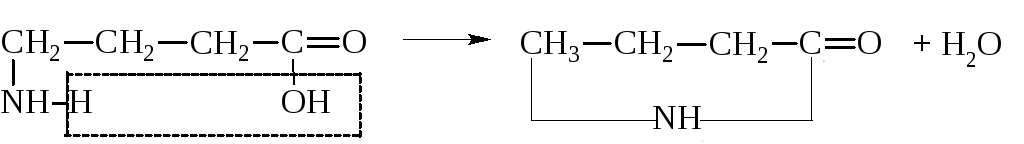
β-Аминокислоты отщепляют аммиак и образуют аммонийную соль непредельной кислоты

γ и δ-Аминокислоты отщепляют воду внутримолекулярно и дают лактамы
Для пищевиков представляет интерес реакция аминокислот с соединениями, содержащими карбонильную группу С=О, с различными альдегидами и восстанавливающими сахарами (глюкозой, рибозой и отчасти фруктозой). В результате этой реакции происходит разложение как исходной аминокислоты, так и реагирующего с ней восстанавливающего сахара.

Отдельные представители
α-Аминопропионовая кислота (α-аланин)

В α-аланине имеется асимметрический атом углерода. Поэтому он оптически активен. L(+)-аланин входит в состав всех белков. Его можно получать гидролизом фиброина шёлка.
2,6-диаминогексановая кислота (лизин)
*
![]()
В состав лизина входят две аминогруппы и один карбоксил. Поэтому он является сильным основанием. L(+)-лизин входит в состав белков и относится к незаменимым аминокислотам.
6-аминогексановая кислота (ε-аминокапроновая)
![]()
Эта кислота и её лактам, капролактам, используется для получения синтетического волокна капрон.
