- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
Глава 1 дисперсные системы
1.1. Общая характеристика дисперсных систем
Реальный окружающий нас мир, как и мы сами, находится в раздробленном состоянии, т.е. состоит из дисперсных систем. Дисперсные системы по размерам занимают промежуточное положение между молекулами (атомами, ионами) и макроскопическими объектами (фазами). Частицы таких размеров широко распространены в природе и участвуют во многих технологических процессах. Почва, водоемы (реки и моря), атмосфера Земли (облака, туманы), а также сырье и конечная продукция различных промышленных производств, строительные материалы, металлы, полимеры, продукты питания, медицинские препараты – все это дисперсные системы.
Дисперсные системы выделяют в особую группу, т.к. многие физические и особенно химические свойства таких систем значительно отличаются от аналогичных свойств макроскопических объектов одного и того же вещества. Такие свойства как прочность, теплоемкость, температура плавления, температура кипения, магнитные и электрические характеристики, реакционная способность выражены тем сильнее, чем меньше размер частиц, и, поэтому, особенно характерны для частиц нанометровых размеров (наночастиц). Особые свойства наночастиц открывают новые практические приложения физики, химии, биологии, медицине и других наук. Поэтому изучение дисперсных частиц (методов их получения, структуры, физических и химических свойств) относится к наиболее актуальным и перспективным задачам современной науки.
Почему же дисперсные системы такие особенные? Благодаря своим малым размерам дисперсные частицы обладают огромной поверхностью и большинство молекул и атомов в таких системах находятся в поверхностном слое. Молекулы и атомы в поверхностных слоях обладают особыми свойствами, отличными от свойств таких же молекул внутри фазы и обуславливают наличие так называемых поверхностных явлений. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз: адгезия, адсорбция, смачивание, образование двойного электрического слоя и другие явления.
Таким образом, целью изучения дисциплины «Коллоидная химия» является изучение дисперсных систем и поверхностных явлений, протекающих на границах раздела фаз.
1.1.1. Признаки объектов коллоидной химии
Для объектов коллоидной химии характерны два основных признака, сформулированных одним из основоположников отечественной коллоидной химии Н.П. Песковым: гетерогенность и дисперсность.
Гетерогенность (многофазность) указывает на наличие межфазной поверхности и поверхностного слоя. Количественной характеристикой гетерогенности является величина поверхностного натяжения (удельной поверхностной энергии) на границе раздела фаз. Чем сильнее выражена гетерогенность и чем сильнее по природе отличаются соприкасающиеся фазы, тем больше поверхностное натяжение. Всякая дисперсная система состоит из дисперсной фазы и дисперсионной среды.
Дисперсная система

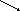

Рис. 1.1. Состав дисперсной системы
Дисперсность (раздробленность) определяется размерами и геометрией частиц. Частицы могут быть сферическими, цилиндрическими, кубическими, а чаще всего имеют неправильную форму.
Мерой дисперсности может служить:
Поперечный размер частиц (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l).
Дисперсность (D) – величина, обратная поперечному размеру частицы: D = l/a.
Удельная поверхность (Sуд) – межфазная поверхность, приходящаяся на единицу объема или массы дисперсной фазы:
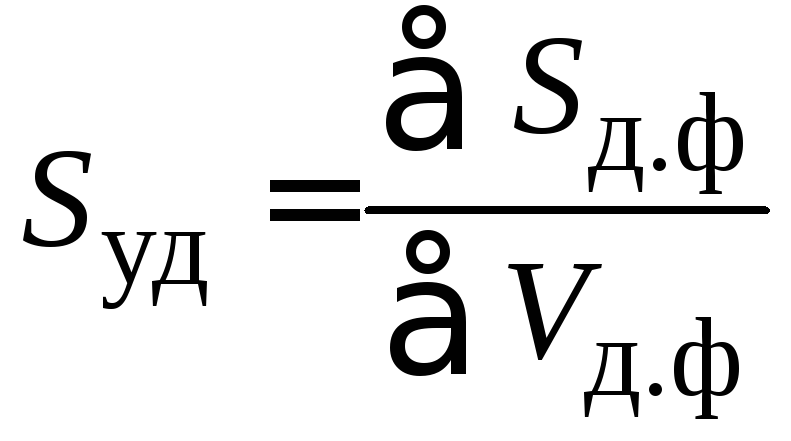 ; или
; или  . (1.1)
. (1.1)
Удельная поверхность связана с размером (дисперсностью) и формой частиц (табл. 1.1).
Таблица 1.1
|
Частицы сферической формы |
|
|
Частицы цилиндрической формы |
|
|
Частицы кубической формы |
|
Таким образом, удельная поверхность прямо пропорциональна дисперсности D, и обратно пропорциональна поперечному размеру частицы а.
Рассчитаем изменение удельной поверхности 1 см3 вещества при дроблении его на кубики меньших размеров.
Таблица 1.2
Изменение Sуд при дроблении 1 см3 вещества
|
Длина ребра куба l, см |
Число кубиков |
Sуд, см–1 |
|
1 |
1 |
6 |
|
1·10–1(1 мм) |
10·10·10=1·103 |
60 |
|
1·10–2 |
1·106 |
600 |
|
1·10–4(1 мкм) |
1·1012 |
60 000 |
|
1·10–7(1 нм) |
1·1021 |
60 000 000 |
Таким образом, при дроблении вещества до коллоидных размеров удельная поверхность достигает значительных величин – до тысяч квадратных метров на 1 см3.
|
Рис. 1.2. Зависимость удельной поверхности системы от размера частиц: I– истинные растворы;II– высокодисперсные (коллоидные);III– среднедисперсные;IV– грубодисперсные |
При увеличении дисперсности, т.е. при уменьшении размера частиц вещества, его удельная поверхность резко возрастает (рис. 1.2). По величине удельной поверхности коллоидные системы занимают особое положение среди дисперсных систем. Это наглядно показано на диаграмме, изображающей резкое увеличение удельной поверхности при уменьшении размеров частиц до коллоидных размеров. В связи с резким увеличением удельной поверхности высокодисперсные системы обладают рядом специфических особенностей. |
Пример 1.1. Дисперсность частиц коллоидного золота 108 м–1. Принимая частицы золота в виде кубиков определить, какую поверхность они могут покрыть, если их плотно уложить в один слой. Масса коллоидных частиц золота 1 г. Плотность золота 19,6·103 кг/м3.
Решение:
1. Общая поверхность частиц коллоидного золота равна S = Sуд·V.
2. Удельная поверхность кубических частиц Sуд = 6D.
3. Объем золота равен V = m/ρ.
4. Тогда общая площадь поверхности составит:
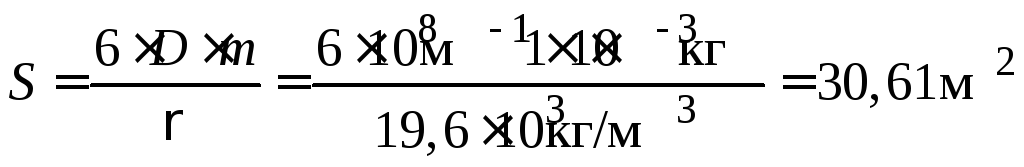 .
.