- •Исследование состояния газа Ван-дер-Ваальса
- •Исследование состояния газа Ван-дер-Ваальса
- •4.1 Понятие газа Ван-дер-Ваальса
- •4.2 Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
- •5 Порядок выполнения работы
- •5.1 Ознакомьтесь с методическими указаниями к лабораторной работе
- •5.2 Введение. Порядок работы с программой
- •5.3 Методика и порядок измерений
- •Получите у преподавателя допуск для выполнения измерений.
- •5.4 Измерения
- •5.5 Обработка результатов и оформление отчета:
- •6 Контрольные вопросы
- •7 Содержание отчёта
- •8 Список использованной литературы

МИНОБРНАУКИ РОССИИ
Егорьевский технологический институт (филиал)
федерального государственного бюджетного образовательного учреждения
высшего профессионального образования
«Московский государственный технологический университет «СТАНКИН»
(ЕТИ ФГБОУ ВПО МГТУ «СТАНКИН»)
Факультет технологии и управления производствами
Кафедра естественнонаучных дисциплин
Исследование состояния газа Ван-дер-Ваальса
Методические указания к выполнению лабораторной работы
ЕТИ. Ф.ЛР.10.
г. Егорьевск 2014
Составители: _____________ В.Ю. Никифоров, ст. преподаватель ЕНД
В методических указаниях рассмотрено понятия идеального, физического газов и газа Ван-дер-Ваальса, агрегатных состояний, фазовых переходов и тройной точки, рассмотрены кривые давления насыщенного пара жидкостей и твердых веществ, а так же рассмотрены компьютерная модель, описывающей вещество в газообразном состоянии и его переход в жидкое состояние, и экспериментальное подтверждение закономерностей поведения «реального газа» (газа Ван-дер-Ваальса) с использованием компьютерной программы ООО «Физикон» «Открытая физика 1.1» версия «Виртуальный практикум по физике для ВУЗов». В основе данных методических указаний лежит учебное пособие «Тихомиров Ю.В. Лабораторные работы по курсу физики с компьютерными моделями (Молекулярная физика и термодинамика). Учебное пособие для студентов высших технических учебных заведений дневной, вечерней и заочной (дистанционной) форм обучения. -М.:2003.-22 с.»
Методические указания предназначены для студентов 1 курса, обучающихся по направлению подготовки бакалавров 280700 Техносферная безопасность для лабораторных работ по дисциплине "Физика".
Методические указания обсуждены и одобрены на заседании учебно-методической группы (УМГ) кафедры ЕНД
(протокол № ___________ от __________г.)
Председатель УМГ _____________ Г.Г Шабаева
Исследование состояния газа Ван-дер-Ваальса
Цель работы:
Знакомство с компьютерной моделью, описывающей вещество в газообразном состоянии и его переход в жидкое состояние.
Экспериментальное подтверждение закономерностей поведения «реального газа» (газа Ван-дер-Ваальса).
Оборудование и материалы: компьютерный класс, пакеты прикладных программ для поддержки лабораторного практикума компании ООО «ФИЗИКОН»: «Виртуальный практикум для ВУЗов» или «Открытая Физика» версия 2.5 часть 1.
Содержание работы.
3.1 Изучить теоретический материал.
3.2 Определить графически критическую изотерму и значения критических параметров ТКР, VКР, pКР .
3.3 Провести испытания по изучению изотерм газа Ван-дер-Ваальса для заданной температуры Т1 и заполнить таблицу аналогичную таблице 2 методических указаний.
3.4 Установив новое значение температуры Т из таблицы 1, задавая Vнач = 0.1 дм3, повторите измерения, записывая результаты в таблицы 3,4,5.
3.5 По
измеренным значениям критических
параметров вычислите константу А
=
![]() .
.
3.6 Построить графики по данным таблиц.
3.7 Для каждой изотермы определить значение количества вещества, вычислить среднее значение и величину константы А’
3.8 Оформить отчет.
Теоретические предпосылки работы
4.1 Понятие газа Ван-дер-Ваальса
Физическим газом называется вещество, находящееся в газообразном состоянии.
«Идеальный газ» это название модели, описывающей физический газ, находящийся в сильно разреженном состоянии (при не слишком больших давлениях и достаточно высоких температурах). Уравнением, связывающим параметры состояния идеального газа, является уравнение Менделеева-Клапейрона. Поэтому оно имеет второе название: уравнение состояния идеального газа. Его вид известен:
pV = RT, (1)
где p - давление газа, V - объем газа, - количество киломолей, R - универсальная газовая постоянная, T - температура газа.
Более точная модель физического (реального) газа была предложена Ван-дер-Ваальсом. Она также является приближенной, но лучше описывает процессы, нежели модель «идеальный газ». Иногда эту модель называют «реальный газ». Газом Ван-дер-Ваальса (ВдВ) называется воображаемый газ (модель), параметры состояния которого точно подчиняются уравнению
![]() . (2)
. (2)
Оно называется УРАВНЕНИЕМ ВАН-ДЕР-ВААЛЬСА. Здесь a и b - константы Ван-дер-Ваальса.
Добавка к внешнему давлению (а) обусловлена взаимным притяжением молекул друг к другу.
Поправка к объему (b) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в газе.
Изотермой называется зависимость давления от объема данного (фиксированного) количества вещества при постоянной температуре.
|
Рисунок 1 |
Рисунок 2 |
Рисунок 3 |
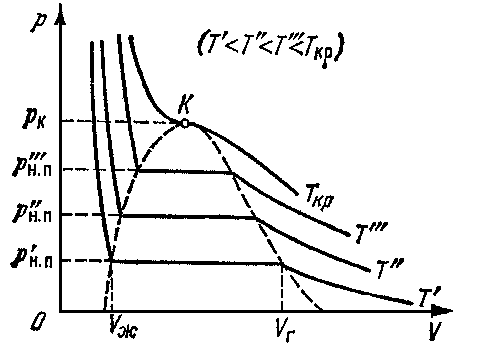
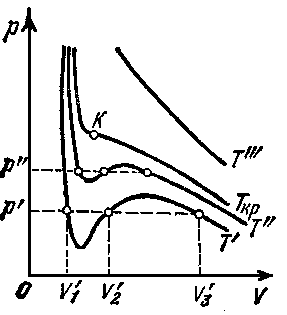
На рисунке 1 приведены изотермы некоторого физического (реального) газа, а на рисунке 2 и рисунке 3 - изотермы ВдВ газа (взяты из учебника [1] ).
Изотерма ВдВ газа, имеющая только точку перегиба и не имеющая экстремумов, называется критической. Температура критической изотермы называется критической температурой. Объем и давление в критической точке также называются критическими.
УРАВНЕНИЯ ДЛЯ КРИТИЧЕСКИХ ПАРАМЕТРОВ:
VКР
= 3bν,
pКР
=
![]() ,
TКР
=
,
TКР
=
![]() ,
,![]() ,
,![]() .
.
Отсюда
А =
![]()
= 0,375. (3)
= 0,375. (3)
При температуре выше критической вещество может находиться только в газообразном состоянии. При температуре ниже критической вещество может находиться как в газообразном, так и в жидком состоянии.
Жидкое состояние описывается левыми (по отношению к точке перегиба на графике) частями графиков на рисунках и характерно тем, что небольшое уменьшение объема вещества может произойти только при резком увеличении давления (жидкость практически несжимаема).
Изотермы ВдВ примерно совпадают с изотермами реального газа на участках, соответствующих однофазным состояниям вещества.
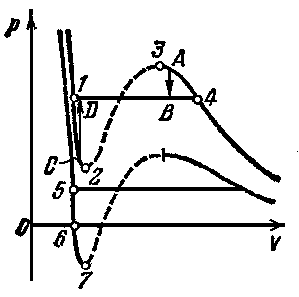
Рисунок 3 разъясняет поведение вещества при разных внешних условиях. В области, где присутствуют 2 фазы (1-2-3-4) S-образный завиток изотермы ВдВ заменяется горизонтальным участком (1-4) реальной изотермы (см.учебник).
НЕРЕАЛИЗУЕМОЕ
СОСТОЯНИЕ
соответствует участку 2-3, на котором
сжимаемость
![]() вещества была бы отрицательна, что
невозможно.
вещества была бы отрицательна, что
невозможно.
ПЕРЕОХЛАЖДЕННЫЙ ПАР на участке 3-4 реализуется при определенных условиях (при практическом отсутствии центров конденсации и внешних воздействий).
ПЕРЕГРЕТАЯ ЖИДКОСТЬ на участке 1-2 реализуется при отсутствии примесей, способных быть центрами кипения.