
- •Государственное образовательное учреждение
- •Государственное образовательное учреждение
- •Аннотация
- •Цель и задачи дисциплины
- •Требования к уровню освоения содержания дисциплины
- •Объем дисциплины и виды учебной работы
- •Разделы (темы) дисциплины и виды занятий
- •Содержание лекционного курса
- •Лабораторный практикум
- •Виды самостоятельной работы студентов
- •Учебно-методическое обеспечение дисциплины
- •Материально-техническое обеспечение дисциплины
- •Формы текущего, промежуточного и итогового контроля
- •Перечень вопросов, выносимых на зачет
- •Рейтинговая система оценки знаний студентов
- •Методические рекомендации к написанию и защите бакалаврских и дипломных работ
- •1. Общая характеристика работы.
- •1. Структура и содержание работы (пояснительной записки).
- •1. Рецензия на работу и отзыв руководителя работы.
- •2. Выступление и демонстрационные материалы.
- •Учебно-методические рекомендации для студентов и организации самостоятельной работы студентов
- •Общие правила выполнения лабораторных работ
- •Методические указания студентам
- •Методические рекомендации для преподавателя
- •1. Приготовление раствора соли с заданной массовой долей
- •2. Приготовление растворов с заданной молярной или нормальной концентрацией
- •3. Определение концентрации раствора кислоты методом титрования
1. Приготовление раствора соли с заданной массовой долей
По заданию преподавателя рассчитайте сколько потребуется соли и воды для приготовления раствора заданной концентрации (проверьте у преподавателя).
На лабораторных технохимических весах взвесьте нужное количество соли.
Перенесите навеску в коническую колбу.
Отмерьте цилиндром необходимое количество воды и влейте в колбу с солью (воду необходимо приливать постепенно, все время перемешивать раствор).
Приготовленный раствор перелейте в цилиндр на 250 мл и измерьте ареометром его плотность.
Рассчитайте молярную и нормальную концентрацию приготовленного раствора.
Результаты опыта оформите в виде таблицы 1.
Таблица 1

2. Приготовление растворов с заданной молярной или нормальной концентрацией
По заданию преподавателя приготовить раствор кислоты заданной концентрации.
Рассчитайте, какое количество (мл) исходной кислоты необходимо для приготовления раствора заданной концентрации (расчет проверьте у преподавателя).
Определите плотность исходного раствора кислоты. Для этого в цилиндр на 250 мл налейте кислоту и ареометром измерьте плотность.
Используя справочные таблицы, по измеренной плотности определите процентную концентрацию кислоты.
Мерной пипеткой отберите необходимый объем кислоты и поместите в мерную колбу нужного объема.
Добавьте недостающее до необходимого объема количество дистиллированной воды в мерную колбу. Последние несколько миллилитров добавляйте с помощью пипетки до метки на колбе.
Закройте колбу стеклянной пробкой и перемешайте содержимое многократным перемешиванием.
Результаты вычислений занесите в таблицу 2.
Титрованием определите точную концентрацию полученного раствора кислоты по методике, описанной ниже.
Таблица 2

3. Определение концентрации раствора кислоты методом титрования
Закрепите бюретку в штативе и промойте ее раствором щелочи известной концентрации, взятым для титрования.
Выпустите немного щелочи из бюретки, чтобы нижняя ее часть и кран наполнились щелочью, а затем наполните бюретку щелочью до нулевой отметки.
Пипеткой отберите точный обьем приготовленного раствора кислоты (10 мл) и перенесите его в коническую колбу для титрования.
Добавьте 2-3 капли индикатора.
Титрование проводят на фоне белого листа бумаги.
При титровании по каплям приливают раствор щелочи с известной концентрацией из бюретки в колбу с анализируемым раствором кислоты, который постоянно перемешивают. Конец титрования устанавливают по изменению цвета индикатора.
Результат титрования (объем раствора щелочи, пошедшего на титрование) записывают. Титрование проводят дважды, если результаты двух титрований отличаются друг от друга более чем на 0,1 мл.
Расчет концентрации полученного раствора по закону эквивалентов.
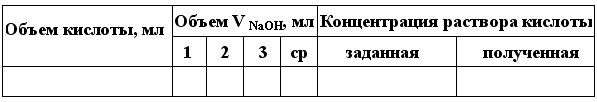
Результаты опыта оформляют в виде таблицы 3.
Таблица 3
Примерные контрольные вопросы
Чем отличается раствор от механических смесей и химических соединений?
Из каких процессов состоит растворение? Тепловые эффекты при растворении.
Как определяется молярная концентрация? Дайте понятие и приведите математическую формулу для расчета молярной концентрации.
Как определяется процентная концентрация? Дайте понятие и приведите математическую формулу для расчета процентной концентрации.
Как определяется нормальная концентрация? Дайте понятие и приведите математическую формулу для расчета нормальной концентрации.
1если УМК разрабатывается обучающей кафедрой
