
- •Що таке еквівалентна електрична провідність?
- •Охарактеризуйте особливості коагуляції золів сумішами електролітів.
- •Що таке діаграма плавкості?
- •Що таке кінетична стійкість дисперсної системи?
- •Які властивості розчинів називають колігативними?
- •Що таке активні молекули?
- •Як можна виміряти електродний потенціал?
- •В чому полягає сутність методів хроматографічного аналізу?
- •Що таке буферна система?
- •Що таке гальванічний елемент?
- •Як орієнтуються молекули поверхнево-активної речовини в адсорбційному шарі?
- •В чому полягає суть методу потенціометричного титрування?
- •Сформулюйте закон Кольрауша, наведіть математичний вираз закону.
- •В чому полягає спільність та відмінність у властивостях розчинів високомолекулярних сполук та істинних розчинів; розчинів вмс та колоїдних розчинів?
- •Дайте визначення понять: фаза, компонент, ступінь свободи системи.
- •В чому полягає сутність методу кондуктометричного титрування?
-
В чому полягає суть методу потенціометричного титрування?
Поте́нціометричне титрува́ння — титриметричний метод, що використовує електрохімічний елемент як детектор, за допомогою чого реєструється вся крива титрування (у вигляді залежності електрорушійної сили ΔE від доданого об'єму ΔVR) чи сама кінцева точка. Точка перегину кривої титрування, що відповідає найбільшому значенню ΔE/ΔVR, збігається з кінцевою точкою реакції, якщо крива титрування симетрична. Якщо стехіометрія реакції не відповідає 1:1, крива титрування несиметрична.
Який вигляд мають інтегральні криві титрування: а) сильної кислоти; б) слабкої кислоти.
А
 б
б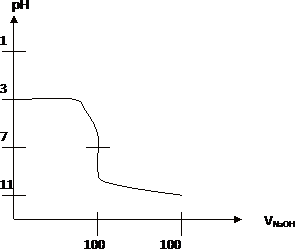
Поясніть хід кривих.
Чим більше концентрації кислоти і основи, тим більше висота стрибка титрування
Який вигляд має диференціальна крива титрування суміші сильної та слабкої кислот?
У сильної рН зростає, у слабкої зменшується
Поясніть хід кривої.
Одна крива зростає, інша спадає
Які переваги має такий метод обробки даних титрування?
Wrong
Білет 7
-
Сформулюйте закон Кольрауша, наведіть математичний вираз закону.
Закон Кольрауша (рос. закон Кольpауша, англ. Kohlrausch's law) — гранична еквівалентна провідність Λ0електроліту є сумою граничних йонних еквівалентних провідностей аніонів Λ0- та катіонів Λ0+:
Λ0= Λ0-+ Λ0+.
У випадку молярної електропровідності
Λ0= ν1Λ0-+ ν2Λ0+,
де ν1 та ν2 — кількості йонів у молекулі.
Закон був встановлений німецьким фізико-хіміком Фрідріхом Кольраушем у 1879 році.
Чим пояснюється аномально висока рухливість іонів Н3О+ та ОН-?
Низьким ступенем дисоціації / мала валентність
Як визначити ступінь (а) дисоціації та константу дисоціації Кд слабкого електроліту кондуктометричним методом?
А) Сту́пінь дисоціа́ції або коефіціє́нт дисоціа́ції — кількісний показник, обчислений як відношення числа формульних одиниць розчиненої речовини, що розпалися на його йони, до їх загального числа дисоціації.
Позначається зазвичай α і є безрозмірною величиною.
Ступінь дисоціації залежить від концентрації. Для слабких електролітів, у яких можна знехтувати взаємодією йонівміж собою, справедливий закон розведення Оствальда
Б) Константа дисоціації в хімії та біохімії — специфічний тип константи рівноваги, що описує схильність хімічного об'єкта оборотно розпадатися на компоненти, наприклад, дисоціації комплексу на окремі молекули в його складі або розпаду солі на іони. Константа дисоціації позначається Ка і є зворотною величиною до константи спорідненості. У випадку солей константа дисоціації може називатися константою іонізації. Це фізична величина, що характеризується відношенням добутку рівноважних концентрацій дисоційованих іонів до рівноважної концентрації недисоційованих молекул. Ка не виникає для сильних електролітів.
Наведіть формули, необхідні для розрахунків.
a^2/1-a = K/n
де n — концентрація молекул, які дисоціюють, K — певний параметр, який залежить від тиску й температури.
При дуже малій концентрації ( n ->0), ступінь дисоціації a ->1, тобто усі молекули дисоційовані.
У слабких електролітах ступінь дисоціації менший ніж 3%, у електролітах середньої сили — 3%<α<30%, у сильних — α>30%.
Сформулюйте закон розведення Оствальда.
Зако́н розба́влення О́ствальда — співвідношення, що виражає залежність еквівалентної електропровідності розведеного розчину бінарного слабкого електроліту від концентрації розчину.
Як впливає довжина вуглеводневого радикалу в гомологічному ряді одноосновних кислот на їх ступінь та константу дисоціації?
Збільшення довжини вуглеводневого радикалу призводить до збільшення розчинності компонентів сировини
