
- •1. Энергетика химических реакций. Что изучает химическая термодинамика?
- •2. Перечислите, какие вы знаете системы. Как называются реакции по тепловым эффектам?
- •3. Дайте понятия процессам: изобарный, изохорный, изотермический.
- •4. Что такое энтальпия образования?
- •5. Что такое термохимическое уравнение? Некоторые особенности термохимических уравнений
- •6. Закон Гесса, следствие из закона Гесса. Постулат Лавуазье Лапласса. Формулировка закона
- •8. Как для реакций, в которых участвуют газообразные вещества, без таблиц можно определить изменение энтропии?
- •11. Химическое равновесие и константа равновесия. От каких факторов зависит константа равновесия? Уравнение, связывающее термодинамические параметры и константу равновесия?
- •12. Принцип Ле-Шателье. Куда сместится равновесие при повышении и понижении давления, температуры и концентрации? При введении катализатора?
- •13. Дать понятие скорости химических реакций. Какие простые реакции Вы знаете? Привести примеры. Мономолекулярные, бимолекулярные и тримолекулярные реакции. Привести примеры.
- •14. Какие сложные реакции Вы знаете? Привести примеры последовательных, параллельных и цепных реакций. Чем отличаются сложные реакции от простых.
- •15. Гомогенные и гетерогенные реакции. Какие вещества не входят в кинетическое уравнение?
- •16. Закон действующих масс, формулировка. Написать любую реакцию и ее кинетическое уравнение.
- •21. Что такое катализ? Что такое гомогенный и гетерогенный катализ? Привести пример расчета во сколько раз увеличится скорость реакции с катализатором и без катализатора?
- •22. Какие электрохимические процессы Вы знаете?
- •24. Рассмотреть работу гальванического элемента на примере элемента Даниэля Якоби. Принцип составления схемы гальванического элемента. Как рассчитывается эдс гальванического элемента.
- •25. Концентрационный гальванический элемент, принцип работы и расчет эдс. Привести пример.
- •26. Что такое электролиз? Какие бывают электроды? Электролиз расплава. Привести пример.
- •27. Электролиз растворов. Привести все случаи в зависимости от активности металлов.
- •28. Анодное окисление. Привести примеры. Электролиз с растворимым анодом. Закон Фарадея. Выход по току. Напряжение разложения. Перенапряжение.
- •29. Коррозия. Химическая и электрохимическая. Привести пример электрохимической коррозии. Что такое протекторная защита?
- •30. Растворы. Коэффициент растворимости. Способы выражения концентрации растворов.
- •31. Свойства растворов не электролитов. От чего зависят коллигативные свойства? Первый закон Рауля. Второй закон Рауля. Явление осмоса. Осмотическое давление.
- •32. Свойства растворов электролитов, характеристики растворов электролитов: степень электролитической диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- •33. Понятие изотонического коэффициента и формулы расчета коллигативных свойств для электролитов. Связь степени электролитической диссоциация и изотонического коэффициента.
- •34. Ионно-обменные реакции, полные и сокращенные. Направление протекания ионно-обменных реакций.
- •2 Примеры записи реакций ионного обмена
- •35. Электролитическая диссоциация воды, водородный показатель (рН). Расчет водородного показателя.
- •36. Гидролиз. Понятие и типы гидролиза. Степень гидролиза. Факторы, влияющие на степень гидролиза. Константа гидролиза.
- •37. Что такое произведение растворимости? Показать на примере.
28. Анодное окисление. Привести примеры. Электролиз с растворимым анодом. Закон Фарадея. Выход по току. Напряжение разложения. Перенапряжение.
Анодное окисление органических веществ, как правило, сопровождается образованием не одного продукта, а ряда веществ, причем бывает весьма затруднительно описать происходящие процессы одним простым стехиометрическим уравнением.
Электролиз растворов с растворимым анодом. Электролиз с растворимым анодом возможен тогда, когда металл легче отдает электроны, чем ионы Сl–, ОН– или молекулы воды. Например, на медном аноде в растворе хлорида или сульфата меди хлор или кислород не выделяются, а происходит переход в раствор ионов Сu2+ . Одновременно на катоде те же ионы разряжаются и осаждается металлическая медь. Таким образом, электролиз с растворимым анодом сводится к переносу меди с анода на катод.
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Эти два закона можно объединить в одном уравнении:
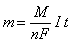 ,
,где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
Величина
 называется
электрохимическим эквивалентом
вещества.
называется
электрохимическим эквивалентом
вещества.
Это масса вещества, образовавшегося в результате электролиза при пропускании через раствор тока определенной силы тока в течение определенного времени. Рассчитывается с помощью закона Фарадея
Напряжение разложения электролита - минимальное напряжение между электродами, при котором начинает протекать электролиз; оно должно быть как минимум равно разности электродных потенциалов, т.е. потенциалов разрядки анионов ( на аноде) и катионов ( на катоде) из растворов электролитов
Часто реально необходимый потенциал разложения электролита оказывается больше теоретической величины. Эта разность называется перенапряжением η = ϕ(р) - ϕ(i) где ϕ(р) – равновесный потенциал, ϕ(i) – потенциал при протекание тока.
29. Коррозия. Химическая и электрохимическая. Привести пример электрохимической коррозии. Что такое протекторная защита?
Коррозия металлов – это процесс их самопроизвольного разрушения при взаимодействии с окружающей средой.
Химическая коррозия - это вид коррозионного разрушения металла, связанный с взаимодействием металла и коррозионной среды, при котором одновременно окисляется металл и происходит восстановление коррозионной среды.
Электрохимическая коррозия - самый распространенный вид коррозии, это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
Коррозионный элемент (короткозамкнутый гальванический элемент) схематично можно изобразить:
(–) А | коррозионная среда | К (+)
При работе коррозионных элементов, т.е. при электрохимической коррозии имеют место три основных процесса (рис. 10.7):
|
1.Анодный процесс – окисление металла, образование гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции:
Me(K) – neˉ ® Men+(p)
2. Процесс перетекания электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов и анионов в растворе.
3. Катодный процесс – приём электронов каким – либо окислителем окружающей коррозионной среды (какими – либо ионами или молекулами – деполяризаторами) на границе раздела фаз металл -коррозионная среда:
Ох + neˉ ® Red или Д + neˉ ® [Дneˉ].
Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой.
ПРИМЕР : электрохимическая коррозия железа в кислой среде.
В качестве конкретного примера рассмотрим коррозию железа в воздухе, содержащем сернистый газ SO2. На поверхности железа в данном случае образуется пленка сернистой кислоты вследствие взаимодействия сернистого газа с парами воды: SO2+Н2О = Н2SO3. Записываем схему микрогальванопар, работа которых в рассматриваемых условиях будет приводить к коррозии железа:
А - Fe| Н2SO3| катодный участок +К
Записываем уравнение электродных процессов, протекающих при работе таких микрогальванопар:
А: Fe = Fe2++2е‾ − окисление железа на анодных участках (коррозия железа)
К: 2Н+ + 2еˉ = Н2− восстановление ионов Н+на катодных участках.
Fe + 2Н+= Fe2++Н2 − суммарное уравнение электрохимической коррозии.
Протекторная защита - Уменьшение коррозии металла в электролите за счет гальванического соединения его с более анодным металлом.
