
- •Критерии оценок выполнения тестовых заданий:
- •Содержание
- •Химия и техника лабораторных работ.
- •А) уксусная сн3соон
- •А) основание
- •А) ковалентная
- •Г) водородная
- •Г) формулы не верны
- •А) раствор соляной кислоты
- •А) 70 % этиловым спиртом
- •Г) фотографирования объектов
- •А) рассмотрения очень удаленных объектов
- •А) подсчета количества эритроцитов
- •Эталоны ответов по химии и тлр.
- •Литература по химии и тлр
- •Дополнительная литература
- •Составители
- •Основы биохимии с методами клинических исследований.
- •Разделы
- •64. Биологическое значение переваривания белков заключается в том, что благодаря этому процессу происходит:
- •А) электрофорез
- •А) мочевой кислоты
- •Б) инфекционном гепатите
- •«Химия и обмен углеводов»
- •Нуклеиновые кислоты
- •Водно-минеральный обмен
- •«Витамины»
- •А) витамина а
- •А) витамина а
- •А) витамина а
- •«Ферменты»
- •В) гемолитической
- •«Гормоны»
- •«Гемостаз»
- •В) фибриноген
- •А) количество тромбоцитов
- •Б) витамин в
- •«Контроль качества лабораторных исследований»
- •В) прием медикаментов
- •А) условия хранения пробы
- •Эталоны ответов по биохимии
- •Список литературы по биохимии:
- •Составители
- •И методами исследования» разделы
- •I. Общая микробиология
- •II. Частная микробиология
- •Эталоны ответов по микробиологии
- •Литература по микробиологии Основная литература
- •Дополнительная литература
- •Составители
- •Методы клинических лабораторных исследований.
- •Разделы «Ликвор»
- •«Мокрота»
- •А) острого бронхита
- •«Исследование мочи»
- •Б) молочный
- •В) Ларионовой
- •«Санитарно – эпидемиологический режим»
- •«Желудочно-кишечный тракт»
- •Эталоны ответов по мки
- •Список литературы:
- •Составители
- •Литература по гистологии Основная литература
- •Дополнительная литература
- •Составители
- •Основы общей и частной патологии
- •Атрофия, гипертрофия, регенерация
- •Дистрофия. Некроз. Апоптоз.
- •Обмен веществ и энергии
- •Патология кровообращения
- •Воспаление
- •Водно-солевой обмен
- •Гипоксия
- •Опухолевый рост
- •Патология дыхательной системы
- •Патология сердечно-сосудистой системы
- •Патология пищеварительной системы
- •Патология выделительной системы
- •Патология эндокринной системы
- •Эталоны ответов по патологии
- •Литература по патологии
- •Составители
- •Медицинская паразитология
- •А) тело цилиндрической формы, длина 2–3 м, на сколексе присасывательные щели
- •В) блохи
- •Эталоны ответов по паразитологии
- •Литература по медицинской паразитологии
- •Составители
- •Первая медицинская помощь
- •Эталоны ответов к тестам по дисциплине "Первая медицинская помощь"
- •Составители
- •Медицина катастроф
- •Эталоны ответов по медицине катастроф
- •Литература по медицине катастроф:
- •Составители
- •Эталоны ответов по вич-инфекции
- •Литература по вич-инфекции
- •Составители
- •Основы организации и экономики здравоохранения и лабораторной службы Выберите 1 правильный ответ
- •Эталоны ответов по Основы организации и экономики здравоохранения и лабораторной службы
- •Литература по «Основам организации и экономики здравоохранения и лабораторной службы» Основная литература
- •Дополнительная литература
- •Составители
- •Гигиена с основами экологии Выберите 1 правильный ответ
- •Манипуляции по «Технике лабораторных работ и Технике безопасности».
- •Манипуляции по «Гигиене с основами экологии».
- •Манипуляции по «Методам клинических лабораторных исследований».
- •Манипуляции по «Микробиологии с основами эпидемиологии».
- •Манипуляции по Гистологии
- •Перечень манипуляций по основам биохимии с методами клинико-биохимических исследований
Химия и техника лабораторных работ.
Инструкция: выберите один правильный ответ.
-
Одноосновной кислотой является:
А) уксусная сн3соон
Б) серная Н2SО4
В) фосфорная Н3РО4
Г) угольная Н2СО3
-
Степень окисления центрального атома в соединении KMnO4 равна:
А) +1
Б) +4
В) +6
Г) +7
-
Атому хрома соответствует следующее заполнение электронных орбиталей:
А)…3d44s2
Б)…3d54s1
В)…3d64s0
Г)…3d34s24p1
-
Амфотерным является следующий гидрооксид:
А) NaOH
Б) Ca(OH)2
В) Cr(OH)2
Г) Cr(OH)3
-
Главное квантовое число обозначают следующим символом:
А) n
Б) l
В) m
Г) s
-
Вид гибридизации электронных орбиталей атома углерода в молекуле бензола С6Н6:
А) sp3
Б) sp
В) sp2
Г) нет гибридизации
-
Число валентных электронов у атома хлора равно:
А) 1
Б) 7
В) 6
Г) 3
-
Третья ступень и К диссоциации фосфорной кислоты соответствует следующей записи уравнения:
А)

Б)

В)

Г)

-
Кислотность среды при гидролизе соли Na2CO3 равна:
А) pH = 7
Б) pH 7
В) pH 7
Г) pH = 0
-
При гидролизе соли FeCl3 кислотность среды равна:
А) pH = 7
Б) pH 7
В) pH 7
Г) pH = 0
-
Ассиметрический атом углерода расположен в следующем соединении:
А) СН3-СН2-СООН

Б)

В)

Г)
-
Аминоуксусную кислоту СН3-СНNН2-СООН можно отнести к следующим соединениям:
А) основание
Б) кислота
В) соль
Г) амфотерное соединение
-
Степень окисления азота в катионе аммония равна:
А) +5
Б) +4
В) –3
Г) +2
-
Заряд комплексообразователя в соли Na2[Sn(OH)6] равен:
А) +1
Б) +2
В) +3
Г) +4
-
Для получения буферной смеси к раствору уксусной кислоты добавляют раствор вещества:
А) NH4Cl
Б) NaHCO3
В) CH3COONa
Г) H3PO4
-
Тип связи в молекуле MgCl2:
А) ковалентная
Б) ионная
В) донорно-акцепторная
Г) водородная
-
Фактор эквивалентности в молекуле СН3СООН равен:
А) 1
Б) 2
В) 3
Г) 4
-
Концентрация соли NaCl в физиологическом растворе равна:
А) 0,1 н
Б) 1,0 н
В) 0,15%
Г) 0,9%
-
Соль хрома, со степенью окисления Cr+6:
А) NaCrO2
Б) CrCl3
В) K2Cr2O7
Г) Cr(OH)2
-
Соединение с альдегидной функциональной группой:
А) CH3-COOH

Б)
В) CH3-CH2-OH
Г) C2H5-O-C2H5
-
Названию «Гексацианоферроат III калия» соответствует соль:
А) K3[Fe(CN)6]
Б) K4[Fe(CN)6]
В) Fe(CNS)3
Г) Fe(OH)2
-
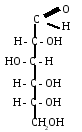
 Таутомерная
форма глюкозы, соответствующая названию
Д -глюко-пираноза:
Таутомерная
форма глюкозы, соответствующая названию
Д -глюко-пираноза:
В)
А)
Г)

Б)
-
Формула фруктозы в перечне углеводов:
А) В)

Б) Г)

-
В 1 моле вещества содержится частиц:
А) 6,02 х 1023
Б) 6,02 х 1024
В) 0,60 х 1023
Г) 0,60 х 1024
-
Мольный объем любого газа равен:
А) 22,4 л
Б) 0,224 л
В) 44,8 л
Г) 67,2 л
-
Для взвешивания навески, с точностью до первого знака после запятой, необходимы весы:
А) аналитические
Б) техно-химические
В) торсионные
Г) аптечные
-
На торсионных весах взвешивают с точностью до:
А) первого знака после запятой
Б) второго знака после запятой
В) третьего знака после запятой
Г) четвертого знака после запятой
-
Навески агрессивных химических веществ, например щелочей, взвешивают :
А) на фильтровальной бумаге
Б) на чашке весов
В) в стеклянном бюксе
Г) на всем перечисленном
-
Навеску вещества массой 200 мг можно выразить в следующих единицах массы:
А) 0,2 г
Б) 20 г
В) 2000 мкг
Г) 0,0002 мкг
-
Навеску вещества 500 мкг можно выразить в следующих единицах массы:
А) 0,5 мг
Б) 0,05 мг
В) 0,5 г
Г) 0,005 г
-
Правильный перевод единиц массы:
А) 0,1 г - 100 мг
Б) 0,1 г - 10 мг
В) 0,1 г - 10000 мкг
Г) 0,1 г - 0,01 кг
-
Химическая посуда считается чистой, если ее промыли:
А) водопроводной водой и мыльно-содовым раствором
Б) кислотой или хромовой смесью
В) дистиллированной водой
Г) всем перечисленным (последовательно)
-
Растворы молярной и нормальной концентрации готовят в химической посуде:
А) химическом стакане
Б) мерной колбе
В) колбе Эрленмейера
Г) цилиндре
-
Число молей вещества определяют по формуле -
 :
:
А) да
Б) нет
В) формула неправильная
Г) по этой формуле определяют число эквивалентов вещества
-
Объем 50 мл можно выразить в следующих единицах объема:
А) 0,05 л
Б) 0,005 л
В) 500 мкл
Г) 0,5 мкл
-
По формуле СМ =
 можно рассчитать и приготовить раствор
с концентрацией:
можно рассчитать и приготовить раствор
с концентрацией:
А) процентной
Б) нормальной
В) молярной
Г) моляльной
-
Навеска щелочи NaOH для приготовления раствора массой 500 г с 5 % концентрацией составляет:
А) 25 г
Б) 50 г
В) 10 г
Г) 100 г
-
Правильный перевод единиц объема:
А) 10 мл - 0,001 л
Б) 10 мл - 10000 мкл
В) 10 мл - 0,001 л
Г) 10 мл - 1000 мкл
-
Концентрацию раствора СМ - 500 ммоль\л можно выразить в следующих единицах концентрации:
А) 0,5 моль\л
Б) 0,05 моль\л
В) 50 моль\л
Г) 50000 мкмоль\л
-
При разбавлении кислот водой приливают растворы в следующем порядке:
А) кислоту к воде
Б) воду к кислоте
В) не имеет значения
Г) одновременно
-
Плотность растворов кислот и щелочей определяют:
А) урометром
Б) спиртометром
В) ареометром
Г) лактометром
-
Навеска KMnO4 (М - 158 г\м) для раствора с концентрацией
СМ - 0,1 моль\л и объемом 1 литр равна:
А) 15,800 г
Б) 0,158 г
В) 1,580 г
Г) 158 г
-
Раствор щелочи с - 5 % ( процентная концентрация - 5 %) готовят из:
А) расчетной навески и воды
Б) разбавлением 40 % - 50 % раствора водой по правилу креста
В) разбавлением 40 % - 50 % раствора водой, но после проверки плотности раствора ареометром
Г) все перечисленное верно
-
При титровании раствора HCl кислоты, раствором щелочи NaOH, расчеты ведут по формуле:
А)
![]()
Б)
![]()
В)
![]()
