
- •Глава 6 водяной пар и его свойства
- •§6.1. Основные понятия и определения
- •§ 6.2. Термодинамическая фазовая рТ – диаграмма. Уравнение клапейрона - клаузиуса
- •§ 6.6. Основные параметры воды и водяного пара
- •§ 6.7. Процессы изменения состояния водяного пара в pν -,ts - и is -диаграммах
- •§ 6.8. Влажный воздух. Абсолютная влажность, влагосодержание и относительная влажность воздуха
- •§ 6.9. Теплоемкость и энтальпия влажного воздуха
- •Глава 7 термодинамика газового потока
- •§ 7.1. Уравнение энергии газового потока
- •§7.2. Располагаемая работа газового потока
- •§ 7.3. Основные закономерности соплового и диффузорного адиабатного течения газа
- •§ 7.4. Истечение идеального газа из суживающихся сопел
- •§ 7.5 Истечение идеального газа из комбинированного сопла лаваля
- •§ 7.6. Расчет истечения реальных газов и паров
- •7.7 Адиабатное дросселирование
- •§ 7.8. Дроссельный эффект (эффект джоуля-томсона)
- •§ 7.9. Газовые смеси
- •Глава 8 компрессорные машины
- •§ 8.1. Мощность привода и коэффициенты полезного действия компрессора
- •§ 8.2. Многоступенчатый компрессор
- •Глава 9 циклы поршневых двигателей внутреннего сгорания
- •§ 9.1. Краткие исторические сведения
- •§ 9.2. Классификация двс
- •§ 9.3. Циклы двс с подводом теплоты при постоянном объёме
- •§9.4. Циклы двс с подводом теплоты при постоянном давлении
- •§ 9.5. Циклы двс со смешанным подводом теплоты
- •Глава 10 циклы газотурбинных установок и реактивных двигателей
- •§ 10.1. Циклы гту с подводом теплоты при постоянном давлении
- •§10.2. Циклы гту с подводом теплоты при постоянном объеме
- •§ 10.3. Методы повышения термического кпд гту
- •§ 10.4. Циклы реактивных двигателей. Жидкостные реактивные двигатели
- •10.5. Воздушно-реактивные двигатели
- •§ 10.6. Пульсирующий воздушно-реактивный двигатель
- •§ 10.7. Компрессорные воздушно-реактивные двигатели
- •§ 10.8. Термодинамические методы сравнения циклов тепловых двигателей
- •Глава 11 циклы паросиловых установок мгд-генератор
- •§ 11.1. Цикл карно во влажном паре и его недостатки
- •§ 11.2. Основной цикл псу-цикл ренкина
- •§ 11.3. Полезная работа цикла ренкина. Работа питательного насоса
- •§ 11.4. Термический кпд цикла ренкина
- •§ 11.5. Влияние параметров пара на термический кпд цикла ренкина
- •§ 11.6. Промежуточный перегрев пара
- •§ 11.7. Регенеративный цикл паросиловой установки
- •§ 11.8. Бинарные (двойные) циклы
- •§ 11.9. Циклы парогазовых установок
- •§ 11.10. Циклы атомных электростанций
- •§ 11.11. Циклы электрических станций с магнитогидродинамическими генераторами
- •Глава 12 циклы холодильных машин
- •§12.1. Цикл воздушной холодильной установки
- •§ 12.2. Цикл паровой компрессорной холодильной установки
- •§ 12.3. Цикл холодильной установки абсорбционного типа
- •§ 12.4. Цикл пароэжекторной холодильной установки
- •§ 12.5. Тепловой насос
- •§ 12.6. Вихревая труба
- •§ 12.7. Термотрансформаторы
- •Глава 13 элементы химической термодинамики
- •§ 13.1. Классификация химических реакций
- •§13.2. Первый закон термодинамики в применении к химическим реакциям
- •§ 13.3. Тепловой эффект реакции
- •§ 13.4. Теплоты химических реакций
- •§ 13.5. Закон гесса
- •§13.6..Закон кирхгофа
- •§ 13.7. Применение второго закона термодинамики к химическим процессам
- •§ 13.8. Изохорно-изотермический и изобарно-изотермический потенциалы
- •§13.9. Максимальная работа реакции
- •§ 13.10. Уравнения максимальной работы (уравнения гиббса-гельмгольца)
- •13.11. Химический потенциал
- •§ 13.12. Условия равновесия в изолированных однородных (гомогенных) системах
- •§ 13.13. Условия равновесия в изолированных неоднородных (гетерогенных) системах и химических реакциях
- •§13.14. Равновесие в химических реакциях
- •§ 13.15. Закон действующих масс. Константы равновесия химических реакций
- •§ 13.16. Термическая диссоциация. Степень диссоциации
- •§ 13.17. Зависимость между константой равновесия и степенью диссоциации
- •§ 13.18. Зависимость между константой равновесия и максимальной работой. Уравнение изотермы химической реакции
- •§ 13.19. Влияние температуры реакции на химическое равновесие. Принцип ле-шателье
- •§ 13.20, Тепловая теорема нернста. Третье начало термодинамики
- •§ 13.21. Третье начало термодинамики в формулировке планка (постулат планка)
§ 7.6. Расчет истечения реальных газов и паров
В этом случае для расчета преимущественно используется is - диаграмма (см. § 6.5). Из уравнения энергии газового потока для адиабатного истечения (dq=0) при dlT=0 получаем уравнение (7.4), после интегрирования которого находим
![]()
При
![]()
![]()
По этой формуле рассчитывается скорость истечения реального газа с помощью is -диаграммы.
Расход газа определяется по формулам.
Если
![]() то
то
![]()
Если β<βкр, то
![]()
Критическая скорость
![]()
может быть приближенно найдена по формуле для идеального газа, т.е. приняв
![]()
(k=1,3 для перегретого пара, k=1,035+0,1x для влажного пара со степенью сухости х).
При необратимом истечении действительная скорость w будет меньше теоретической wT, т.к. в этом случае имеют место потери кинетической энергии на трение газа как внутри потока, так и на стенках канала.
Потеря кинетической энергии будет
![]()
где ξ = 1 - φ2 - коэффициент потерь энергии; φ= w / wT - коэффициент скорости.
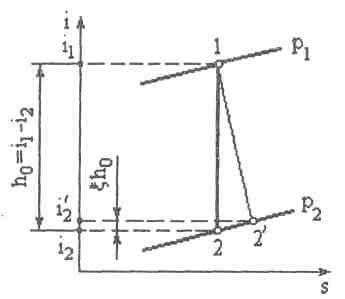
Рие.7.3
Отсюда
![]() или w=φwT,
где
или w=φwT,
где
![]()
На рис. 7.3 процесс 1-2 является теоретическим процессом адиабатного обратимого истечения пара или газа от давления р1 до давления р2; 1-2' - действительный необратимый процесс истечения. Значение i2' находится по
формуле
![]() ,
, ![]()
Эта формула позволяет по значению ξ находить конечную точку 2' действительного процесса истечения. Определив i2 , по этой формуле находим i'2. Проведя изоэнтальпу i'2=const до пересечения с изобарой р2, находим конечное состояние процесса истечения - точку 2'.
7.7 Адиабатное дросселирование
Адиабатным дросселированием (или мятием) называется необратимый переход рабочего тела от высокого давления р1 к низкому давлению р2 без теплообмена. Дросселирование, близкое к адиабатному, имеет место на практике при прохождении жидкости или газа через вентили, задвижки и измерительные диафрагмы (рис. 7.4).
Рис. 7.4
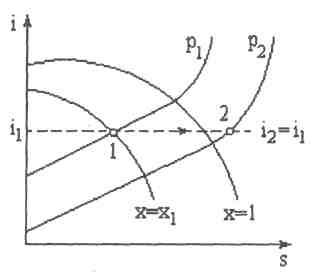
Рис. 7.5
Из уравнения энергии газового потока для адиабатного дросселирования (dq=0) при условии dlT = 0 после интегрирования получаем соотношение (7.5). Если сечения канала до (сечение 1-1) и после (сечение 2-2) расширения одинаковы, то
![]()
Тогда
![]()
и, следовательно, энтальпия газа в результате дросселирования не изменяется. Последнее уравнение является уравнением процесса дросселирования. Оно позволяет с помощью is- диаграммы по состоянию рабочего тела до дросселирования находить его состояние после дросселирования так, как это показано на рис. 7.5
§ 7.8. Дроссельный эффект (эффект джоуля-томсона)
Дроссельный эффект был обнаружен Джоулем и Томсоном опытным путем в 1852 г. [Опытами было установлено, что в результате дросселирования изменяется температура рабочего тела. Это явление было названо эффектом Джоуля-Томсона. Изменение температуры при дросселировании связано с тем, что в каждом реальном газе действуют силы притяжения и отталкивания между молекулами. При дросселировании происходит расширение газа, сопровождающееся увеличением расстояния между ними. Все это приводит к уменьшению внутренней энергии рабочего тела, связанному с затратой работы, что, в свою очередь, приводит к изменению температуры.
Температура идеального газа в результате дросселирования не изменяется, и эффект Джоуля-Томсона в данном случае равен нулю. Таким образом, изменение температуры реального газа при дросселировании определяется величиной отклонения свойств реального газа от идеального, что связано с действием межмолекулярных сил.
Различают дифференциальный и интегральный температурные дроссель-эффекты. При дифференциальном эффекте Джоуля-Томсона температура изменяется на бесконечно малую величину, а при интегральном - на конечную величину. Если давление газа уменьшается на бесконечно малую величину dp, то происходит бесконечно малое изменение температуры, т.е. dTi = aidpi или
![]() (7.18)
(7.18)
Величина ai называется дифференциальным температурным эффектом Джоуля-Томсона. Значение а, можно определить из уравнения (см. § 5.48)
![]()
Учитывая, что при дросселировании нет изменения энтальпии (di = 0), получим
![]()
Отсюда
![]() (7.19)
(7.19)
Дроссельный эффект может быть положительным, отрицательным и равным нулю. Положительный дроссель-эффект имеет место в случае, когда при дроселировании температура газа понижается. Отрицательный - когда повышается. В случае неизменности температуры при дросселировании наблюдается нулевой эффект Джоуля-Томсона. Состояние реального газа при дросселировании, когда дроссельный эффект равен нулю, называется точкой инверсии. В этой точке происходит смена знака температурного эффекта. Если температура газа перёд дросселированием меньше температуры инверсии, то газ при дросселировании охлаждается, если больше - то нагревается.
Для нахождения условий, при которых происходит изменение температуры газа или она остается неизменной, необходимо проанализировать уравнение (7.19), записанное в виде
![]() (7.20)
(7.20)
При дросселировании dp < 0, так как давление газа всегда уменьшается. Теплоемкость ср - величина положительная. Отсюда следует, что знак dT
зависит
от знака выражения
![]() и
всегда ему противоположен.
и
всегда ему противоположен.
Тогда
при
![]() ,
при
,
при
![]() ,
,
при T(dv / dT)p - v = 0 dT = 0. Случай, когда dT = 0 можно использовать для
получения температуры инверсии Тнн.
T(dv/dT)р -v = 0, Tнн=v/(dv/dT)р .
Последнее выражение называется уравнением кривой инверсии (кривой, на которой дроссельный эффект равен нулю).
Интегральный эффект Джоуля-Томсона определяется в результате интегрирования уравнения (7.20)
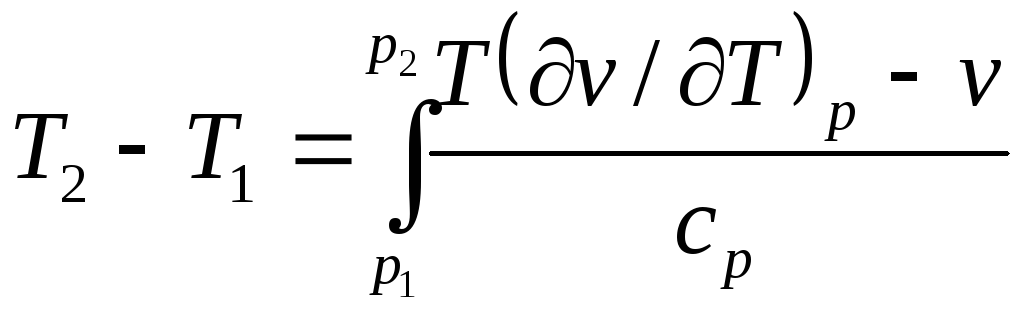 .
.
