
4
.pdf
5.4.5. Прямой расчет истинных профилей с использованием аналитической аппроксимации данных измерений и ядер детекторов и теоремы о свертке
Полное прямое аналитическое решение проблемы усреднения дозы по объему приведено в работе [31]. Предпосылкой создания такого метода стало то, что точное измерение полей излучения в областях высокого градиента требует использования бесконечно малого детектора с идеальной чувствительностью по энергии и направлению падения излучения, что не является возможным на данный момент.
Метод основывается на использовании теоремы о свертке, однако предлагает использование преобразования Фурье в аналитическом виде, а не в дискретном, поскольку применение последнего зачастую приводит к численным ошибкам, зависящим от предельной частоты исходной функции, шага измерения, уровня шума, точности данных и компьютерной обработки. К тому же, профили содержат области высокого градиента и в процессе свертки они играют роль высокочастотного фильтра, усиливая шумы. В связи с этим, если дискретное преобразование не сделано достаточно аккуратно, то результаты могут быть плачевными. Однако аналитическое решение требует представления результатов измерения в функциональном виде, которое зачастую трудно обобщить на все возможные случаи. В работе [31] используется следующая функция подгонки, представляющая результаты измерений в аналитическом виде:
где |
( ) = |
|
|
erf |
( ) |
|
( |
) |
+erf |
( ) |
|
( |
; |
) |
+ , (19.15) |
||||
|
|
|
|
||||||||||||||||
|
|
||||||||||||||||||
|
|
|
|
|
erf(– |
) = / |
|
|
|
|
|
|
|
|
|||||
L – ширина поля, |
σ |
|
|
|
|
|
|
|
|
σ |
= 1,4892 |
(19.16) |
|||||||
|
параметр формы, |
определяет |
|||||||||||||||||
полутень при с=0, |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
причем с – уровень дозы в хвосте профиля. |
|||||||||||||||
Изначально такая функия использовалась для моделирования полей электронов и может быть достаточно успешно применена для малых фотонных полей. Результаты использования такой функции подгонки приведены на рис.19.21.
681
Преимуществом использования такой функции также является то, что она может быть записана в следующем виде:
( ) = |
|
exp[−π( − ) /σ ] + , (19.17) |
|
где H(x) – хорошо известная функция Хевисайда (19.9).
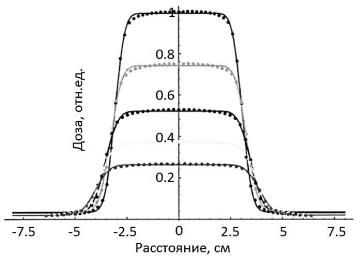
Рис.19.21. Измеренные и аппроксимированные с помощью функции (19.15) профили пучка фотонов энергии 6 МВ для размера поля 4х4 см, РИП=100 см, глубины в воде 16, 94, 172, 250 и 328 мм. Для измерений использовалась камера PTW31002 (0.125 см3, 6.9 мм диаметр) с шагом съемки 2 мм [31]
Таким образом, применяя преобразование Фурье, и с учетом теоремы о свертке получим:
где |
Ф[ |
( |
)] = Ф |
|
|
Ф[ ( )]+ Ф[ ], |
; |
(19.18) |
|
|
|||||||||
|
Ф[ |
( |
)] = (̅) = |
/ |
( ) |
(19.20) |
|||
|
|
|
|
|
|
|
|
|
(19.19) |
Следовательно |
( ) = |
|
̅ . |
. |
) |
(19.21) |
|
||||||
|
( ) = |
( ) ( )+ ̅( |
|
|
||
|
|
682 |
|
|
|
|

Преобразования Фурье функций Гаусса, Хевисайда и константы хорошо известны:
Ф |
|
|
|
= sinπ |
/π ; |
(19.23) |
|
[ |
( )] |
δ( ). |
; |
(19.22) |
|||
(19.24) |
|||||||
Ф[ |
] = |
|
|
||||
СледовательноФ |
, |
|
|
= e |
|
||
( |
) = |
|
|
+ δ( ). |
(19.25) |
||
|
|
||||||
Согласно теореме о свертке, истинный профиль может быть найден по формуле (19.8). Для нахождения аналитического решения представим ядро детектора в форме гауссиана, аналогично
(19.13):
( ) = |
|
/ . |
(19.26) |
|
Тогда, если P(x) – истинный профиль, F(x) – измеренный, а K(x)
– ядро детектора, получим:
( ) = |
( |
) |
= |
sinπ |
|
|
|
|
+ |
|
δ( |
) |
= |
|
||||
( |
) |
π |
|
|
|
|
|
|
|
(19.27) |
||||||||
= |
|
|
|
|
|
( |
) |
+ |
|
( ) |
; |
|
|
|
||||
|
|
|
( |
|
|
|
|
|||||||||||
|
|
|
|
|
) = Ф |
[ |
( )] = |
|
|
|
]. |
|
(19.28) |
|||||
= Ф |
|
|
|
|
|
|
|
|
|
+ Ф |
[ |
|
|
( ) |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Обратное преобразование Фурье второго члена равняется 1, и таким образом, конечное выражение для аналитического представления истинного профиля имеет вид:
( ) = Ф |
|
e |
+ . (19.29) |
|
Как видно, функция в скобках практически совпадает с результатом преобразования Фурье функции измеренного профиля (27), вплоть до σ. Тогда, произведя замену
σ = σ − σ , |
(19.30) |
получим следующее аналитическое представление истинного профиля пучка:
683

( ) = |
|
erf |
( ) |
|
( |
) |
+erf |
( ) |
|
( |
) |
+ . (19.31) |
|
|
|
||||||||||
|
Таким образом, задача нахождения истинного профиля из данных измерений легко решается аналитически. Как только ядро детектора, которым производили измерения, известно в требуемом виде, а для полученного профиля найдена функция подгонки, то истинный профиль может быть вычислен практически мгновенно, с использованием (19.30) и (19.31). На рис. 19.22 представлена функция подгонки для профиля пучка 4х4 см на глубине 2 см в воде, при РИП=100 см, измеренного камерой диаметром 6.9 мм, а также его истинный профиль. В соответствии с полученными данными, указанная камера искусственно уширяет профиль примерно на 2 мм.
Рис. 19.22. Измеренный профиль (пунктирная линия) и истинный профиль (сплошная линия) [31]
Контрольные вопросы
1.В чем состоит процедура поверки СИ?
2.Что такое калибровка СИ?
3.Что представляют собой стандартные условия для определе-
ния поглощенной дозы в воде с помощью ионизационной камеры (ИК) для γ-излучения 60Со и высокоэнергетического тормозного излучения?
684
4.Что представляют собой стандартные условия для определения поглощенной дозы в воде с помощью ионизационной камеры (ИК) для рентгеновского излучения средних энергий?
5.Что представляют собой стандартные условия для определения поглощенной дозы в воде с помощью ионизационной камеры (ИК) для пучков электронов и протонов?
6.Какие требования предъявляются к материалам твердых фантомов, используемым в качестве заменителей воды?
7.Как проводится пересчет глубин при применении твердых фантомов?
8.Что такое качество пучка и как оно определяется для пучков фотонов, электронов и протонов?
9.Какие относительные стандартные неопределенности в настоящее время существуют при определении значения погло-
щенной дозы в воде на опорной глубине при калибровке ИК в пучке γ-излучения 60Со?
10.Какие особенности имеют относительные измерения поглощенной дозы в воде?
11.Какие детекторы и фантомы применяются для относительных дозовых измерений?
12.Какие характеристики пучков определяются обычно в относительных измерениях?
13.Какие поля в лучевой терапии считаются малыми полями?
14.В каких случаях полутени от противоположных краев поля перекрываются?
15.Как влияет положение шторок основного коллиматора на дозовый профиль поля, создаваемого "вторичным" коллиматором"?
16.Как влияют размеры детектора на зависимость фактора выхода от диаметра конического коллиматора?
17.Какие детекторы являются предпочтительными при измерении дозового профиля малых полей?
18.Какие подходы применяются в настоящее время для реконструкции истинных дозовых профилей?
19.Как производится гелевая дозиметрия пространственных дозовых распределений и в чем ее преимущества и недостатки?
20.Как определяется ядро денситометра?
685
21. Опишите метод прямого расчета истинных профилей с использованием аналитической аппроксимации данных измерений, ядер детекторов.
Список литературы
1.Ратнер Т.Г., Лютова Н.А. Клиническая дозиметрия. Теоретические основы и практическое применение.М.: Изд-во "Весть". 2006.
2.Костылев В.А., Наркевич Б.Я. Медицинская физика.М.: Издво "Медицина", 2008.
3.Handbook of radiotherapy physics. Theory and practice / Ed. by P. Mayles, A. Nahum, J.-C. Rosenwald. New York, London: Taylor & Francis. 2007.
4.Климанов В.А. Радиобиологическое и дозиметрическое планирование лучевой и радионуклидной терапии. Часть 1 и 2 // М.: Изд. НИЯУ МИФИ. 2011.
5.Методические указания. Государственная система обеспечения единства измерений. Поглощенные дозы фотонного (1 – 50 МэВ) и электронного (5 – 50 МэВ) излучений в лучевой терапии. Методы определения // РД 50-691-89. 1989.
6.IAEA. Absorbed dose determination in external beam radiotherapy: An international Code of Practice for dosimetry based on standard dose to water // Technical Report Series no. 398. IAEA, Vienna. 2000.
7.МАГАТЕ. Определение поглощенной дозы при дистанционной лучевой терапии: Международные практические рекомендации по дозиметрии, основанные на эталонах единицы поглощенной дозы в воде. Серия технических докладов № 398 // МАГАТЕ. Перевод на русск. 2004.
8.Лебеденко И.М., Крылова Т.А. Методическое пособие по определению поглощенной дозы при дистанционной лучевой терапии для энергий фотонного (1 – 50 МэВ) и электронного излучений (4 – 50 МэВ) в соответствии с протоколом Международного Агентства по Атомной Энергии TRS 398 // РОНЦ им. Н.Н. Блохина РАМН. М.: 2011.
9.AAPM (American association of physics in medicine). Task Group 20: Protocol for Heavy Charged-particle Therapy Beam Dosimetry// Rep. 16, AAPM, New York: 1986.
686
10.Vynckier S., Bonnett D.E., Jones D.T.L. Code of practice for clinical proton dosimetry // Radiother. Oncol. V. 20. 1991. P. 53–63.
11.Vynckier S., Bonnett D.E., Jones D.T.L. Supplement to the code of practice for clinical proton dosimetry // Radiother. Oncol. V. 32. 1994. P. 174–179.
12.ICRU (International commission on radiation units and measurements). Clinical proton dosimetry, Part I: Beam Production, Beam Delivery and Measurement of Absorbed Dose // Rep. 59. ICRU. Bethesda. MD. 1999.
13.Small fields: Nonequilibrium radiation dosimetry. I.J.Das, G. X. Ding, A. Ahnesjo // Med. Phys. V. 35. 2008. P. 206 – 215.
14.Extrafocal radiation: A unified approach to the prediction of beam penumbra and output factors for megavoltage x-ray beams. M. B. Sharpe, D. A. Jaffray, J. J. Battista, P. Munro // Med. Phys. V. 22. 1995. P. 2065–2074
15.Ding G. X., Duggan D. M., Coffey C. W. Commissioning stereotactic radiosurgery beams using both experimental and theoretical methods // Phys. Med. Biol. V. 51. 2006. P. 2549–2566.
16.Li X. A., Soubra M., Szanto J., Gerig L. H. Lateral electron equilibrium and electron contamination in measurements of head-scatter factors using miniphantoms and brass caps // Med. Phys. V. 22. 1995. P. 1167–1170.
17.Choice of Radiation Detector in Dosimetry of Stereotactic Radi- osurgery–Radiotherapy. I. J. Das, M. B. Downes, . Kassaee, Z. Tochner // J.O.Radioth. V. 3. 2000. P. 177 – 186.
18.Laub W. U., Wong T. The volume effect of detectors in the dosimetry of small fields used in IMRT // Med. Phys. V. 30. 2003. P. 341–347.
19.Rikner G., Grusell E. General specifications for silicon semiconductors for use in radiation dosimetry // Phys. Med. Biol. V. 32. 1987. P. 1109–1117.
20.Алмазные детекторы в относительной дозиметрии фотонных, электронных и протонных радиационных полей. В.С. Хрунов,
С.С.Мартынов, С.М.Ватницкий et al // Radiat.Prot.Dosimetry. V.33. 1990. P. 155-157.
21.Horowitz Y. S. The theoretical and microdosimetric basis of thermoluminescence and applications to dosimetry // Phys. Med. Biol. V. 26.1981. P. 765–824
687
22.TG-69: Radiographic film for megavoltage beam dosimetry. S. Pai, I. J. Das, J. F. Dempsey et al // Med. Phys. V. 34. 2007. P. 2228– 2258.
23.Ramani R., Russell S., O’Brien P. F. Clinical dosimetry using MOSFETs // Int. J. Radiat. Oncol. Biol. Phys. V. 37. 1997. P. 959–964.
24.Three-dimensional visualization and measurement of conformal dose distributions using magnetic resonance imaging of BANG polymer gel dosimeters. G. S. Ibbott, M. J. Maryanski, P. Eastman et al // Int. J. Radiat. Oncol. Biol. Phys. V. 38. 1997. P. 1097–1103.
25.Pappas E. et al. Experimental determination of the effect of detector size on profile measurements in narrow photon beams // Med. Phys. V. 33. 2006. P.3700-3710.
26.Application of a radiophotoluminescent glass plate dosimeter for small field dosimetry. F. Aaki, T. Ishidoya, T. Ikegami et al // Med. Phys. V. 32. 2005. P. 1548–1554.
27.Chen F., Graeff C. F. O., Baff O. K-band EPR dosimetry: Small field beam profile determination with miniature alanine dosimeter // Appl. Radiat. Isot. V. 62. 2005. P. 267–271.
28.Laub W.U., Wong T. The volume effect of detectors in the dosimetry of small fields used in IMRT // Med. Phys. V. 30. 2003. P.341347.
29.Garcia-Vicente F. et al. Experimental determination of the convolution kernel for the study of the spatial response of a detector // Med. Phys. V. 25. 1998. P.202-207.
30.Higgins P. et al. Deconvolution of detector size effect for small field measurement // Med. Phys. V. 22. 1995. P.1663-1666.
31.Garcia-Vicente F. et al. Exact analytical solution of the convolution integral equation for a general profile fitting function and Gaussian detector kernel // Phys.Med.Biol. V. 45. 2000. P. 645-650.
688
Глава 20. Дозиметрия в ядерной медицине
Отличительная особенность ядерной медицины заключается во введении внутрь организма пациентов радиофармпрепаратов (РФП) или радиотрассеров в некапсулированном виде, испускающих ионизирующее излучение внутри тела человека. Вопросами определения доз при внутреннем облучении занимается специальный раздел радиационной дозиметрии, называемый "Дозиметрия инкорпорированных радионуклидов" или "Внутренняя дозиметрия". По этой причине дозиметрия в ядерной медицине является, в основном, внутренней дозиметрией.
Экспериментальное определение доз внутреннего облучения, как отмечается в главе 17, представляет чрезвычайно трудную проблему, поэтому значения доз находятся преимущественно расчетным путем. Основные принципы и методы дозиметрии инкорпорированных излучений применительно к проблемам радиационной безопасности были описаны в главе 17. В настоящей главе рассматриваются особенности применения расчетных методов внутренней дозиметрии в области ядерной медицины.
Учитывая широкое использование формул для расчета доз, ученые, работающие в области дозиметрии, привели в настоящее время эти формулы к очень простым формам, удобным для практического применения в ядерной медицине. Однако простота формул, облегчая их применение, часто маскирует основные принципы и допущения, принятые при их получении. Кроме того, сейчас имеется несколько систем расчета доз при внутреннем облучении, причем каждая со своим набором формул. Такая ситуация может быть причиной их некорректного применения. Поэтому целью настоящей главы является также раскрытие основных концепций, реализуемых при расчетах в рамках этих систем.
1.Историческая справка
Вистории развития радиационной дозиметрии в ядерной медицине важнейшую роль сыграли (и продолжают играть) две общеизвестные международные организации: Международная комиссия по радиологической защите ((МКРЗ) или англ. Internal commission
689
on radiological protection (ICRP)) и Комитет по медицинской внут-
ренней радиационной дозе ((МВРД) или англ. Medical internal radiation dose (MIRD) committee Американского общества ядерной медицины. Целевая установка деятельности обеих организаций является разной. ICRP акцентировала свою работу на радиологической защите работников, систематически облучаемых ионизирующим излучением в силу своей профессиональной деятельности. ICRP опубликовала большое количество подробной информации по поглощенным дозам для разных радиоактивных медицинских препаратов (РМП) или, как чаще сейчас называют, радиоактивным фармпрепаратам (РФП) и рекомендации по радиационной безопасности в медицине. С другой стороны, комитет MIRD сосредоточился исключительно на пациентах ядерной медицины (ЯМ).
ICRP была основана в 1928 г. как комитет, связанный с Международным конгрессом по радиологии, и в том же году опубликовал свой первый отчет. Публикации и рекомендации этой организации легли в основу большинства программ и законодательств, регулирующих на государственном уровне деятельность, связанную с использованием ионизирующих излучений. В настоящее время ICRP организационно состоит из Основных комиссий и постоянно действующих Комитетов. Комитет 1 занимается радиационными эффеками, комиссия 2 – дозовыми пределами, комиссия 3 – радиационной безопасностью и защитой в медицине и комитет 2 – применением и внедрением рекомендаций ICRP. Для анализа отдельных проблем и подготовки проектов рекомендаций ICRP создает проблемные и рабочие группы. За последние несколько десятилетий ICRP выпустила много публикаций, оказавших очень сильное влияние на развитие радиационной дозиметрии ЯМ. К таким важнейшим публикациям в первую очередь относятся Публикации номер
26 (1977, [1]), 53 (1987, [2]), 60 (1991, [3]), 103 (2007, [4]), которые ввели понятия и предложили методы определения эффективного дозового эквивалента и его производных, эффективной дозы, суммировали и обобщили данные для определения риска от детерминистских и стохастических эффектов, вызываемых ионизирующим излучением. В Публикации 30 (1979, [5]) были представлены дозиметрические модели кости и костного мозга, желудочно-кишечного тракта, системы дыхания. Впоследствии эти модели были пере-
смотрены в Публикациях 66 (1994, [6]), 70 (1995, [7]) и 100 (2006, 690
