
- •Предисловие
- •§ 1. Гидрология как наука
- •§ 2. Основные понятия
- •§ 1. Вода как вещество, её молекулярная структура и изотопный состав
- •§ 2. Химические свойства воды
- •§3. Физические свойства воды и географические следствия
- •§ 4 Агрегатное состояние воды и фазовые переходы
- •§5. Малоизученные свойства воды
- •§ 1. Фундаментальные законы физики и их использование при изучении водных объектов
- •§2. Водный баланс
- •§3. Тепловой баланс
- •Круговорот воды в природе и водные ресурсы Земли
- •§ 1. Происхождение воды на Земле
- •§ 2. Изменение количества воды на Земле
- •§ 3. Круговорот воды в природе
- •§ 4. Круговорот содержащихся в воде веществ
- •§5. Водные ресурсы Земли
- •§1. Происхождение ледников и их распространение на земном шаре. Снеговая линия.
- •§2. Типы ледников
- •§3. Образование и строение ледников
- •§4. Питание ледника
- •§5. Режим и движение ледников
- •§6. Влияние на природную среду и практическое значение ледников
- •§ 1. Происхождение и распространение подземных вод на Земле
- •§2. Виды воды в порах горных пород и грунтов
- •§3. Классификации подземных вод
- •§4. Воды зоны аэрации
- •§5. Воды зоны насыщения. Грунтовые воды
- •§6. Движение подземных вод
- •§7. Режим подземных вод
- •§8. Влияние подземных вод на природную среду и их практическое значение
- •§1. Реки и их распространение на земном шаре
- •§2. Типы рек
- •§3. Морфология и морфометрия реки и ее бассейна
- •§4. Питание рек
- •§5. Водный режим рек
- •§6. Речной сток
- •§7. Движение воды в реках
- •§8. Движение речных наносов
- •§9. Термический и ледовый режим рек
- •§10. Гидрохимический режим рек
- •§11. Устья рек
- •§12. Хозяйственное значение рек и антропогенное влияние на реки
- •§13. Реки Крыма и Украины
- •§ 1. Происхождение озер и их распространение на земном шаре
- •§ 2. Типы озер
- •§ 3. Морфология и морфометрия озер
- •§ 4. Водный баланс озер
- •§ 5. Водный режим озера
- •§ 6. Термический режим озера
- •§ 7. Ледовый режим озер
- •§ 8. Гидрохимические характеристики озер
- •§ 9. Гидробиологические характеристики озер
- •§ 10. Донные отложения в озерах
- •§ 11. Влияние озер на природную среду и их практическое значение
- •§ 1. Назначение водохранилищ и их размещение на земном шаре
- •§ 2. Типы водохранилищ
- •§ 3. Морфометрические характеристики водохранилищ
- •§ 4. Гидрологический режим водохранилищ
- •§ 5. Формирование берегов и заиление
- •§ 6. Влияние водохранилищ на природную среду
- •§ 7. Водохранилища Крыма и Украины
- •§ 1. Происхождение болот и их распространение на земном шаре
- •§ 2. Типы болот
- •§ 3. Морфология, строение и гидрография торфяных болот
- •§ 4. Развитие и гидрологический режим болот
- •§ 5. Мелиорация болот и их практическое значение
- •§ 1. Океаны и их распространенность на земном шаре
- •§ 2. Моря и их классификация
- •§ 3. Заливы и проливы
- •§ 4. Дно Мирового океана
- •§ 5. Донные отложения океана
- •§ 1. Солевой состав и генезис вод океана
- •§ 2. Соленость морской воды и ее распределение в океане
- •§ 3. Термические особенности вод Мирового океана
- •§ 4. Плотность вод и ее распределение в океане
- •§1. Льдообразование в море
- •§ 2. Физические свойства морского льда
- •§ 3. Классификация морских льдов
- •§ 4. Ледовитость океанов и морей
- •§ 5. Движение морских льдов
- •§ 1. Волнение
- •§ 2. Волны зыби и элементы волны
- •§ 3. Ветровые волны
- •§ 4. Волны цунами
- •§ 5. Сейши
- •§ 6. Внутренние волны
- •§ 1. Приливы
- •§ 2. Элементы приливной волны
- •§ 3. Приливообразующая сила
- •§ 4. Деформации приливной волны у берега
- •§ 5. Котидальные карты приливов
- •§ 1. Происхождение морских течений и их классификация
- •§ 2. Теория ветровых течений
- •§ 3. Плотностные течения
- •§ 4. Циркуляция вод в Мировом океане
- •§1. Уровень моря. Нуль глубин
- •§2. Изменения уровня моря
- •§ 3. Водные массы океана
- •§1. Биологические ресурсы
- •§2. Минеральные ресурсы
- •§3. Энергетические ресурсы
- •§1. Антропогенное загрязнение Мирового океана
- •§2. Экологические проблемы Азовского моря
- •§3. Экологические проблемы Черного моря
- •§4. Прогнозы экологических изменений Мирового океана
- •Оглавление
- •95007, Симферополь, пр. Вернадского 4
§ 2. Основные понятия
Вода – одно из самых распространенных на Земле химических соединений, это один из самых важных минералов на Земле.
Без воды невозможно существование биосферы, жизни и человека на Земле.
Велика роль воды в формировании географической оболочки Земли, облика поверхности нашей планеты. Вода – важный компонент ландшафтов.
Она является активным геологическим и географическим фактором. Она служит носителем механической и тепловой энергии, транспортирует вещества, совершает работу, играет важную роль в обмене веществом и энергией между геосферами, определяет многие особенности климатических, метеорологических и геоморфологических процессов на Земле. Вода для человека является необходимым средством жизнедеятельности и основой современного производства.
Вода - бесценное богатство человечества и поэтому водные ресурсы люди должны бережно и экономно использовать и охранять.
Водные объекты – это скопление природных вод на земной поверхности или в верхних слоях земной коры, обладающих определенным гидрологическим режимом. Выделяют три группы водных объектов:
1. Водотоки с поступательным движением воды в направлении уклона – реки, ручьи, каналы.
2. Водоемы в понижениях с замедленным движением воды – океаны, моря, озера, пруды, водохранилища, болота.
3. Особые водные объекты – ледники и подземные воды.
Совокупность водотоков и водоемов в пределах определенной территории образуют гидрографическую сеть.
гидросфера – это слабо прерывистая водная оболочка земного шара, расположенная на поверхности земной коры и в её толще, представляющая совокупность океанов, морей и водных объектов суши (рек, озёр, болот, подземных вод), включая снежный покров и ледники. Гидросфера не включает атмосферную влагу и воду в живых организмах.
гидрологические процессы – это совокупность физических, химических и биологических процессов, определяющих закономерности формирования гидрологического состояния и режима водного объекта.
гидрологические характеристики водного объекта могут быть следующими: уровень воды, скорость течения, расход воды, температура воды, форма и размеры водного объекта, расход наносов и другие.
гидрологическое состояние водного объекта определяется совокупностью гидрологических характеристик данного водного объекта в данном месте и в данный момент времени. Это состояние подобно погоде подвержено пространственно-временным изменениям.
гидрологический режим - это совокупность закономерно повторяющихся изменений гидрологического состояния водного объекта. Аналогом режима можно считать климат в атмосфере.
водные ресурсы – это запасы всех видов воды на Земле, исключая воду, связанную с горными породами и биосферой. Для практических нужд необходимы в основном пресные воды. Общий объём водных ресурсов на земном шаре составляет около 1388 млн. км3.
|
Свойства природных вод |
§ 1. Вода как вещество, её молекулярная структура и изотопный состав
Вода – это простейшее устойчивое химическое вещество-соединение водорода с кислородом. Это оксид водорода Н2О. В чистом виде вода – вещество бесцветное, без вкуса и запаха (11,19 % весовых Н и 88,81 % О2, молекулярный вес 18,0160). Молекула воды несимметрична: в виде равнобедренного треугольника с двумя ядрами водорода в основании и ядом кислорода в вершине

О

 __----
__----



 0,97х10-8
см
0,97х10-8
см

 1050
1050





Н 1,53 х 10-8 см Н
Рис. 1. Строение молекулы воды
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода и тем самым приобретает отрицательный заряд. В свою очередь, оба атома водорода лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь (рис. 1).
Полярное строение воды и возникающее в воде электрическое поле обуславливает большую диэлектрическую проницательность (показывает во сколько раз силы взаимодействия электрозарядов уменьшаются в воде по сравнению с вакуумом), которая предопределяет большую её ионизирующую способность, т.е. способность расщеплять молекулы других веществ, что обуславливает сильное растворяющее действие воды. Поэтому вода – сильный растворитель.
В зависимости от агрегатного состояния организация молекул может быть различной (рис. 2):
1) В кристаллах льда молекулы воды составляют гексагональную систему с прочными водородными связями. Эта структура рыхлая, ажурная, чем и объясняется резкое снижение плотности льда, в результате чего он плавает на воде. Во льду преобладают молекулярные агрегаты тригидроли – (Н2О)3.
2) В жидкой воде обычна тетраэдрическая структура, при которой 4 молекулы по вершинам тетраэдра окружают пятую. Здесь преобладают дигидроли – (Н2О)2.
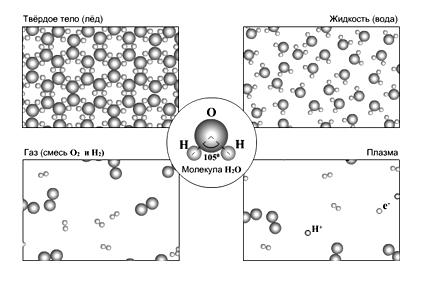
Рис. 2. Изменение структуры воды в зависимости от агрегатного состояния
3) Водяной пар состоит из мономерных одиночных молекул воды (гидролей), не имеющих водородных связей.
4) В состоянии плазмы происходит разрушение мономерных молекул с появлением отрицательно и положительно заряженных частиц.
Вода же имеет наибольшую плотность не при температуре плавления, а при +40 С. В ней одновременно присутствуют разные типы агрегатов молекул.
По изотопному составу Н2О – это вода, образованная двумя атомами водорода с атомным весом 1 (называется протий) и атомом кислорода с атомным весом 16. Однако наличие тяжелых изотопов водорода (2Н, 3Н), природных и искусственных изотопов кислорода (14О-19О) допускает комбинации из нескольких десятков изотопных типов воды.
Д2О – это тяжёлая вода, образованная двумя атомами изотопа водорода дейтерия с атомным весом 2 (протон-нейтрон-электрон).
Т2О – сверхтяжёлая вода, образованная двумя атомами изотопа водорода трития с атомным весом 3 (протон, 2 нейтрона, электрон).
Д и Т – сами по себе уникальные изотопы, так как их атомные веса не на доли процента, а в 2 и 3 раза отличаются от атомного веса стабильного протия. Поэтому дейтериевая (тяжёлая) и тритиевая (сверхтяжёлая) вода, выделенная в чистом виде, также отличается рядом особых свойств (табл. 1)
Это определяет и биологические свойства тяжёлой воды. Доказано, что в ней задерживается размножение микробов, не прорастают семена растений, погибают некоторые простейшие, происходят необратимые изменения у высших организмов. То есть в высокой концентрации тяжёлая вода – это «мёртвая вода» наших сказок… Но имеются и другие данные. Д2О стимулирует рост некоторых плесневых грибов.
В настоящее время содержание Д2О в природных водах составляет примерно 145 атомов на 1 млн. атомов Н2О в реках и озёрах и 180 атомов в морях. В ходе геологического времени происходило прогрессивное увеличение содержания Д2О за счёт испарения, вымораживания, поступления из космоса.
Таблица 1
Свойства воды разного изотопного состава
|
Свойство |
Н2О |
Д2О |
Т2О |
|
Атомный вес |
18 |
20 |
22 |
|
Температура кипения, 0С |
100,0 |
101,41 |
101,60 |
|
Температура замерзания, 0С |
0,00 |
+3,80 |
9,00 |
|
Плотность, г/см3 |
1,00 |
1,100 |
1,330 |
|
Температура максимальной плотности |
4,00 |
11,2 |
- |
|
Растворимость |
1,00 |
0,90 |
0,85 |
Т2О естественного происхождения на Земле всего 20 кг. Основная масса трития образуется при термоядерных реакциях.
