
- •II. Алгоритм процесса кибернетического моделирования.
- •Структурная схема системы «Черный ящик».
- •III. Одночастевая математическая модель фармакокинетики
- •II. Двухчастевая модель непрерывной инфузии в кровь
- •Порядок выполнения работы
- •5. Сочетание 1-го и 2-го способов.
- •6. Сочетание 3-го и 2-го способов.
Лабораторная работа №26
Исследование математической модели
фармакокинетики
Студент должен знать: определение и виды моделей, преимущества моделей, этапы моделирования, модели фармакокинетики, смысл дифференциальных уравнений, переменных и коэффициентов, входящих в них.
Студент должен уметь: определять ход кинетики по начальным условиям и индивидуальным коэффициентам, находить оптимальный режим введения препарата.
Краткая теория
I. Основные понятия и определение моделирования.
Моделирование эффективно используется в биологии и медицине для изучения биологических объектов на всех уровнях от субклеточного до сообщества живых организмов.
Модель – искусственно созданная система, которая отображает или воспроизводит объект исследования по структуре или функции и способна замещать его. (Пример: аппарат искусственного кровообращения, искусственная почка, протезы и т.д.)
Модель создается для исследования одного или группы свойств биологического объекта, все остальные стороны функционирования биосистемы при этом не являются существенными и в моделях, как правило, не учитываются. Поэтому модель всегда упрощает и в некоторой степени искажает оригинал. Сходство, аналогия между моделью и оригиналом могут быть чисто внешними, могут касаться внутренней структуры внешне совсем не похожих объектов. Например, механические колебания тела человека, обусловленные сердечной деятельностью и электрические колебания в колебательном контуре, состоящем из индуктивности, емкости и сопротивления математически описываются одинаково.
В медицине и биологии модели делят на три группы:
Биологические модели. К ним относятся живые организмы, биосистемы, ткани, культуры клеток. На них проводятся испытания химических препаратов, физических и психических воздействий, облучение, исследование космических факторов и т.д.
Физические (аналоговые) модели – поведение которых аналогично поведению системы – оригинала. К ним относятся технические системы, заменяющие органы или системы живого организма, например аппараты искусственного дыхания, кардиостимуляторы и т.п., механические или электрические устройства.
Кибернетические модели, имеющие отличную от прототипа физическую природу, но допускающие одинаковое с прототипом описание процессов управления и связи. Они реализуются на электронных устройствах, в основном на ЭВМ. Для создания кибернетической модели используют закономерности, выявленные при экспериментальном изучении объекта моделирования. Преимуществами этого вида моделей является точное количественное описание моделируемых процессов, значительно более высокие возможности исследования сложных объектов, быстрота и точность анализа различных вариантов моделей.
Моделирование значительно облегчает проведение анализов процессов в оригинале и позволяет изучать их при таких условиях, которые очень трудно или невозможно организовать при эксперименте или в клинике на натуральном объекте.
II. Алгоритм процесса кибернетического моделирования.
На первом этапе определяется цель, пути и средства моделирования по предварительным данным, осуществляются необходимые исходные эксперименты.
Второй этап - составление модели. В исследуемом объекте выделяются существенные связи, явления, составляется формальная математическая модель, затем осуществляется ее техническая реализация на ЭВМ.
Третий этап - исследование и корректировка модели. Модель исследуется при различных условиях, проверяется правильность построения, осуществляется поиск новых свойств, эффектов, не полученных в опытах с оригиналом. Проверяется соответствие полученных свойств модели системе - оригиналу, проводится уточнение модели.
Четвертый этап - перенос знаний. Полученные данные используются для раскрытия свойств системы- оригинала в практических целях.
Эвристическое моделирование используется при изучении труднодоступных для непосредственного исследования объектов. При этом изучаемый объект обычно считают системой, о внутренней структуре и алгоритме функционирования который ничего не известно, а известны лишь входные и выходные сигналы. Такая система в кибернетике называется «черный ящик» (рис 1.1).

Рис 1.1
Структурная схема системы «Черный ящик».
X(t) – входные сигналы.
Y(t) – помехи.
V(t) – внешние условия.
Z(x,y, V,t) – выходные сигналы системы.
Для построения эвристической модели сигнала задаются рабочей гипотезой о возможном алгоритме функционирования этого «черного ящика», способы переработки им информации, его предположительной внутренней структуре. Затем составляются математические уравнения, по которым строится электронная или физическая модель и проверяется ее адекватность оригиналу.
III. Одночастевая математическая модель фармакокинетики
а) Метод однократного введения препарата в орган

Рис. 1
Терапевтический эффект препарата зависит от его концентрации и времени пребывания в действующей концентрации. Изменение концентрации dL препарата в органе пропорционально его концентрации L и промежутку времени, за который происходит изменение:
dL= – BLdt, (1)
где B - коэффициент скорости выведения препарата из органа. Решение этого уравнения имеет вид убывающей экспоненты L(t) = L0exp(–Bt) (L0 – начальная концентрация), график которой представлен кривой 1 на рис.2.
б) Метод непрерывного введения препарата
Дифференциальное уравнение такой системы (см.рис.1):
dL/dt = QN – BL, (2)
где QN - скорость введения препарата.
Решение уравнения (2) имеет вид возрастающей экспоненты (кривая 2, рис.2).

Рис. 2
Сочетанием двух методов введения, а) и б) меняя Q, можно достичь постоянной концентрации препарата в органе (кривая 3, рис.2), что часто необходимо на практике. Данные рис. 2 подтверждены экспериментально.
II. Двухчастевая модель непрерывной инфузии в кровь
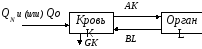
Рис. 3
В этой структурной схеме:
QN - скорость непрерывного введения препарата в кровь,
К - концентрация препарата в крови,
А - коэффициент скорости выведения препарата из крови в орган,
B - коэффициент скорости выведения препарата из органа в кровь,
G - коэффициент удаления препарата из крови почками.
Скорость изменения концентрации препарата в крови равна:
dK/dt = – AK+BL – GK+QN. (3)
Скорость изменения препарата в органе:
dL/dt = AK – BL. (4)
Система уравнений (3)-(4) решается наиболее просто численным методом Эйлера. Величину скорости изменения концентрации препарата в органе приближенно можно вычислить как отношение приращения L(ti+h)-L(ti) концентрации препарата к промежутку времени h, за который оно произошло (см. рис.2):
dL(ti)/dt (L(ti+h) – L(ti))/h. (5)
В пределе при h-->0 выражение (5) в точности выполняется. Найдем из уравнения (5):
L(ti+h) L (ti)+h(dL(ti)/dt). (6)
Подставив уравнение (4) в (6) получим:
L(ti+h) L(ti)+h[AK(ti)– BL(ti)] (7)
Аналогично выводится формула для вычислений K(ti+h):
K(ti+h) K(ti)+h[QN+BL(ti)-AK(ti)-GK(ti)] (8)
По формулам (7) и (8) и осуществляется расчет. Как видно из уравнений (7) и (8), для подсчета L(ti+h), K(ti+h) необходимо знать предыдущие значения L(ti), K(ti) и задаться шагом по оси времени h. При различных сочетаниях значений индивидуальных коэффициентов A, B, G решение системы уравнений (7) и (8) приводит к различным вариантам зависимости L(t), K(t) при разных значениях Q0 и QN.
Рассмотренные модели фармакокинетики позволяют рассчитать и подобрать оптимальную схему дозирования лекарственного препарата. Оптимальной является схема, удовлетворяющая следующим условиям:
1. Концентрация препарата в крови или органе больного после первичного приема должна достаточно быстро достигать уровня, не ниже эффективного, терапевтического значения Стер, а между приемами препарата, не стать меньше этой величины.
2. Максимальная концентрация препарата в крови или органе не должна быть больше предельной концентрации Сдоп.
Таким образом, оптимальная концентрация препарата должна быть в пределах:
Стер < Сопт < Сдоп .
Если С< Стер, то препарат мало активен или не активен, если С > Сдоп, то будет высока вероятность возникновения токсических явлений.
