
- •5. Развернутое содержание лекций Механика
- •Законы Ньютона
- •2. Силы в механике. Закон всемирного тяготения. Сила тяжести. Вес. Сила упругости. Закон Гука. Сила трения.
- •1. Импульс тела и импульс силы. Теорема об изменении импульса системы материальных точек. Центр масс системы материальных точек. Закон сохранения импульса
- •2. Момент импульса материальной точки и момент силы. Теорема об изменении момента импульса смт. Закон сохранения момента импульса.
- •3. Работа. Кинетическая и потенциальная энергия. Теорема об изменении механической энергии смт. Закон сохранения механической энергии.
- •1. Гармонические колебания. Линейный гармонический осциллятор. Затухающие гармонические колебания. Вынужденные гармонические колебания. Резонанс. Физический и математический маятники.
- •2. Механические волны. Поперечные и продольные волны. Уравнение бегущей волны. Двойная периодичность волны. Луч, волновая поверхность, волновой фронт
- •1. Термодинамические параметры. Нулевое начало термодинамики. Температура. Температурные шкалы. Термометры.
- •2. Экспериментальные законы изопроцессов. Уравнение состояния идеального газа.
- •4. Адиабатный процесс. Уравнения Пуассона. Расчет работы в адиабатном процессе.
- •3. Число степеней свободы молекулы. Расчет внутренней энергии иг. Расчет теплоемкости иг.
1. Термодинамические параметры. Нулевое начало термодинамики. Температура. Температурные шкалы. Термометры.
Термодинамическая
система
(ТС) это макроскопическая система,
изучаемая в термодинамике. Термодинамическими
параметрами
называют характеристики системы, которые
можно измерить приборами. Внутренние
параметры (давление p,
температура T)
определяются самой ТС, внешние (объем
V)
– внешними телами. Определенный набор
параметров ТС характеризует ее состояние.
Состояние ТС называют термодинамическим
равновесием,
если не происходит изменений ни в
системе, ни во внешних телах.
Термодинамическое равновесие предполагает
и механическое равновесие в системе.
Если нарушено хотя бы одно из этих
условий, то состояние ТС неравновесное.
Стационарным
состоянием
называют состояние ТС, при котором
изменений в системе не происходит, но
изменяется состояние внешних тел.
Процесс это изменение состояния ТС, или
иначе, изменение определенных систем.
На практике используют температуру
кипения воды при нормальном атмосферном
давлении и температуру таяния льда при
том же условии. В шкале Цельсия их
принимают за 100˚С и 0˚С. Соответственно,
сотая часть этого интервала равна 1˚С.
На основе других, прежде всего,
теоретических соображений, в термодинамике
создана термодинамическая параметров
ТС. Процесс называют обратимым,
если для него существует обратный
процесс, в результате которого ТС
возвращается в исходной состояние, и
состояние внешних тел не изменяется.
Обратимым процессом был бы процесс,
состоящий из последовательных равновесных
состояний. Реальные процессы всегда
необратимы, но чем медленнее процесс,
тем он ближе к обратимому. ТС называют
изолированной,
если она не обменивается энергией с
внешними телами. Нулевое
начало термодинамики:
Изолированная ТС с течением времени
переходит в состояние термодинамического
равновесия.
Мерой равновесия является температура.
Температура это единственный параметр,
значения которого в состоянии
термодинамического равновесии системы
одинаковы во всех точках системы. Для
измерения температуры строят температурные
шкалы. Основой их являются реперные
точки – температуры определенных
состояний шкала температур (шкала
Кельвина). В ней отсчет ведут от самой
низкой температуры в природе, принятой
за нуль (0К). 0К= –273˚С, 1˚С=1К. Значения
температур в этих двух шкалах связаны
формулой: T(K)=t(˚C)+273.
Температуру измеряют термометрами. В
них используют зависимость некоторых
параметров от температуры, например, в
жидкостных термометрах зависимость
объема от температуры. (![]() §41;
§41;
![]() 41)
41)
2. Экспериментальные законы изопроцессов. Уравнение состояния идеального газа.
Состояние
газа характеризуется тремя параметрами:
давление p,
объем V,
температура Т. Изопроцессом
называют процесс, когда один из параметров
остается постоянным. Экспериментальным
путем над атмосферным воздухом были
открыты законы изопроцессов для газа.
В изотермическом процессе (Т=сonst)
объем и давление связаны законом
Бойля-Мариотта (PV=const).
В изобарическом процессе (p=const)
объем и температура связаны законом
Гей-Люссака (![]() ).
В изохорическом процессе (V=const)
давление и температура связаны законом
Шарля (
).
В изохорическом процессе (V=const)
давление и температура связаны законом
Шарля (![]() ).
Реальные газы подчиняются этим законам
неточно. Идеальным
газом (ИГ)
называют газ, который точно подчиняется
законам изопроцессов. Графики, изображающие
зависимость одного параметра от другого
в изопроцессе, называют, соответственно,
изотермой, изобарой, изохорой. Термическим
уравнением состояния называют уравнение,
связывающие параметры p,V,T.
Законы изопроцессов ИГ позволяют вывести
уравнение состояния ИГ, которое называют
уравнением состояния Клапейрона (
).
Реальные газы подчиняются этим законам
неточно. Идеальным
газом (ИГ)
называют газ, который точно подчиняется
законам изопроцессов. Графики, изображающие
зависимость одного параметра от другого
в изопроцессе, называют, соответственно,
изотермой, изобарой, изохорой. Термическим
уравнением состояния называют уравнение,
связывающие параметры p,V,T.
Законы изопроцессов ИГ позволяют вывести
уравнение состояния ИГ, которое называют
уравнением состояния Клапейрона (![]() ).
Из опыта известен объем одного моля
газа при нормальных условиях. Поэтому
можно рассчитать сonst
для моля. Расчет дает
).
Из опыта известен объем одного моля
газа при нормальных условиях. Поэтому
можно рассчитать сonst
для моля. Расчет дает
![]() .
Для газа с произвольной массой m
получим уравнение Менделеева-Клапейрона:
PV=
.
Для газа с произвольной массой m
получим уравнение Менделеева-Клапейрона:
PV=![]() .
Для смеси ИГ выполняется закон
Дальтона:
P=
.
Для смеси ИГ выполняется закон
Дальтона:
P=![]() .
Давление
смеси ИГ равно сумме
парциальных
давлений.
Парциальным давлением газа, входящего
в смесь называют давление, которое
создал бы газ, если бы он один занимал
объем смеси. Уравнение состояния смеси
идеальных газов: PV=
.
Давление
смеси ИГ равно сумме
парциальных
давлений.
Парциальным давлением газа, входящего
в смесь называют давление, которое
создал бы газ, если бы он один занимал
объем смеси. Уравнение состояния смеси
идеальных газов: PV=![]()
![]() .
(
.
(![]() §§41,42;
§§41,42;
![]() §41)
§41)
3.
Внутренняя энергия системы и способы
ее изменения: процессы работы и
теплообмена. Первое начало термодинамики.
Теплоемкость системы. Расчет работы и
количества теплоты при изменении
температуры системы. Уравнение Майера.
Опыт
показывает, что тела обладают внутренней
энергией. При действии сил трения
механическая энергия уменьшается, а
тела нагреваются. И, наоборот, нагретый
газ или пар могут совершить работу,
увеличивая механическую энергию тел.
В термодинамике внутренней
энергией ТС
называют часть полной внутренней энергии
системы, которая изменяется в тепловых
процессах. Из опыта следует, что внутренняя
энергия зависит от температуры и внешних
параметров, прежде всего, объема: U
= U(T,V).
У не очень плотных газов, а значит и у
идеального газа внутренняя энергия от
объема не зависит. Внутренняя энергия
является функцией состояния, она
однозначно характеризует состояние
ТС. Изменение внутренней энергии не
зависит от вида процесса. Внутренняя
энергия ТС изменяется в процессах
работы и теплообмена.
Мерой изменения внутренней энергии в
процессе работы является величина
работы:
![]() ,
где
,
где![]() - величина работы ТС. Если
- величина работы ТС. Если
![]() - одновременная с работой системы, работа
внешних тел, которая не изменяет
механического состояния ТС, то
- одновременная с работой системы, работа
внешних тел, которая не изменяет
механического состояния ТС, то
![]() =
=![]() .
Теплообменом
называют процесс
обмена ТС и
внешних тел внутренней энергией без
совершения работы.
Мерой изменения внутренней энергии при
теплообмене является количество
теплоты (Q).
По определению,
.
Теплообменом
называют процесс
обмена ТС и
внешних тел внутренней энергией без
совершения работы.
Мерой изменения внутренней энергии при
теплообмене является количество
теплоты (Q).
По определению,
![]() .
Если ТС одновременно участвует и в
процессе работы и в процессе теплообмена,
то
.
Если ТС одновременно участвует и в
процессе работы и в процессе теплообмена,
то
![]() .
Это закон сохранения энергии с учетом
тепловых процессов. Его называют первым
началом термодинамики. Работа в
термодинамике связана с изменением
объема ТС и вычисляется по формуле:
.
Это закон сохранения энергии с учетом
тепловых процессов. Его называют первым
началом термодинамики. Работа в
термодинамике связана с изменением
объема ТС и вычисляется по формуле: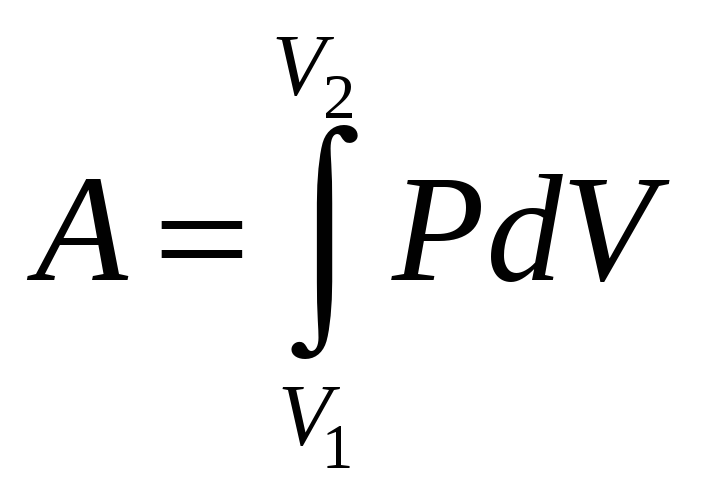 .
Количество теплоты и величина работы
являются характеристиками процессов.
Количества теплоты при изменении
температуры рассчитывают по формуле
.
Количество теплоты и величина работы
являются характеристиками процессов.
Количества теплоты при изменении
температуры рассчитывают по формуле
![]() ,
где
,
где
![]() - удельная теплоемкость ТС. Теплоемкость
системы как и количество теплоты зависит
от вида процесса. Его обозначают индексом
(х). Теплоемкость одного моля (молярная
теплоемкость) равна
- удельная теплоемкость ТС. Теплоемкость
системы как и количество теплоты зависит
от вида процесса. Его обозначают индексом
(х). Теплоемкость одного моля (молярная
теплоемкость) равна
![]() ,
где
,
где
![]() - масса моля. Связь молярных изобарической
и изохорической теплоемкостей выражается
уравнением Майера:
- масса моля. Связь молярных изобарической
и изохорической теплоемкостей выражается
уравнением Майера:
![]() .
.
