
- •5. Развернутое содержание лекций Механика
- •Законы Ньютона
- •2. Силы в механике. Закон всемирного тяготения. Сила тяжести. Вес. Сила упругости. Закон Гука. Сила трения.
- •1. Импульс тела и импульс силы. Теорема об изменении импульса системы материальных точек. Центр масс системы материальных точек. Закон сохранения импульса
- •2. Момент импульса материальной точки и момент силы. Теорема об изменении момента импульса смт. Закон сохранения момента импульса.
- •3. Работа. Кинетическая и потенциальная энергия. Теорема об изменении механической энергии смт. Закон сохранения механической энергии.
- •1. Гармонические колебания. Линейный гармонический осциллятор. Затухающие гармонические колебания. Вынужденные гармонические колебания. Резонанс. Физический и математический маятники.
- •2. Механические волны. Поперечные и продольные волны. Уравнение бегущей волны. Двойная периодичность волны. Луч, волновая поверхность, волновой фронт
- •1. Термодинамические параметры. Нулевое начало термодинамики. Температура. Температурные шкалы. Термометры.
- •2. Экспериментальные законы изопроцессов. Уравнение состояния идеального газа.
- •4. Адиабатный процесс. Уравнения Пуассона. Расчет работы в адиабатном процессе.
- •3. Число степеней свободы молекулы. Расчет внутренней энергии иг. Расчет теплоемкости иг.
4. Адиабатный процесс. Уравнения Пуассона. Расчет работы в адиабатном процессе.
Адиабатный
процессом называют процесс, происходящий
без теплообмена (Q=0).
Для адиабатного процесса
![]() .
Для ИГ можно установить связь между
параметрами в адиабатном процессе. Эти
формулы называют уравнениями Пуассона
(
.
Для ИГ можно установить связь между
параметрами в адиабатном процессе. Эти
формулы называют уравнениями Пуассона
(![]() ).
Соответствующие этим формулам графики
зависимостей одного параметра от
другого, называют адиабатами. Здесь
).
Соответствующие этим формулам графики
зависимостей одного параметра от
другого, называют адиабатами. Здесь
![]() - постоянная адиабаты. Расчет работы в
адиабатном процессе приводит к формуле:
- постоянная адиабаты. Расчет работы в
адиабатном процессе приводит к формуле:
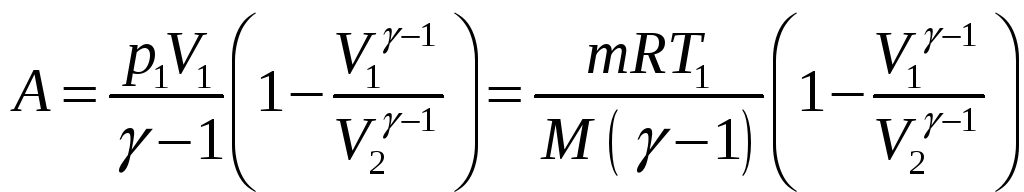 . Величину работы можно найти через
связь ее с изменением внутренней
энергии:
. Величину работы можно найти через
связь ее с изменением внутренней
энергии:![]() .
Если использовать эти две формулы работы
и второе уравнение Пуассона, то можно
получить формулу изохорической удельной
теплоемкости:
.
Если использовать эти две формулы работы
и второе уравнение Пуассона, то можно
получить формулу изохорической удельной
теплоемкости:
![]() .
(
.
(![]() 50-55;
50-55;
![]() §41)
§41)
Лк. 7
Циклы. Прямые и обратные, обратимые и необратимые циклы. Тепловые двигатели. Коэффициент полезного действия прямого цикла (теплового двигателя). Цикл Карно. Расчет КПД цикла Карно для ИГ.
Циклом
называют
замкнутый процесс. Если цикл состоит
из обратимых процессов, он будет
обратимым.
Если хотя бы один процесс в цикле
необратимый, то и весь цикл необратимый.
Графически, например, в осях P,V
цикл изображается замкнутой линией –
диаграммой цикла. У прямого
цикла диаграмма закручена по часовой
стрелке, у обратного
– против часовой стрелки. Изменение
внутренней энергии за цикл равно нулю,
поэтому
![]() .
Обозначим через
.
Обозначим через
![]() >0
- количество теплоты, полученное ТС за
цикл,
>0
- количество теплоты, полученное ТС за
цикл,
![]() >0
- отданное ТС за цикл. Поэтому
>0
- отданное ТС за цикл. Поэтому
![]() –
–![]() .
Для прямого цикла вводят коэффициент
полезного действия (КПД):
.
Для прямого цикла вводят коэффициент
полезного действия (КПД):
![]() .
Тепловыми
двигателями
называют устройства, в которых в
результате прямых циклов над рабочим
веществом его внутренняя энергия
превращается в механическую. Все тепловые
двигатели включают три блока: 1)
нагреватель,
от которого рабочее вещество получает
количество теплоты
.
Тепловыми
двигателями
называют устройства, в которых в
результате прямых циклов над рабочим
веществом его внутренняя энергия
превращается в механическую. Все тепловые
двигатели включают три блока: 1)
нагреватель,
от которого рабочее вещество получает
количество теплоты
![]() ;
2) преобразователь,
в котором в процессе циклов часть
полученной от нагревателя внутренней
энергии превращается в механическую;
3) холодильник,
которому рабочее вещество отдает
количество теплоты
;
2) преобразователь,
в котором в процессе циклов часть
полученной от нагревателя внутренней
энергии превращается в механическую;
3) холодильник,
которому рабочее вещество отдает
количество теплоты
![]() .
К.П.Д. теплового двигателя рассчитывается,
как для прямого цикла. Основные типы
тепловых двигателей: паровые, двигатели
внутреннего сгорания, паровые и газовые
турбины, реактивные двигатели. Цикл
Карно включает
четыре процесса: 1) (1
.
К.П.Д. теплового двигателя рассчитывается,
как для прямого цикла. Основные типы
тепловых двигателей: паровые, двигатели
внутреннего сгорания, паровые и газовые
турбины, реактивные двигатели. Цикл
Карно включает
четыре процесса: 1) (1![]() 2)
- изотермическое расширение при
температуре
2)
- изотермическое расширение при
температуре
![]() ;
2)
;
2)
![]() - адиабатное расширение; 3)
- адиабатное расширение; 3)
![]() - изотермическое сжатие при температуре
- изотермическое сжатие при температуре
![]() <
<
![]() ;
4)
;
4)
![]() - адиабатное сжатие до первоначального
состояния. Расчет КПД цикла Карно дает
формулу
- адиабатное сжатие до первоначального
состояния. Расчет КПД цикла Карно дает
формулу
![]() .
(
.
(![]() §§56,59;
§§56,59;
![]() §§71)
§§71)
Лк 8. Второе начало термодинамики. Теорема Карно-Клаузиуса и ее следствие для КПД цикла Карно. Приведенная теплота. Энтропия. Аналитическое выражение второго начала термодинамики.
Второе
начало термодинамики имеет несколько
формулировок, основанных на обобщении
опытных фактов. Формулировка Клаузиуса:
невозможен
самопроизвольный переход количества
теплоты от тела менее нагретого к телу
более нагретому.
Формулировка Кельвина: невозможно
создать периодически действующее
устройство, единственным результатом
функционирования которого было бы
совершение работы за
счет охлаждения
одного тела.
Формулировка Планка: невозможно
создать
тепловой
двигатель с КПД равным единице.
Такой двигатель называют вечным
двигателем второго рода. Все формулировки
эквивалентны. Эквивалентность второй
и третьей очевидна, так как при
![]()
![]() .
На основе второго начала термодинамики
доказывается теорема Карно-Клаузиуса:
КПД тепловых
двигателей, работающих между одними и
теми же нагревателем и холодильником,
одинаковы, если двигатели обратимые. У
необратимых двигателей КПД меньше, чем
у обратимых.
Из теоремы следует, что для циклов Карно
справедливо неравенство:
.
На основе второго начала термодинамики
доказывается теорема Карно-Клаузиуса:
КПД тепловых
двигателей, работающих между одними и
теми же нагревателем и холодильником,
одинаковы, если двигатели обратимые. У
необратимых двигателей КПД меньше, чем
у обратимых.
Из теоремы следует, что для циклов Карно
справедливо неравенство:
![]() .
Отсюда можно придти к неравенству:
.
Отсюда можно придти к неравенству:
![]() .
Иначе говоря, сумма приведенных теплот
для циклов Карно меньше нуля при
необратимом цикле и равна нулю при
обратимом. Произвольный цикл можно
разбить на циклы Карно. При этом для
суммы по всем этим циклам получим
.
Иначе говоря, сумма приведенных теплот
для циклов Карно меньше нуля при
необратимом цикле и равна нулю при
обратимом. Произвольный цикл можно
разбить на циклы Карно. При этом для
суммы по всем этим циклам получим
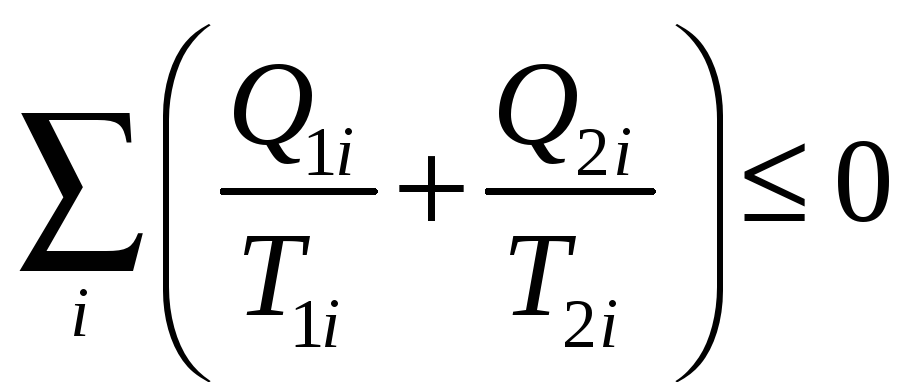 .
При устремлении количества этих циклов
к бесконечности, их совокупность будет
полностью эквивалентно данному циклу,
и для произвольного цикла будем иметь
интегральное неравенство:
.
При устремлении количества этих циклов
к бесконечности, их совокупность будет
полностью эквивалентно данному циклу,
и для произвольного цикла будем иметь
интегральное неравенство:
![]() .
Для обратимого цикла имеем равенство:
.
Для обратимого цикла имеем равенство:
![]() .
Это значит, что величина
.
Это значит, что величина
![]() является дифференциалом некоторой
функции состояния. Ее называют энтропией
(S),
является дифференциалом некоторой
функции состояния. Ее называют энтропией
(S),
![]() .
Отсюда
.
Отсюда
![]() .
Эта формула позволяет рассчитать
энтропию ТС. Для ИГ получим
.
Эта формула позволяет рассчитать
энтропию ТС. Для ИГ получим
![]() ..
Используя энтропию, можно получить
формулу, которая выражает аналитически
второе начало термодинамики :
..
Используя энтропию, можно получить
формулу, которая выражает аналитически
второе начало термодинамики :
![]() .
Если ТС изолирована, то процессы,
происходящие с ней будут адиабатными
(
.
Если ТС изолирована, то процессы,
происходящие с ней будут адиабатными
(![]() ).
Для такой ТС справедливо неравенство:
).
Для такой ТС справедливо неравенство:
![]() .
Оно выражает
принцип
возрастания энтропии:
энтропия изолированной ТС не убывает;
возрастает, если процесс необратимый
и остается постоянной, если процесс
обратимый. Иначе
говоря, энтропия
изолированной
системы при переходе к состоянию
равновесия возрастает, достигая
максимального значения в равновесном
состоянии. Вероятностью
состояния
системы
называют предел, к которому стремится
отношение времени нахождения системы
в этом состоянии (
.
Оно выражает
принцип
возрастания энтропии:
энтропия изолированной ТС не убывает;
возрастает, если процесс необратимый
и остается постоянной, если процесс
обратимый. Иначе
говоря, энтропия
изолированной
системы при переходе к состоянию
равновесия возрастает, достигая
максимального значения в равновесном
состоянии. Вероятностью
состояния
системы
называют предел, к которому стремится
отношение времени нахождения системы
в этом состоянии (![]() )
к времени
наблюдения над системой, когда это время
стремится к нулю (T):
)
к времени
наблюдения над системой, когда это время
стремится к нулю (T):
![]() .
Вероятность
изолированной системы ведет себя подобно
энтропии: при переходе к равновесному
состоянию вероятность состояния растет,
достигая максимума при равновесии.
Можно показать, что связь между ними
задается выражением:
.
Вероятность
изолированной системы ведет себя подобно
энтропии: при переходе к равновесному
состоянию вероятность состояния растет,
достигая максимума при равновесии.
Можно показать, что связь между ними
задается выражением:
![]() Термодинамической
вероятностью
(W
Термодинамической
вероятностью
(W![]() )
называют количество микросостояний
ТС, которыми реализуется ее макросостояние.
Наибольшее значение W
имеет в равновесном состоянии, чем
дальше состояние системы от равновесного,
тем меньше W.
Очевидно,
)
называют количество микросостояний
ТС, которыми реализуется ее макросостояние.
Наибольшее значение W
имеет в равновесном состоянии, чем
дальше состояние системы от равновесного,
тем меньше W.
Очевидно,
![]() .
Связь энтропии с
термодинамической вероятностью установил
Больцман:
.
Связь энтропии с
термодинамической вероятностью установил
Больцман:![]() .
Здесь k
– постоянная Больцмана. (
.
Здесь k
– постоянная Больцмана. (![]() §§57,58;
§§57,58;
![]() §§72-74)
§§72-74)
Молекулярная физика.
Лк 9
1. Основные положения молекулярно-кинетической теории вещества.
1)
Все тела состоят из атомов или молекул;
2) Атомы и молекулы находятся в состоянии
беспрестанного хаотического движения;
3) между атомами и молекулами действуют
силы притяжения и отталкивания.
Размеры, масса, количество молекул.
Число Авогадро (![]() ).
Взаимодействие молекул. Зависимость
силы взаимодействия между двумя
молекулами от расстояния между ними.
Хаотическое движение молекул. Характер
движения молекул в газах, твердых телах
и жидкостях. (
).
Взаимодействие молекул. Зависимость
силы взаимодействия между двумя
молекулами от расстояния между ними.
Хаотическое движение молекул. Характер
движения молекул в газах, твердых телах
и жидкостях. (![]() §§43)
§§43)
2. Молекулярно-кинетическая теория идеального газа (МКТ). Модель идеального газа. Распределение Максвелла по скоростям поступательного движения молекул.
Модель
идеального газа:
идеальный
газ – это система МТ, которые взаимодействуют
между собой и стенкой сосуда только
посредством упругих
соударений.
Основное
уравнение МКТ:![]() .Молекулы
ИГ распределены по скоростям поступательного
движения. Это
значит, что в состоянии термодинамического
равновесия количество молекул со
скоростями из
некоторого
интервала скоростей остается в среднем
постоянным:
.Молекулы
ИГ распределены по скоростям поступательного
движения. Это
значит, что в состоянии термодинамического
равновесия количество молекул со
скоростями из
некоторого
интервала скоростей остается в среднем
постоянным:
![]() .
Для бесконечно малого интервала скоростей
.
Для бесконечно малого интервала скоростей
![]() ,
взятого около скорости
,
взятого около скорости
![]() ,
количество молекул
,
количество молекул
![]() будет пропорционально
будет пропорционально
![]() ,
N,
и некоторой функции скорости. Ее называют
функцией распределения Максвелла:
,
N,
и некоторой функции скорости. Ее называют
функцией распределения Максвелла: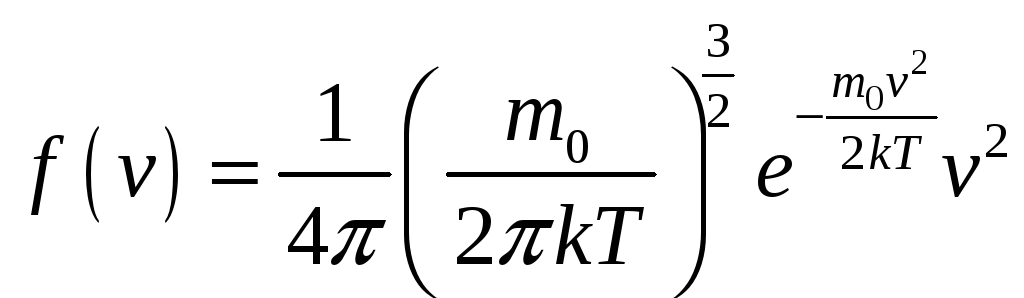 .
Так что
.
Так что
![]() .
Функция распределения определяется
выражением:
.
Функция распределения определяется
выражением:
![]() .
Отсюда видно, что
.
Отсюда видно, что
![]() равна плотности вероятности, а величина
равна плотности вероятности, а величина
![]() равна вероятности того, что молекула
имеет скорость v.
Интеграл
равна вероятности того, что молекула
имеет скорость v.
Интеграл
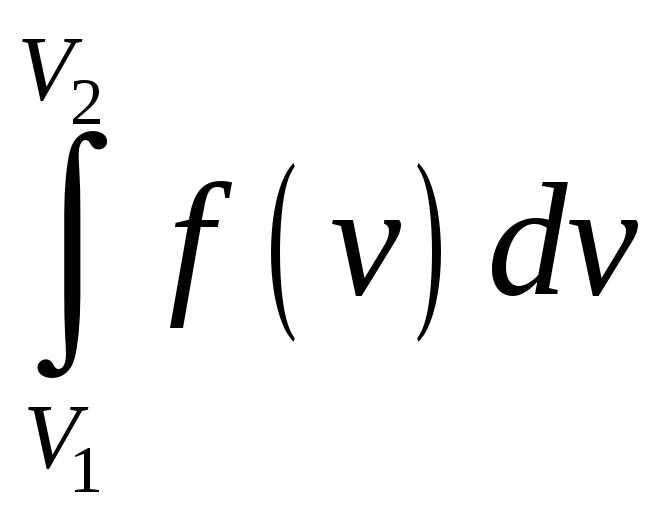 равен вероятности того, что скорость
молекулы находится в интервале
равен вероятности того, что скорость
молекулы находится в интервале
![]() .
Интеграл
.
Интеграл
![]() и равен вероятности того, что молекула
имеет какую-нибудь скорость. Функция
и равен вероятности того, что молекула
имеет какую-нибудь скорость. Функция
![]() имеет максимум при некоторой скорости,
которую называют наивероятнейшей (
имеет максимум при некоторой скорости,
которую называют наивероятнейшей (![]() ).
Ее можно найти из условия экстремума.
Получим, что
).
Ее можно найти из условия экстремума.
Получим, что
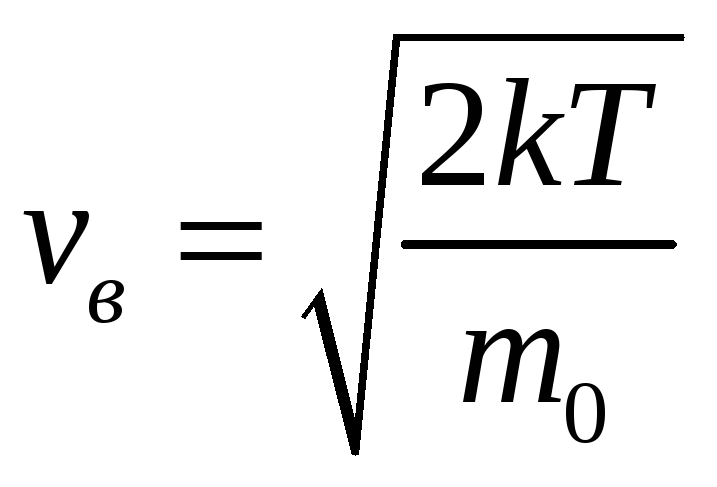 .
Используя распределение Максвелла,
можно рассчитать среднюю арифметическую
скорость
.
Используя распределение Максвелла,
можно рассчитать среднюю арифметическую
скорость
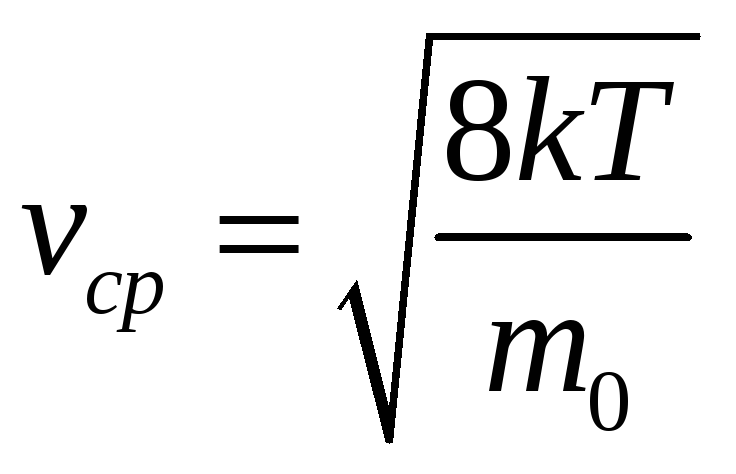 и среднюю квадратичную скорость
и среднюю квадратичную скорость
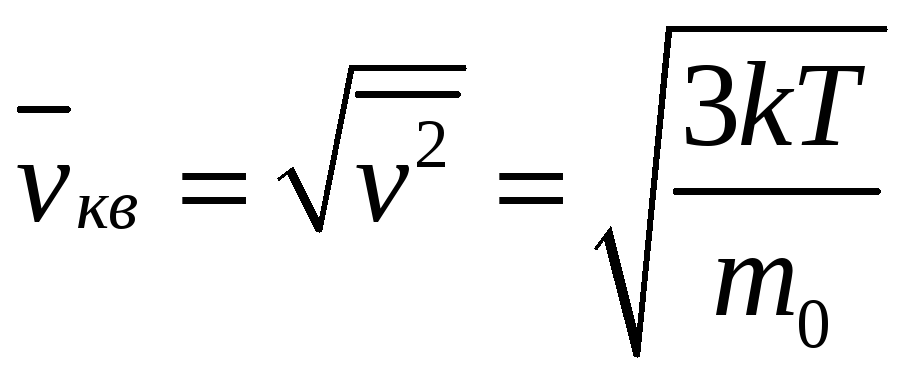 .
Эти три скорости называют характеристическими.
(
.
Эти три скорости называют характеристическими.
(![]() §44,47;
§44,47;
![]() 37,38,40)
37,38,40)
