
- •Э.А.Бикяшев основы теории электролитической диссоциации
- •1.2 Классификация электролитов и механизм электролитической диссоциации
- •1.2.1 Диссоциация в расплавах
- •1.2.2 Диссоциация в среде полярного растворителя
- •2.2 Кислотно-основный характер водородных соединений
- •Кислота средней силы сильные кислоты:
- •2.3 Кислотно-основный характер гидроксидов (но)mЭОn
- •2.4 Особенности диссоциации сильных электролитов
- •2.5 Зависимость степени диссоциации слабых электролитов от параметров состояния
- •2.5.1 Влияние концентрации электролита
- •2.5.2 Влияние "третьего" вещества
- •2.5.3 Влияние температуры
- •Оглавление
- •1.1 Основные понятия
2.4 Особенности диссоциации сильных электролитов
Как было показано ранее, сильными электролитами являются ионные вещества (практически все соли; гидроксиды щелочных и щелочно-земельных металлов), а также сильные кислоты молекулярного строения. В растворах они диссоциированы практически полностью (это категорически справедливо для ионных соединений). И в то же время, если экспериментально изучать коллигативные свойства таких растворов (см. выражения (1) на стр.1), то обычно оказывается, что изотонический коэффициент для таких растворов несколько меньше возможного максимального значения, а рассчитанная по (13) степень диссоциации меньше единицы. Причем и i, и α быстро увеличиваются при разбавлении растворов. Эти факты нашли объяснение в начале ХХв. в работах П.Дебая-Г.Хюккеля. Подробный разговор на эту тему выходит за рамки данного пособия. Если же причину этих особенностей сформулировать кратко, то следует отметить, что из-за высокой концентрации ионов в растворах таких электролитов они испытывают сильные электростатические притяжения даже через гидратные оболочки. Соответственно подвижность ионов уменьшается, они ведут себя не как абсолютно обособленные частицы. Это создает впечатление кажущейся неполной диссоциации. Заниженная за счет этих эффектов степень диссоциации называется "кажущейся". При разбавлении растворов межионные взаимодействия ослабевают, и "кажущаяся" степень диссоциации приближается к истинной (т.е. к единице).
2.5 Зависимость степени диссоциации слабых электролитов от параметров состояния
2.5.1 Влияние концентрации электролита
Как отмечено на стр.1, еще в конце XIXв. С.Аррениус, изучая электропроводность, экспериментально доказал, что при разбавлении степень диссоциации электролитов увеличивается. На год позже (в 1988г.) аналогичные результаты получил В.Ф.Оствальд и дал им теоретическое обоснование на основе теории равновесия. Например, в случае слабой уксусной кислоты имеем:
СН3СООН
![]() СН3СОО– + Н+
СН3СОО– + Н+
 .
.
Если теперь в формулу для константы диссоциации подставить равновесные концентрации, используя выражения (2.4) и (2.6), то получим:
 .
(2.15)
.
(2.15)
Учитывая, что для слабых электролитов α≪1, знаменатель дроби (2.15) примерно равен единице, тогда
 и
и
 .
(2.16)
.
(2.16)
Полученные выражения называют законом разбавления Оствальда. Из (2.16) следует, что степень диссоциации слабого электролита увеличивается при разбавлении растворов.
Этому факту можно дать простое качественное объяснение: разбавление раствора не препятствует диссоциации электролита, но затрудняет его моляризацию, т.е. смещает равновесие диссоциации в сторону ионов. Более строго смещение равновесия можно обосновать анализом формулы для концентрационной константы диссоциации
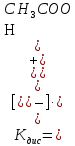 .
.
Если раствор уксусной кислоты разбавить вдвое, то в два раза уменьшатся концентрации всех находящихся в растворе частиц: и молекул, и ионов. При этом числитель дроби уменьшится в четыре раза, а знаменатель – только в два! Дробь станет меньше константы равновесия (она осталась неизменной, т.к. от концентрации раствора не зависит17):
 .
.
Отсутствие равенства означает отсутствие равновесия. То есть, разбавив раствор, мы нарушили равновесие диссоциации. Теперь система самопроизвольно будет его вновь восстанавливать, а для этого требуется увеличение дроби. Это может произойти только за счет преобладающего протекания реакции диссоциации, при которой несколько увеличится концентрация ионов (числитель) и уменьшится концентрация недиссоциированных молекул (знаменатель). Равновесие сместится вправо, в сторону дополнительного образования ионов.
