
1.7.Уравнение состояния идеального газа
Уравнение, связывающее любой термодинамический параметр системы с параметрами, принятыми в качестве независимых переменных, называется уравнением состояния.
Уравнение состояния идеального газа позволяет вычислять давление, объем, плотность и температуру ограниченного объема газа любого сорта Уравнение состояния, связывающее для однородного тела давление р, объем V и температуру Т называется термическим уравнением состояния.
Выведем уравнение состояния идеального газа.
-
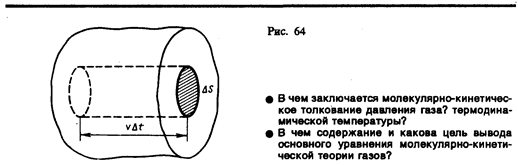
Будем считать молекулы газа маленькими твердыми шарами, заключенными в ящик объема V. Это дает нам возможность считать, что между молекулами происходит упругое соударение.
-
Рассмотрим сначала одну такую молекулу, отражающуюся от левой стенки ящика. Средняя сила, действующая на стенку на протяжении времени
 t
, равна
t
, равна
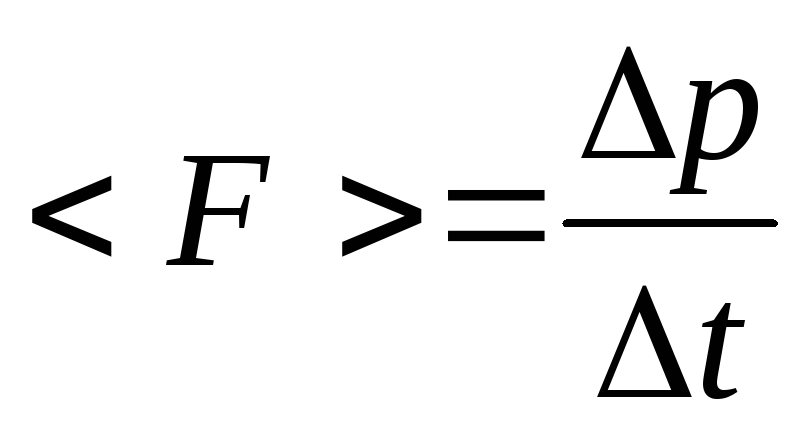 .
.
В результате удара о стенку импульс молекулы меняется на величину
![]() - удар абсолютно
упругий.
- удар абсолютно
упругий.
Время между
соударениями молекулы с этой стенкой
![]() ,
,
тогда
![]() .
.
-
В
 равновесном состоянии движение всех
молекул хаотично. Это позволяет считать,
что все молекулы движутся только в
направлениях X,Y
и
Z,
т.е. если в единице объема содержится
п
молекул, то в каждом из этих направлений
движутся по
равновесном состоянии движение всех
молекул хаотично. Это позволяет считать,
что все молекулы движутся только в
направлениях X,Y
и
Z,
т.е. если в единице объема содержится
п
молекул, то в каждом из этих направлений
движутся по
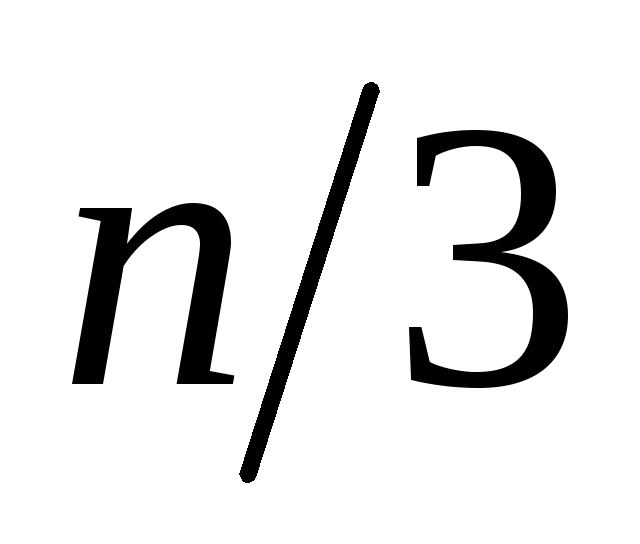 молекул,
или по
молекул,
или по
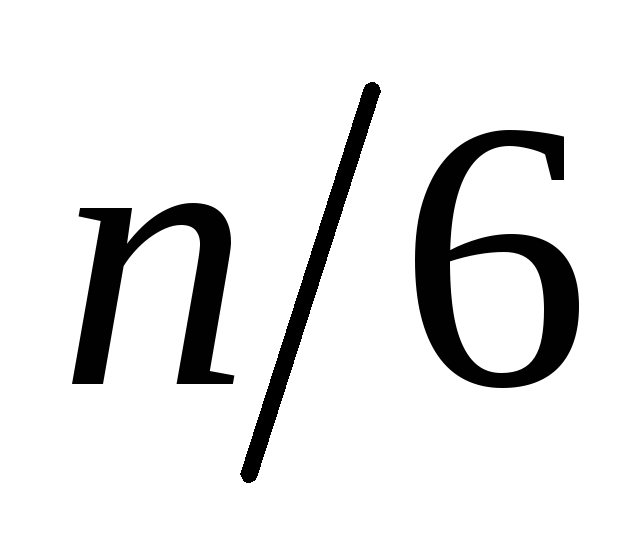 в одну сторону.
в одну сторону. -
Если в объеме содержится N молекул, то результирующая сила, действующая на стенку со стороны всех молекул рана
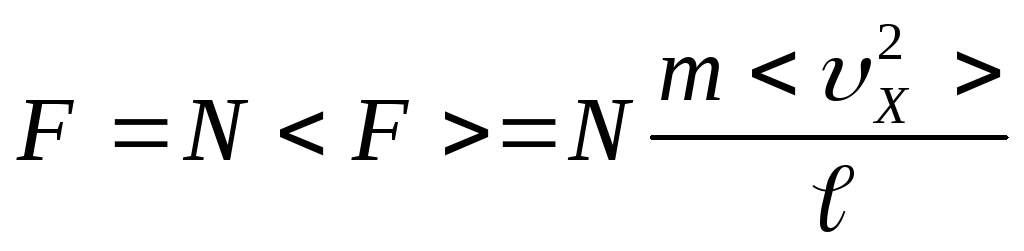 ,
,
где <x2 > - средний квадрат скорости движения всех N молекул в направлении Х.
Величина, равная корню квадратному из <X2 > называется среднеквадратичной скоростью молекулы в направлении Х.
-
Разделив обе части этого уравнения на площадь стенки S, получим выражение для давления:
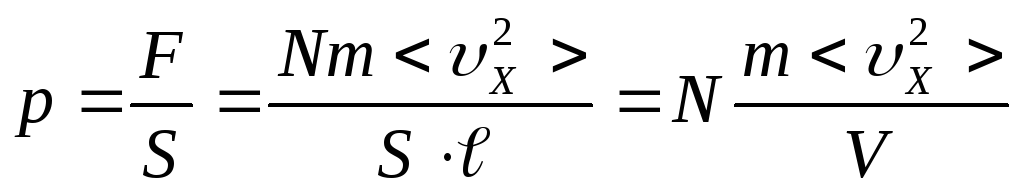 ,
где V
– объём газа (ящика).
,
где V
– объём газа (ящика).
Мы получили, что для данной массы газа произведение pV остается постоянным, при условии, что кинетическая энергия частиц остается без изменения (сохраняется). Это закон Бойля.
-
Молекулы газа движущегося хаотически во всех направлениях в пространстве равноправны, поэтому:
![]() .
.
Ясно, что
![]() ,
,
поэтому
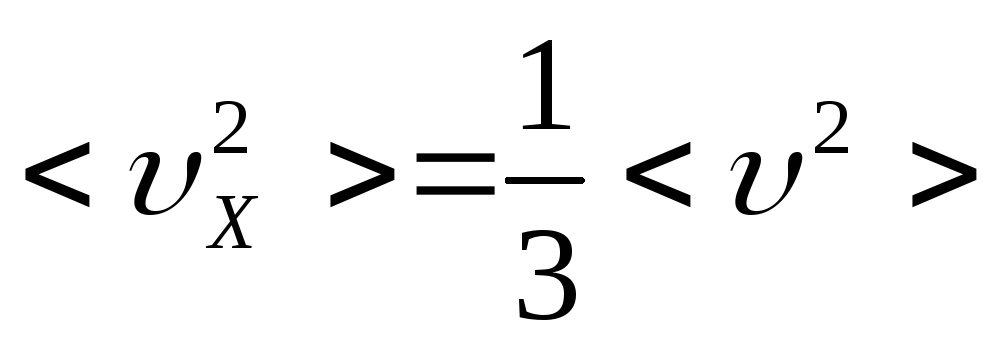 ,
,
тогда
![]() . (1)
. (1)
![]() ,
,
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
С другой стороны, по уравнению Клапейрона — Менделеева, pVm=RT. Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
![]()
Абсолютной температурой принято называть величину, прямо пропорциональную средней кинетической энергии молекул в сосуде:
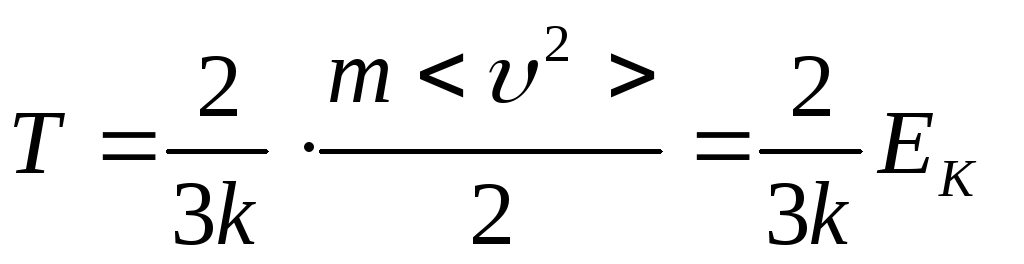 ,
,
где k
- постоянная Больцмана, k=![]() Дж/К
,
Дж/К
,
EK - средняя кинетическая энергия, приходящаяся на одну частицу.
Тогда уравнение
(1) можно записать в виде
![]() ,
(2)
,
(2)
Или
![]() .
.
Таким образом, применив уравнения классической механики к молекулам идеального газа, мы вывели уравнение его состояния.
-
Согласно закону Авогадро, моли всех газов занимают при одинаковых условиях одинаковый объем, поэтому для моля вещества константа в уравнении будет одинакова для всех газов:
![]() ,
(3)
,
(3)
индекс означает, что данный параметр берется в расчете на моль вещества,
R - универсальная газовая постоянная, R=8,31 Дж/(моль∙К)
Для произвольной массы газа m уравнение состояния идеального газа примет вид:
![]() -
уравнение
Менделеева – Клапейрона,
-
уравнение
Менделеева – Клапейрона,
где μ – молярная масса, ν - число молей (количество вещества).
Отношение
![]() - это постоянная Больцмана.
- это постоянная Больцмана.
Здесь
![]() – число Авогадро.
– число Авогадро.
Умножим правую
часть уравнения (3) на
![]() .
Произведение
.
Произведение
![]() равно числу молекул в массе газа m.
равно числу молекул в массе газа m.
С учетом этого
получаем:
![]() ,
(4)
,
(4)
разделив на V c учетом того, что N/V - число молекул в единице объема, получаем
![]() .
Это основное
уравнение молекулярно - кинетической
теории.
.
Это основное
уравнение молекулярно - кинетической
теории.
Выражения (1), (2), (4), (5) – это уравнения состояния идеального газа.
