
- •Оглавление
- •Вариант №10а
- •Термодинамические свойства веществ реакции
- •Расчет изменения теплоемкости в ходе химической реакции
- •Расчет и построение графической зависимости стандартного теплового эффекта реакции от температуры
- •Расчет зависимости константы равновесия от температуры
- •Расчет изменений стандартной энергии Гиббса и стандартной энтропии реакции
- •Расчет парциальных давлений компонентов при заданном начальном составе смеси
- •Определение направления процесса при заданных условиях
- •Определение влияния давления на смещение равновесия
- •Определение равновесных парциальных давлений
-
Расчет зависимости константы равновесия от температуры
Перепишем изобару Вант-Гоффа:

подставив значение ΔrH°, полученное в п.IV:
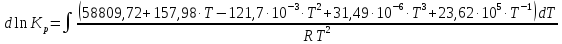
Проинтегрировав данное уравнение, получим:

Из данного уравнения необходимо найти константу интегрирования lnKJ. Для этого примем T=298,15 К и подставим lnKp,298:

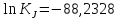
Следовательно:

Рассчитаем значения lnKp для интервала температур 300<T<700 с шагом в 50 К. Полученные результаты запишем в таблицу и построим график f=lnKp(1/T):
Таблица №3
|
T |
1/T*103 |
lnKp |
Kp |
|
300 |
3,33 |
-9,2339 |
9,7670*10-5 |
|
350 |
2,86 |
-3,1884 |
0,04124 |
|
400 |
2,50 |
1,4858 |
4,4187 |
|
450 |
2,22 |
5,2235 |
185,5817 |
|
500 |
2,00 |
8,2886 |
3978,2286 |
|
550 |
1,82 |
10,8517 |
51624,2199 |
|
600 |
1,67 |
13,0287 |
455313,7149 |
|
650 |
1,54 |
14,9013 |
2961750,9072 |
|
700 |
1,43 |
16,5289 |
15081014,9291 |

График №2. Зависимость натурального логарифма константы равновесия от обратной температуры
-
Расчет изменений стандартной энергии Гиббса и стандартной энтропии реакции
Из уравнений:
 ;
;
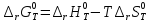
рассчитаем значения ΔrGT° (Дж/моль) и ΔrST° (Дж/моль*К) для 300<T<700 с шагом 50 К и занесем значения в таблицу:
Таблица №4
|
T,К |
(1/Т)*103, К-1 |
ΔrH0T, Дж/моль |
lnKp |
Kp |
ΔrG0T, Дж/моль |
ΔrS0T, Дж/моль*К |
|
300 |
3,33 |
103974,37 |
-9,2339 |
9,7670*10-5 |
23032,61 |
269,81 |
|
350 |
2,86 |
107293,32 |
-3,1884 |
0,04124 |
9278,45 |
280,04 |
|
400 |
2,50 |
110450,29 |
1,4858 |
4,4187 |
-4941,59 |
288,48 |
|
450 |
2,22 |
113375,19 |
5,2235 |
185,58 |
-19543,84 |
295,38 |
|
500 |
2,00 |
116035,39 |
8,2886 |
3978,23 |
-34457,75 |
300,99 |
|
550 |
1,82 |
118418,72 |
10,8517 |
51624,22 |
-49624,76 |
305,53 |
|
600 |
1,67 |
120524,95 |
13,0287 |
455313,71 |
-64996,48 |
309,20 |
|
650 |
1,54 |
122361,17 |
14,9013 |
2961750,91 |
-80532,91 |
312,14 |
|
700 |
1,43 |
123939,22 |
16,5289 |
15081014,93 |
-96200,95 |
314,49 |
-
Расчет парциальных давлений компонентов при заданном начальном составе смеси
Рассчитаем начальные парциальные давления участвующих в реакции газов по формуле:
 где
где
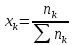
 0,01+1,5=1,51
0,01+1,5=1,51




Полученные данные
занесем в таблицу. Так же рассчитаем
парциальные давления участников реакции
при изменении общего давления в М раз
по формуле
 и занесем в эту же таблицу:
и занесем в эту же таблицу:
Таблица №5
|
Вещество |
nнач, моль |
xk |
|
|
атм |
|
|
C3H8 |
0,01 |
0,00662252 |
10 |
0,06623 |
2 |
0,0132450 |
|
H2 |
1,5 |
0,99337748 |
10 |
9,9338 |
2 |
1,9867550 |




