
- •Оглавление
- •Вариант №10а
- •Термодинамические свойства веществ реакции
- •Расчет изменения теплоемкости в ходе химической реакции
- •Расчет и построение графической зависимости стандартного теплового эффекта реакции от температуры
- •Расчет зависимости константы равновесия от температуры
- •Расчет изменений стандартной энергии Гиббса и стандартной энтропии реакции
- •Расчет парциальных давлений компонентов при заданном начальном составе смеси
- •Определение направления процесса при заданных условиях
- •Определение влияния давления на смещение равновесия
- •Определение равновесных парциальных давлений
-
Определение направления процесса при заданных условиях
Одна из форм записи уравнения энергии Гиббса выглядит так:

Рассчитаем значение
 для нашей реакции при p=10
атм и T=500
K.
При этом сделаем вывод о возможности
протекания реакции самопроизвольно из
критерия направления процесса:
для нашей реакции при p=10
атм и T=500
K.
При этом сделаем вывод о возможности
протекания реакции самопроизвольно из
критерия направления процесса:


Так как энергия Гиббса при T=500 К и р=10 атм принимает положительное значение следует, что процесс не может идти самопроизвольно.
-
Определение влияния давления на смещение равновесия
Для определения
влияния давления на смещение равновесия
рассчитаем
 при
при
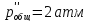 ,
Т=500 К и том же соотношении компонентов:
,
Т=500 К и том же соотношении компонентов:

Сравнивая значения
 и
и
 ,
приходим к выводу, что понижение
давления
приводит к уменьшению энергии Гиббса
и, следовательно, к смещению
равновесия в сторону продуктов.
,
приходим к выводу, что понижение
давления
приводит к уменьшению энергии Гиббса
и, следовательно, к смещению
равновесия в сторону продуктов.
-
Определение равновесных парциальных давлений
Запишем реакцию вместе с количеством вещества каждого компонента до начала реакции и после достижения состояния равновесия:
C3H8 = 4H2 + 3Cгр
nk,нач, моль 0,01 1,5 0
nk,равн, моль 0,01-α 1,5+4α 0

Значит, парциальные давления равны:


Общее давление равно 10 атм.
Запишем уравнение для константы равновесия через равновесные парциальные давления:

Решением данного уравнения является два действительных значения:


Откуда следует,
что α2
не удовлетворяет требованиям задачи,
следовательно, принимаем значение

Рассчитаем равновесные парциальные давления компонентов:


Проведем проверку, подставив полученные значения парциальных давлений в уравнение константы равновесия и вычислим ее:
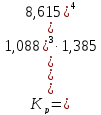
Выводы
-
Стандартный тепловой эффект реакции выше нуля, следовательно, реакция является эндотермической и протекает с поглощением теплоты, что также подтверждается законом Вант-Гоффа и графиком 2.
-
По принципу Ле-Шателье повышение температуры в реакции приведет к смещению равновесия в сторону продуктов.
-
По графику №2 (графическое изображение закона Вант-Гоффа) можно прийти к выводу, что для эндотермических реакций с повышением температуры возрастает значение константы равновесия.
-
При заданных условиях (Т=500 К, робщ=10 атм) энергия Гиббса принимает положительное значение. Значит, согласно одному из критериев направления процесса, данная реакция в данных условиях протекать самопроизвольно не может.
-
Константа равновесия может выражаться разными способами, но все варианты ее записи находятся в определенной зависимости друг от друга. Напишем зависимость константы равновесия, выраженную через парциальные давления, от константы равновесия, выраженную через мольные доли веществ в системе:
 ,
,
где Kp – константа равновесия, выраженная через парциальные давления веществ в системе;
Kx – константа равновесия, выраженная через мольные доли веществ в системе;
p – общее давление в системе;
Δν – изменение числа моль в ходе реакции.
Из уравнения видно, что при постоянном значении Δν≠0 константа равновесия системы находится в прямо пропорциональной зависимости от давления: с повышением давления увеличивается значение константы равновесия и наоборот (при Kx=const). Увеличение значения константы равновесия Kp свидетельствует о повышении давления конечных продуктов, что приводит к смещению равновесия в сторону реагентов.
Таким образом, понижение давления в нашей системе приводит к смещению равновесия в сторону продуктов.
