
Растворы электролитов
Диссоциация электролитов
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. При попадании этих веществ в полярный растворитель происходит электролитическая диссоциация, сопровождающаяся образованием сольватированных заряженных частиц - положительно заряженных катионов и отрицательно заряженных анионов. Например, для водных растворов:
HCl (газ) + (n+m)H2O = H+×nH2O + Cl-×mH2O,
NaCl (крист) + (p+q)H2O = Na+×pH2O + Cl-×qH2O.
Количественной характеристикой электролитической диссоциации служит степень диссоциации a, равная отношению числа диссоциированных молекул Nдисс к общему числу молекул электролита в растворе Nобщ:
a
=
![]() .
.
Для процесса электролитической диссоциации
KmАn
D m![]() + n
+ n![]() ,
,
где KmАn
– молекула электролита,
![]() – катион,
– катион,
![]() –
анион, z – зарядовое число
ионов; различают аналитическую,
или концентрационную, константу
диссоциации Kд,c,
вычисленную по концентрациям молекул
и ионов:
–
анион, z – зарядовое число
ионов; различают аналитическую,
или концентрационную, константу
диссоциации Kд,c,
вычисленную по концентрациям молекул
и ионов:
Kд,
с
=
![]() ,
(1)
,
(1)
где [![]() ],
[
],
[![]() ]
-
равновесные молярные концентрации
катионов и анионов, соответственно;
[KmАn]недисс
-
равновесная молярная концентрация
недиссоциированных молекул электролита,
и
термодинамическую
константу
диссоциации
Kд,
а,
вычисленную по активностям a
соответствующих
частиц:
]
-
равновесные молярные концентрации
катионов и анионов, соответственно;
[KmАn]недисс
-
равновесная молярная концентрация
недиссоциированных молекул электролита,
и
термодинамическую
константу
диссоциации
Kд,
а,
вычисленную по активностям a
соответствующих
частиц:
Kд,
а
=
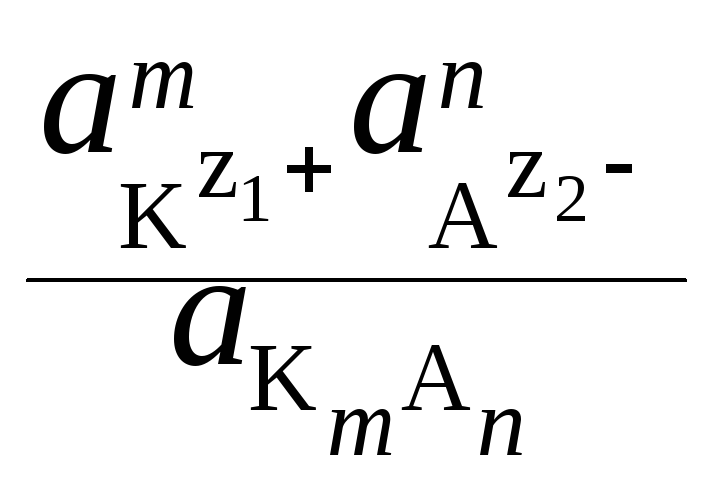 (2)
(2)
Понятие активности, равной произведению концентрации на коэффициент активности а=f*С было предложено Льюисом для того, чтобы можно было использовать для реальных систем термодинамические уравнения, выведенные для идеальных растворов, в которых отсутствуют взаимодействия между компонентами.
Выражение (1) обычно используется для растворов слабых электролитов, поскольку в разбавленных растворах коэффициент активности слабого электролита f»1 и значение активности практически соответствует величине концентрации С частиц.
Для растворов сильных электролитов концентрационная константа диссоциации не имеет физического смысла, т.к. концентрация недиссоциированных молекул практически равна нулю. Для них справедливо выражение (2), поскольку коэффициент активности сильного электролита, отражающий влияние межионных и ион-молекулярных взаимодействий на свойства раствора, f < 1.
Пусть слабая кислота НА (Н+ - ион водорода, А- - анион) с молярной концентрацией С диссоциирует по уравнению:
НА D Н+ + А-.
Степень диссоциации кислоты равна a. Тогда при достижении равновесия концентрации ионов Н+ и А- составят aС, а концентрация недиссоциированных молекул кислоты - (С – aС) = С(1– a). Используя уравнение (1), получаем:
Kд,
с
=![]() =
=
![]()
или
Kд,
с
=
![]() (3)
(3)
Это выражение носит название закона разбавления (или разведения) Оствальда.
В случае, когда степень диссоциации электролита a << 1, величиной a по сравнению с 1 можно пренебречь и закон разбавления Оствальда записать в упрощенном виде:
Kд, с » a2С (4)
Константа диссоциации не зависит от концентрации электролита и при постоянной температуре Kд,с = const, а степень диссоциации слабого электролита a тем больше, чем ниже концентрация, то есть чем больше разбавлен раствор. При введении в равновесный раствор ионов Н+ или А- произойдет сдвиг равновесия диссоциации влево в соответствии с принципом Ле-Шателье и установится новое равновесие с другими концентрациями [H+], [А-] и [HА]недисс, но с той же Kд,с. Константа диссоциации будет меняться только при варьировании температуры.
Константу равновесия процесса диссоциации принято обозначать Kа в случае слабых кислот (от английского слова "acid") и Kb для слабых оснований (от слова "base"). Например, слабая цианистоводородная кислота диссоциирует по уравнению:
HCN D H+ + CN- и
Ka = [H+]×[CN-]/[HCN]недисс = 4,93×10–10.
Примером диссоциации слабого основания является следующее уравнение:
NH4OH D NH4+ + OH- и
Kb = [NH4+]×[OH-]/[NH4OH]недисс = 1,8×10–5.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, процесс диссоциации щавелевой кислоты протекает следующим образом:
I ступень: H2C2O4 D H+ + HC2O4-, Ka(I) = 6,46×10–2;
II ступень: HC2O4- D H+ + C2O42-, Ka(II) = 6,17×10–5;
общее уравнение диссоциации: H2C2O4 D 2H+ + C2O42-, Ka = Ka(I) ×Ka(II).
Аналогично, для гидроксида свинца можно записать:
I ступень: Pb(OH)2 D PbOH+ + OH-, Kb(I) = 9,55×10–4;
II ступень: PbOH+ D Pb2+ + OH-, Kb(II) = 3,0×10–8;
общее уравнение диссоциации: Pb(OH)2 D Pb2+ + 2OH-, Kb = Kb(I) ×Kb(II).
В случае разбавленных растворов сильных электролитов можно считать, что их диссоциация происходит практически полностью. Например, при диссоциации серной кислоты по первой ступени:
H2SO4 = H+ + HSO4- и Ka(I) ® ¥,
так как [H2SO4]недисс ® 0, тогда как для второй ступени:
HSO4- D H+ + SO42- и Ka(II) = 1,12×10–2.
То же относится и к диссоциации сильных оснований, например, Ca(OH)2:
I ступень: Ca(OH)2 = CaOH+ + OH- и Kb(I) ® ¥,
II ступень: CaOH+ D Ca2+ + OH- и Kb(II) = 4,0×10–2.
