
- •Оглавление
- •Введение
- •1. История открытия
- •2. Распространение в природе
- •3. Получение
- •4. Физические свойства
- •5. Химические свойства
- •6. Применение
- •7. Биологическая роль
- •Заключение
- •Список литературы
- •3. Государственный доклад "о состоянии и использовании минерально-сырьевых ресурсов Российской Федерации в 2016 и 2017 годах"
4. Физические свойства
В компактном состоянии никель – металл блестящего серебристо-серого цвета (после полировки появляется красивый металлический блеск); может существовать в двух кристаллических модификациях: β-Ni – структура с плотной гексагональной упаковкой и α-Ni с кубической гранецентрированной решеткой.
Никель – тяжелый металл, его плотность 8,907 г/см3 при 20º, твердость 5 по шкале Мооса, он ковок, тягуч и может перерабатываться при нагревании под давлением, тугоплавок (т. пл. 1455º, т. кип. 3075º), имеет относительно низкую тепло- и электропроводность.
Кристаллическая модификация α-Ni, в отличие от модификации β-Ni, ферромагнитна, для нее точка Кюри близка к 350°. Известно множество сплавов, которые никель образует с железом, кобальтом, медью, марганцем, цинком, хромом, молибденом, вольфрамом, бериллием, углеродом, кремнием, фосфором, серой и другими [6].
5. Химические свойства
С химической точки зрения металлический никель не активен, он не корродирует в воде, на воздухе и в различных растворах.
При обычной температуре воздух и вода не действуют на металлический никель в компактном состоянии. На воздухе (в кислороде) металлический никель легко превращается в NiO (зеленого цвета) при ~500º, если он находится в компактном состоянии, или при 150-200º – в виде порошка.
Помимо оксида NiO известны также оксиды Ni2O, Ni3O, Ni4O, Ni3O4, · 2H2O, Ni2O3 · H2O.
При 600-1000º никель реагирует с водяным паром:
(3) Ni + H2O ⇆ NiO + H2
Металлический никель в твердом состоянии (компактном, губчатом или порошкообразном) или в расплаве поглощает водород лучше, чем железо, кобальт или медь.
При нагревании металлический никель взаимодействует с галогенами, серой, селеном, теллуром, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, образуя различные соединения: NiF2, NiCl2, NiBr2, NiI2, NiS, Ni3S2, Ni6S5, Ni7S6, NiS2, Ni2S,Ni3Se4, Ni2Se3, NiSe2, Ni2Te3, NiTe2, NiP2, NiP3, Ni5As2, NiSb, Ni3C, Ni2Si, NiB и др.
В условиях обычной температуры и влажного воздуха хлор или бром с металлическим никелем дают соответствующие дигалогениды.
При нагревании в атмосфере сероводорода поверхность металлического никеля покрывается пористой пленкой NiS, которая не прилегает плотно к металлу и не оказывает защитного действия.
В результате взаимодействия диоксида серы с никелем образуются NiO и сульфид никеля, который растворяется в расплавленном металле, образуя сплавы, хрупкие при нагревании. Для удаления серы в сплавы никеля добавляют металлические марганец, магний и литий. Сульфид никеля NiS образует с металлическим никелем легкоплавкую при 645º эвтектику, в то время как сульфиды марганца, магния или лития плавятся при высокой температуре и кристаллизуются в виде изолированных включений.
Диоксид азота при 200º окисляет металлический никель до NiO, сама восстанавливаясь до NO.
При пропускании газообразного аммиака над тонкодисперсным порошком металлического никеля, нагретого до 500º, образуется чёрный кристаллический порошок Ni3N.
При 900º никель взаимодействует с СО2:
(4) Ni + CO2 ⇆ NiO + CO
Пропусканием оксида углерода над нагретым до 50-60º металлическим никелем получают летучее соединение Ni(CO)4.
В результате действия оксида углерода, метана, ацетилена, бензола, гексана и др. на никель при высокой температуре образуется карбид никеля Ni3C и выделяется водород (в случае применения углеводородов), который растворяется в расплавленном металле, образуя сплавы.
При нагревании металлический никель восстанавливает многочисленные оксиды или гидроксиды металлов, сульфиды, тиоцианаты и нитраты щелочных металлов.
Никель взаимодействует с расплавленными щелочами (температура выше 600º). При нагревании (550-600°) металлического никеля с NaOH в вакууме образуются NiO, металлический натрий и выделяется водород.
Галогеноводороды в газообразном состоянии взаимодействуют при нагревании с никелем по общему уравнению
(5) Ni + 2HX ⇆ NiX2 + H2
Разбавленные кислоты HCl, H2SO4, HNO3 медленно растворяют металлический никель. Чем более разбавлен раствор кислоты, тем более высокая температура требуется для растворения никеля. В концентрированной HNO3 (d=1,42) металлический никель при 15º пассивируется, а при 72º – энергично растворяется. В царской водке никель растворяется, образуя хлорид никеля(II).
Никель медленно растворяется в кислотах H2CO3 и H3PO4, а с уксусной, щавелевой, винной и лимонной кислотами взаимодействует только после длительного контакта.
Растворы NaCl, CaOCl2, (NH4)Fe(SO4) 2 ·12H2O вызывают коррозию (растворяют) металлического никеля при комнатной температуре.
При
действии растворов персульфатов щелочных
металлов на порошок металлического
никеля образуются двойные сульфаты
никеля и щелочных металлов. Химические
свойства никеля наглядно иллюстрируются
следующей схемой:
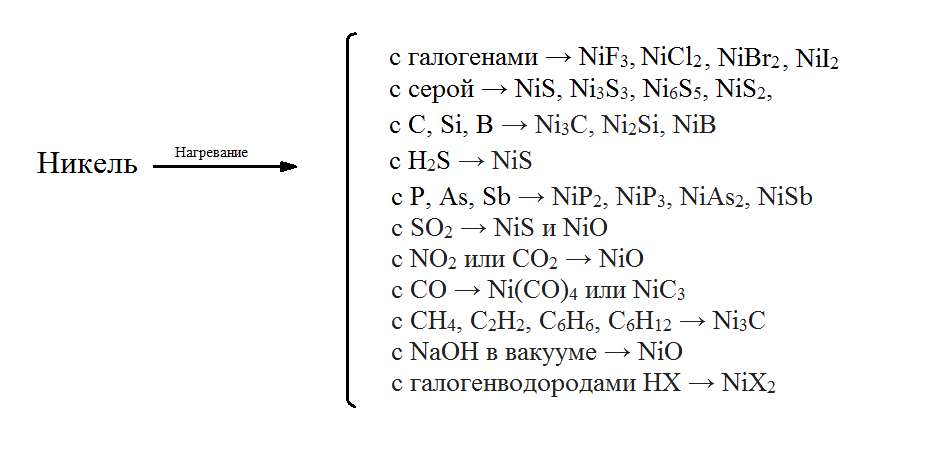
Рис.8 Химические свойства никеля [6]
С физиологической точки зрения металлический никель не токсичен для человека, животных и растений [6].
Никель образует множество различных соединений, как органических, так и неорганических. Приведём примеры некоторых неорганических соединений никеля:
NiO – Оксид никеля (II)
Бунзенит. Жёлтый, при нагревании в инертной атмосфере становится коричневым, при нагревании на воздухе - темно-зеленым. Термически устойчивый, в прокаленном виде не реагирует с кислотами, водой. Проявляет амфотерные свойства (основные свойства преобладают); реагирует с кислотами, при спекании - со щелочами и оксидами типичных металлов. Переводится в раствор действием концентрированного гидрата аммиака.
(6) NiO(т) + 7H2O ⇆ [Ni(H2O)6]2+ + 2OH–
(7) NiO + 2HCl (разб.) → NiCl2 + H2O
(8)
NiO
+ 2NaOH
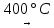 Na2NiO2
(зел.) +
H2O
Na2NiO2
(зел.) +
H2O
(9)
NiO + BaO
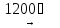 (BaNi)O2
(черн.)
(BaNi)O2
(черн.)
(10) NiO + 6(NH3 · H2O) [конц.] → [Ni(NH3)6](OH)2 (син.) + 5H2O
(11)
NiO + H2
 Ni
+ H2O
Ni
+ H2O
(12)
2NiO + SiO2
 Ni2SiO4
Ni2SiO4
Ni(OH)2 – Гидроксид никеля (II)
Светло-зеленый, при нагревании разлагается. Не растворяется в воде. Из раствора осаждается гидрат Ni(OH)2· nH2O, при выдерживании над концентрированной серной кислотой переходит в Ni(OH)2 · 0,67 H2O. Проявляет амфотерные свойства (основные свойства преобладают): реагирует с разбавленными кислотами, щелочами при спекании. Переводится в раствор действием гидрата аммиака. Слабый восстановитель.
(13)
Ni(OH)2
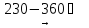 NiO
+ H2O
NiO
+ H2O
(14) Ni(OH)2 + 2HCl (разб.) → NiCl2 + 2H2O
(15)
Ni(OH)2(т)
+ 2NaOH(т)
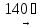 Na2[Ni(OH)4]
Na2[Ni(OH)4]
(16) Ni(OH)2 + 6(NH3 · H2O) [конц.] → [Ni(NH3)6](ОН)2 (син.) + 6Н2O
(17) 2Ni(OH)2 + Cl2 + 2KOH (конц.) → 2NiO(OH)↓ + 2KC1 + 2H2O
NiO(OH) – Метагидроксид никеля
Черный, термически неустойчивый. Не растворяется в воде. Из раствора осаждается серо-черный гидрат Ni2O3 · nH2O, при стоянии под раствором "стареет", при слабом нагревании переходит в черный (NiIINi2III)O2(OH)4 (безводный оксид Ni2O3 не выделен). Не реагирует со щелочами, гидратом аммиака. Разлагается кислотами. Сильный окислитель.
(18)
NiO(OH)
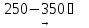 4NiO + 2H2O
+ O2
4NiO + 2H2O
+ O2
(19) 2NiO(OH) + H2O → Ni2O(OH)4↓
(20) 2NiO(OH) + 6HCl (конц.) → Cl2↑ + 2NiC12 + 4H2O
(21) 2NiO(OH) + 3H2SO4(разб.) + 2KI → I2↓ + 2NiSO4 + K2SO4 + 4H2O
Ni(NO3)2 – Нитрат никеля (II)
Светло-зеленый, нелетучий, при нагревании разлагается. Хорошо растворяется в воде (гидролиз по катиону). Реагирует со щелочами, гидратом аммиака, сильными окислителями.
(22)
2Ni(NO3)2
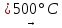 2NiO
+ 4NO2
+ O2
2NiO
+ 4NO2
+ O2
(23)
Ni(NO3)2
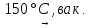 Ni(NO2)2
+
O2
Ni(NO2)2
+
O2
(24) Ni(NO3)2 (разб.) + 2NaOH (конц.) → Ni(OH)2↓ + 2NaNO3
(25) Ni(NO3)2 + NH3 · H2O (разб.) → Ni(NO3)OH↓ + NH4NO3
(26) Ni(NO3)2 + 6(NH3 · H2O) [конц.] → [Ni(NH3)6](NO3)2 (син.) + 6H2O
(27) 2Ni(NO3)2 + NaClO + 4NaOH(разб.) → 2NiO(OH)↓ + NaCl + 4NaNO3 + H2O
NiSO4 – Сульфат никеля (II)
Светло-желтый (кристаллогидрат – зеленый, моренозит), при прокаливании разлагается. Хорошо растворяется в воде (гидролиз по катиону). Реагирует со щелочами, гидратом аммиака, сильными окислителями. Вступает в реакции комплексообразования.
(28)
2NiSO4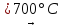 2NiO
+ 2SO2
+ O2
2NiO
+ 2SO2
+ O2
(29) 2NiSO4 (конц.) + 2NaOH (разб.) → Ni2SO4(OH)2↓ + Na2SO4
(30) NiSO4 (разб.) + 2NaOH (конц.) → Ni(OH)2↓ + Na2SO4
(31) NiSO4 + 6(NH3 · H2O) [конц.] → [Ni(NH3)6]SO4 + 6H2O
(32) NiSO4 + NaClO + 4NaOH (разб.) → 2NiO(OH)↓ + NaCl + 2Na2SO4 + H2O
(33) NiSO4 + 2KCN (разб.) → Ni(CN)2↓ + K2SO4
(34) Ni(CN)2 + 2KCN (конц.) + H2O → K2[Ni(CN)4] · H2O↓
NiF2 – Фторид никеля (II)
Желтовато-зеленый, термически устойчивый, летучий при прокаливании. Плохо растворяется в воде, растворимость не зависит от температуры. Из фтороводородной кислоты кристаллизуется сине-зеленый гидрат NiF2 · 5HF · 6H2O. Не реагирует с кислотами даже при нагревании. Разлагается щелочами, гидратом аммиака, восстанавливается водородом. Образует фторокомплексы.
(35) NiF2 + 2NaOH (конц.) → Ni(OH)2↓ +2NaF + H2O
(36) NiF2 + 6(NH3 · H2O) [конц.] → [Ni(NH3)6]F2 + 6H2O
(37)
NiF2
+ H2
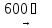 Ni + 2HF
Ni + 2HF
(38) NiF2 + MF (конц.) → (MNi)F3↓ (M= Li, Na, K, Rb, Cs)
(39)
2NiF2
+ 3K(HF2)
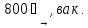 (KNi)F3
+ K2[NiF4]
+ 3HF
(KNi)F3
+ K2[NiF4]
+ 3HF
NiCl2 – Хлорид никеля (II)
Желто-коричневые кристаллы или желтый порошок, летучий при нагревании. Хорошо растворяется в воде (гидролиз по катиону). Зелёный кристаллогидрат NiCl2 · 6H2O имеет строение [Ni(H2O)4Cl2] · 2H2O. Плохо растворяется в концентрированной хлороводородной кислоте, жидком аммиаке. Реагирует с концентрированными серной и азотной кислотами, щелочами, гидратом аммиака, кислородом, водородом. Вступает в реакции обмена и комплексообразования.
(40)
NiCl2(т)
+ H2SO4
(конц.)
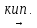 NiSO4
+ 2HCl↑
NiSO4
+ 2HCl↑
(41)
3NiCl2(т)
+ 8HNO3
(30%-я)
 3Ni(NO3)2+3Cl2↑
+ 2NO↑ +4H2O
3Ni(NO3)2+3Cl2↑
+ 2NO↑ +4H2O
-
NiCl2(конц.) + NaOH (разб.) → NiCl(OH)↓ + NaCl
(43) NiCl2 (разб.) + NaOH (конц.) → Ni(OH)2↓ + 2NaCl
(44)
NiCl2
+
H2
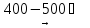 Ni
+ 2HCl
Ni
+ 2HCl
-
NiCl2 + O2
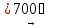 2NiO
+ 2Cl2
[7]
2NiO
+ 2Cl2
[7]
