
- •Неорганическая химия
- •Оглавление
- •Введение
- •История открытия
- •Первый способ получения металлического цинка
- •Строение атома
- •3. Получение цинка
- •3.1. Промышленный способ
- •3.2. Лабораторный способ
- •4. Физические свойства металла
- •Физические свойства некоторых металлов
- •5. Химические свойства
- •5.1. Простое вещество
- •5.2. Амфотерность цинка
- •5.3. Соли цинка
- •5.4. Комплексные соединения
- •Константы нестойкости комплексных ионов [7, c . 334]
- •5.5. Нерастворимые соединения
- •Пр некоторых веществ [8, c. 383]
- •6. Биологическая роль цинка
- •6.1. Положительное влияние
- •6.2. Токсичность
- •Применение цинка
- •Заключение
- •Приложение 1
5. Химические свойства
5.1. Простое вещество
Цинк может реагировать с неметаллами. Как уже говорилось выше, металл на воздухе покрывается оксидной пленкой:
Zn + O2→ 2ZnO.
Так же он может реагировать с галогенамии другими неметаллами при нагревании:
Zn + Hal2→ ZnHal2 (Hal2= Cl2, Br2, F2, I2)
Zn+ SZnS.
5.2. Амфотерность цинка
Цинк является амфотерным элементом, поэтому он может реагировать как с кислотами, с основаниями и с оксидами (кислотными и основными)Хорошо растворяется в азотной, серной и других кислотах при различных концентрациях:
3Zn + 8HNO3конц→3Zn(NO3)2 + 2N2O↑ + 4H2O
4Zn + 10HNO3р-р→ 4Zn(NO3)2 + NH4NO3 + 3H2O
4Zn + 5H2SO4конц→ 4ZnSO4 + H2S↑ + 4H2O
Zn + HCl → ZnCl2 + H2↑.
Чистый металл, его оксид и гидроксид способны реагировать с щелочами в растворах и в расплавах,с образованием цинкатов и тетрагидроксоцинкатов:
Zn + 2KOHK2ZnO2 + H2↑
Zn +2NaOH + 2H2O→ Na2[Zn(OH)4] + H2↑.
Понимая, что цинк обладает амфотерными свойствами, является серебристым на внешний вид металлом, покрытый на воздухе оксидной пленкой и имеет характерный блеск на свежем срезе, его запросто можно спутать с алюминием, чьи характеристики похожи. Однако объект нашего исследования имеет способность растворяться в водном растворе аммиака с выделением газообразного водорода, чего не скажешь о втором металле:
Zn + 4NH3∙H2O → [Zn(NH3)4](OH)2 + H2↑ +2 H2O
Al + NH3∙H2O↛.
5.3. Соли цинка
Соли цинка, как и других металлов, тоже химически активны, т.е. могут вступать в реакции с другими веществами. К примеру, растворимые соединения могут реагировать с основаниями с образованием осадков:
Zn2+ + 2OH-→ Zn(OH)2↓.
Так же растворимые соли цинка способны подвергаться гидролизу: по катиону, в случае если соль от сильной кислоты, или по катиону и аниону, в случае если соль образована слабой кислотой. Например, наиболее стойкими к гидролизу солями являются сульфаты и нитраты цинка:
Zn(NO3)2 + 2HOH = Zn(OH)2↓ + 2HNO3.
Глядя в таблицу, находим константу диссоциации гидроксида цинка и находим конствнту гидролиза для нашей соли(гидролиз протекает по катиону, так как гидроксид цинка – слабое основание):
Таблица 2
Константы диссоциаций некоторых кислот и оснований [6, C. 579-587]
|
H2SO4 |
K1=1,2 ∙ 10-2 K2=1,6 ∙ 10-2 |
NH4OH |
K=1,8 ∙ 10-5 |
|
HCN |
K=7,9 ∙10-10 |
Zn(OH)2 |
K=4,0 ∙ 10-5 |
|
HNO2 |
K=4∙ 10-4 |
Cu(OH)2 |
K=3,4 ∙ 10-7 |
|
CH3COOH |
K=1,8 ∙ 10-5 |
H2S |
K1=6 ∙ 10-8, K2=1 ∙10-14 |
Kг=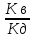 =
=
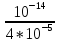 = 2,5 ∙ 10-10.
= 2,5 ∙ 10-10.
Примером соли, гидролиз которой протекает по катиону и по аниону может быть ацетат цинка:
Zn(CH3COO)2 + 2H20 = Zn(OH)2↓ + 2CH3COOH
Рассчитываем константу гидролиза для этой соли:
Kг=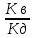 =
=
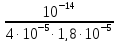 = 1,388∙10-5.
= 1,388∙10-5.
Сравним две константы, чтобы выяснить, какая соль больше подвергается гидролизу:
1,388∙ 10-5> 2,5 ∙ 10-10.
Константа гидролиза второй соли больше, чем константа для первой, а следовательно, ацетат цинка лучше подвергается гидролизу.
Так же соли цинка способны принимать участие в двойном гидролизе, это реакция обмена двух солей с последующим гидролизом одной из них. Можно разобрать следующий пример: двойной гидролиз сульфата цинка и нитрита натрия:
ZnSO4 + NaNO2 + HOH = Zn(OH)2↓ + Na2SO4 + HNO2.
Реакция протекает в две стадии: первая – реакция обмена между сульфатом цинка и нитритом натрия:
ZnSO4 + 2NaNO2 → Zn(NO2)2 + Na2SO4
Вторая стадия – гидролиз нитрита цинка:
Zn(NO2)2 + 2HOH = Zn(OH)2 + 2HNO2
Константа гидролиза будет равна 6,25 ∙ 10-7
Kг=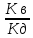 =
=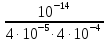 = 6,25 ∙ 10-7.
= 6,25 ∙ 10-7.
