
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
1 Порядок
![]() .
(1 порядок) С – концентрация, тогда
.
(1 порядок) С – концентрация, тогда
![]() , [A]=C
, [A]=C
![]() .
Имеем
.
Имеем
![]()
![]() ,
,
![]() .
.
Если
![]() =0,
то С=С0, тогда
=0,
то С=С0, тогда
![]() .
.
Пусть а – исходное число моль, а x
– число моль в момент
,
тогда a-x –
число моль вещества, вступивших в
реакцию.
![]() - текущая концентрация.
- текущая концентрация.
![]() .
.
![]() .
.
Для сравнения скорости реакций вводится период полупревращения (время, за которое концентрация реагирующего вещества уменьшается на 50%)
![]() .
.
Если
![]() ,
то
,
то
![]()
![]() .
Период полупревращения 1-го порядка не
зависит от концентрации.
.
Период полупревращения 1-го порядка не
зависит от концентрации.
2 Порядок
![]() ,
,
![]() .
.
![]()
![]()
![]() .
.
Если
=0,
то С=С0.
![]() ,
,
![]() ,
,
![]() .
.
Если
,
а С=0.5С0, то
![]() .
Период полупревращения зависит от С.
.
Период полупревращения зависит от С.
![]() .
.
![]() .
.
Реакции 3 порядка.
Порядок реакции это сумма показателей степеней, при которых концентрации входят в ЗДМ. A+B+D E. 3A B.
![]() .
.
Если
![]() ,
то
,
то
 .
.
Если
![]() ,
то
,
то
![]() .
Зависит от С.
.
Зависит от С.
Реакции n-ого порядка
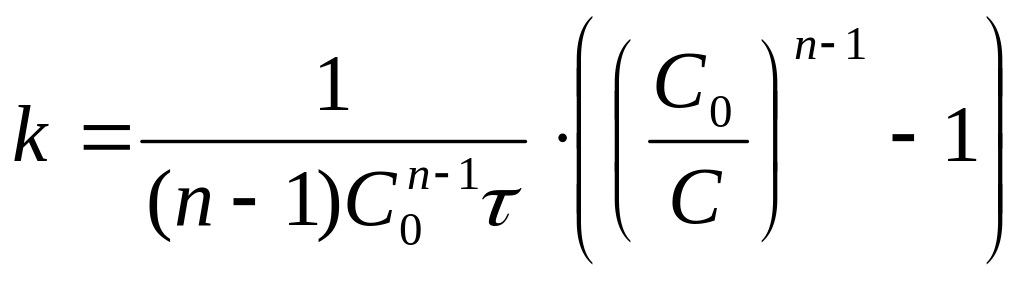 .
.
![]() .
.
Реакции 0-го порядка – это реакции, в которых скорость хим. реакции не зависит от С.
![]() .
.
При
![]()
![]()
При
![]()
![]() - зависит от С.
- зависит от С.
Закономерности протекания сложных реакций
Сложные – порядок не совпадает с числом молекул веществ, участвующих в суммарном уравнении реакций. Закономерности таких реакций определяются правилом независимого протекания Вильгельма: При одновременном протекании нескольких реакций, каждая из них протекает независимо и подчиняется закону действующих масс.
Последовательные реакции. Если
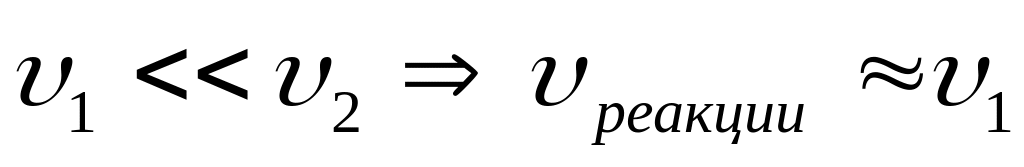
Параллельные
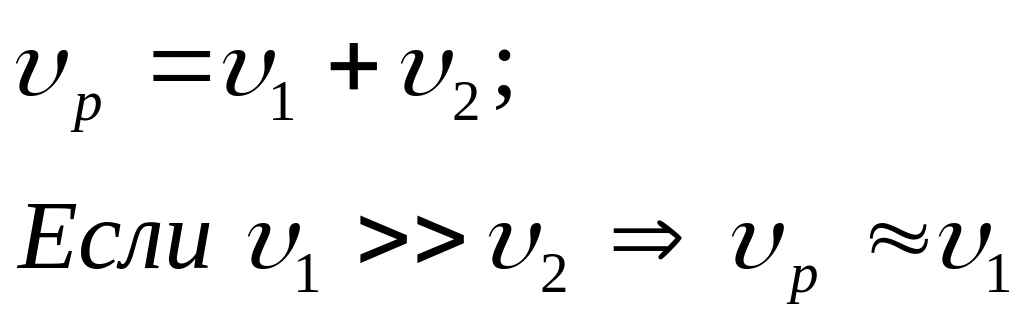
Двусторонние (обратные)
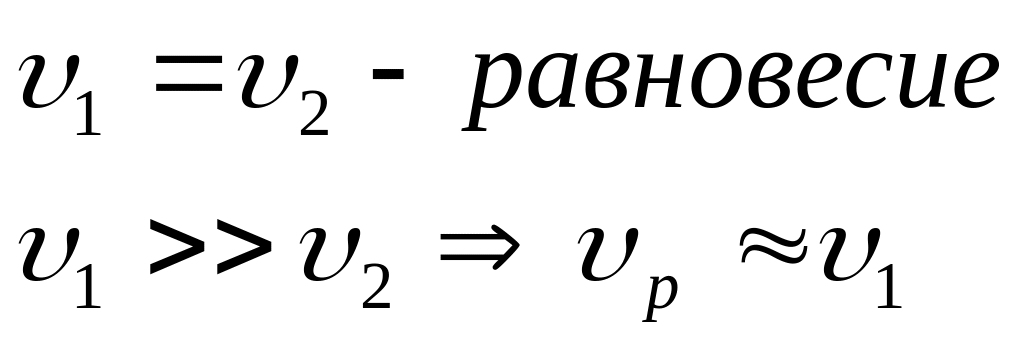
Способы определения порядка реакции
По постоянству k.
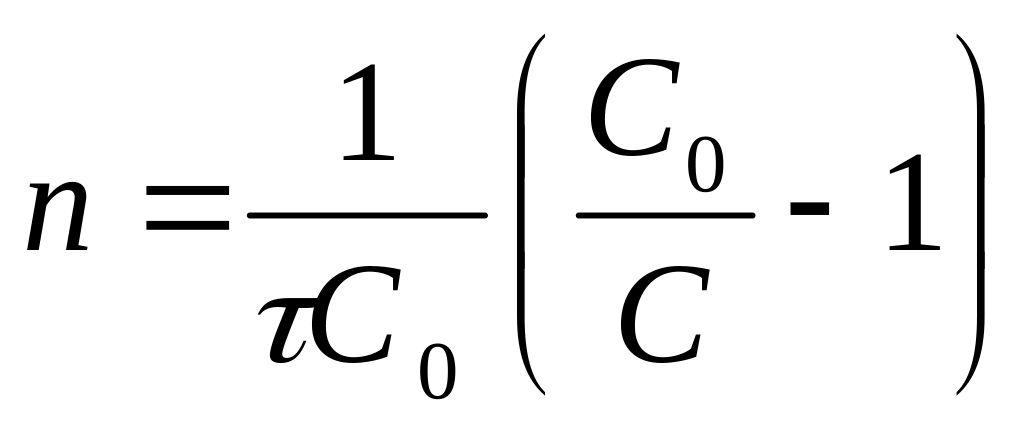
Способ расчета n при равенстве С исходных веществ:
а) Графический метод (выбирается система координат, дающая прямолинейную зависимость С во время
б) Аналитический метод. Определяется n
по
![]() .
.
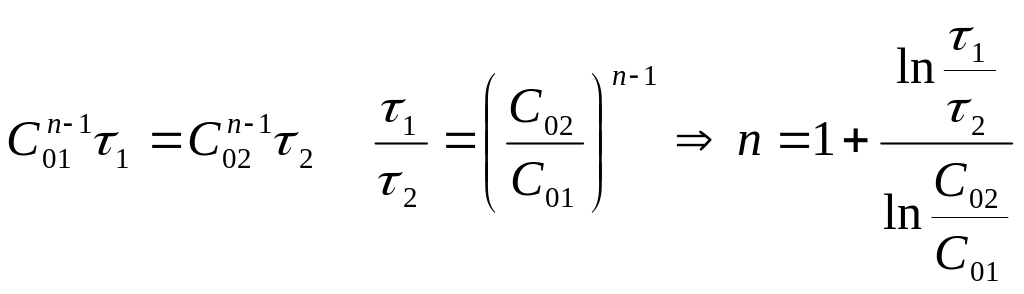
Для определения n, задаются 2 различными исходными С.
По скорости химической реакции (метод Вантгоффа)
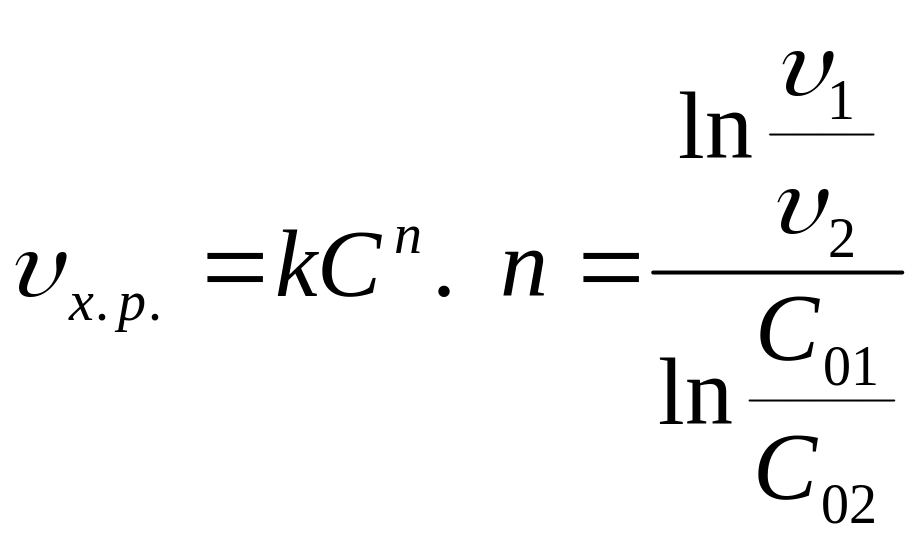 .
При определении скорости хим. реакции
обычно используют средние концентрации
и средние скорости.
.
При определении скорости хим. реакции
обычно используют средние концентрации
и средние скорости.
Если в результате расчета не получаются целые порядки, то обычно принимают ближайшее целое число.
Метод понижения порядка реакции. Для определения порядка сложной реакции обычно определяется порядок реакции по каждому из реагирующих веществ, для чего задаются избытком все остальные вещества.
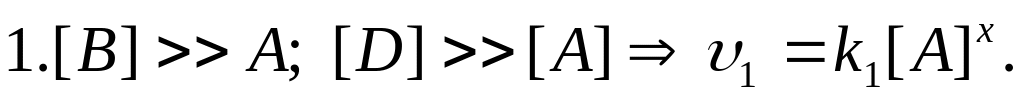
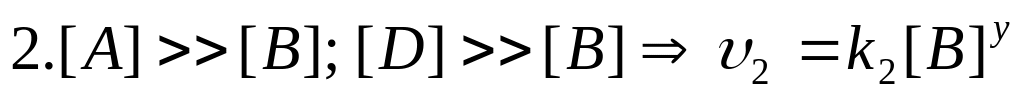 .
.
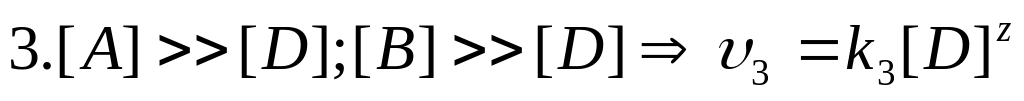 .
.
n=x+y+z
Влияние Т на скорость химической реакции.
Зависимость
![]() от Т проявляется через k.
(Сванге-Арениус).
от Т проявляется через k.
(Сванге-Арениус).
![]() .
.
Еакт – минимальная Е, по сравнению
со средней энергией теплового движения
молекул, необходимую для начала химической
реакции
![]() .
.
![]() предэкспоненциальный множитель,
зависящий от природы реагирующих
веществ, способа соударения молекул и
частоты соударений.
предэкспоненциальный множитель,
зависящий от природы реагирующих
веществ, способа соударения молекул и
частоты соударений.
Еакт определяется 2 способами: 1)
аналитически
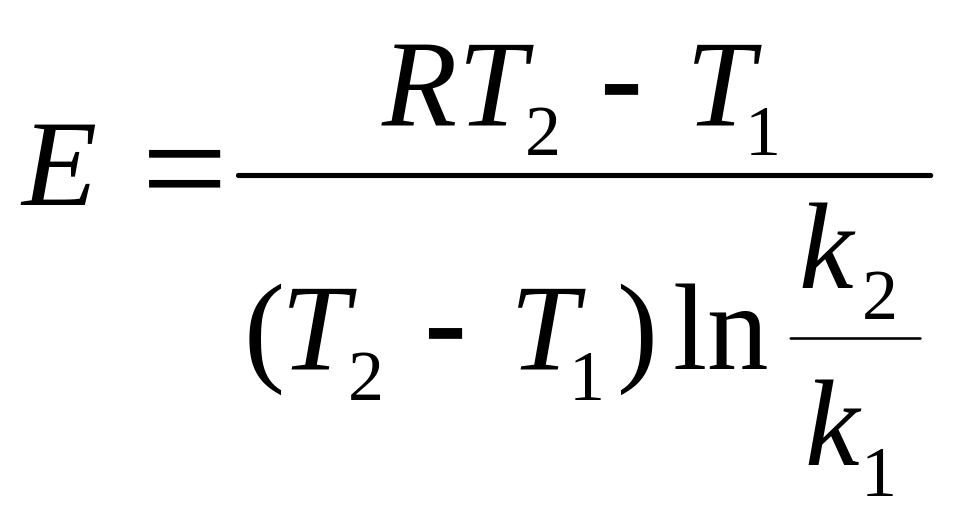 ;
2) графически.
;
2) графически.
Если Еакт зависит от Т, то данная
реакция сложная и Еакт кажущаяся.
Также это указывает на то, что реакция
сложная и рассмотренный механизм не
является истинным. В растворах Еакт
![]() .
Для реакций между веществами с ковалентными
химическими связями Еакт>120 кДж.
Для реакций, протекающий со скоростью
Еакт,
.
Для реакций между веществами с ковалентными
химическими связями Еакт>120 кДж.
Для реакций, протекающий со скоростью
Еакт,
![]() кДж.
кДж.
Правило Вант-Гоффа:
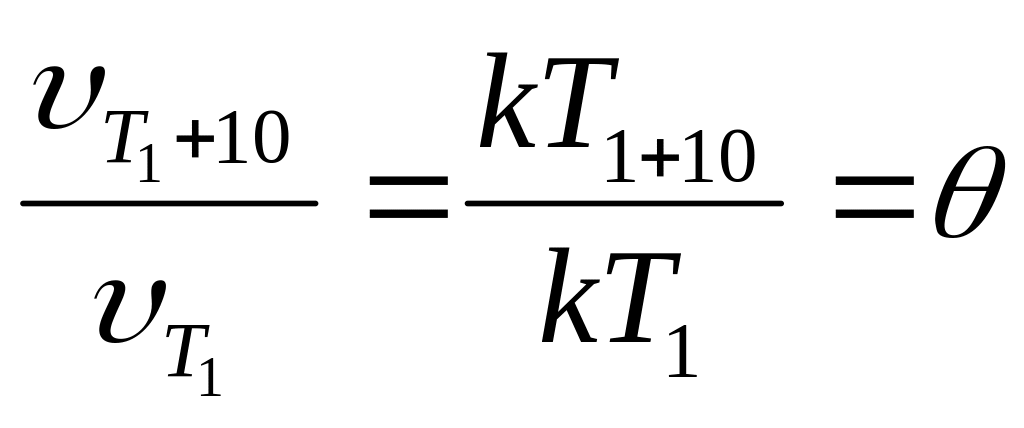 (температурный коэффициент)
(температурный коэффициент)
При нагревании системы число активных
молекул растет примерно в
![]() раза.
раза.
Влияние катализаторов на скорость химической реакции.
Катализ – изменение
![]() в присутствии катализатора.
в присутствии катализатора.
Катализатор – вещество, участвующее в промежуточных взаимодействиях и восстанавливающее свой первоначальный вид в конце реакции. Катализаторы делят по агрегатному состоянию на:
а) Гомогенные (катализатор и взаимодействующие вещества находятся в одной фазе);
б) Гетерогенные (катализатор и взаимодействующие вещества находятся в разных фазах).
Для улучшения свойств катализатора используют специальные добавки – промоторы.
Если катализатор ускоряет процесс, то катализ положительный.
В некоторых химических процессах катализатором могут быть продукты реакции, в таком случае процесс называют автокаталитическим.
Важное свойство катализаторов – селективность (способность из нескольких возможных реакций ускорять нужную)
Еще не вскрыт механизм некоторых катализаторов. Существует несколько теорий гетерогенного катализа: 1) теория мультиплетная Баландина; 2) Теория активных ансамблей; 3) Теория полупроводниковая Волькенштейна.
Все теории едины в одном: 1) В присутствии катализаторов реакции протекают по другому пути, требующему меньшей Еакт. 2) В присутствии катализаторов образуются промежуточные вещества, соединяющиеся с катализатором, которые в результате рекомбинации атомов или взаимодействии с другими веществами образуют продукты реакции, а катализаторы восстанавливают свой первоначальный вид.
