
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Физика колебаний и волн
- •Тема 4. Механические колебания
- •Молекулярная физика и термодинамика. Кинематика и динамика жидкостей и газов Лекция 5
- •Тема 5. Основы молекулярной физики
- •5.1. Предмет и метод молекулярной физики. Кинетическая теория
- •Тема 6. Физические основы термодинамики
Тема 6. Физические основы термодинамики
Лекция 6. Физические основы термодинамики
6.1. Основные понятия и определения
Термодинамика — это наука о закономерностях превращения одних видов энергии в другие. Значение термодинамики состоит в том, что она устанавливает принципы наиболее эффективного и оптимального преобразования энергии. Этим термодинамика дает ответ на вопрос, как нужно организовать рабочий процесс в тепловом двигателе, чтобы КПД его был максимальным.
Термодинамической системой называют совокупность макроскопических тел, находящихся в энергетическом (механическом и тепловом) взаимодействии друг с другом и другими телами, окружающими их, а также обменивающихся друг с другом веществом.
Любое взаимодействие в системе связано с энергетическими затратами, и каждое из них имеет хвою, только ему присущую причину, называемую обобщенной силой или потенциалом воздействия, и каждое воздействие приводит к изменению только ему присущей величины, которая называется обобщенной координатой или индикатором воздействия. Воздействие возможно при наличии разности потенциалов данного взаимодействия. Необходимо четко определять обобщенную силу и обобщенную координату каждого взаимодействия. При термическом взаимодействии это соответственно абсолютная температура и энтропия.
Механическое взаимодействие между телами осуществляется посредством механических сил, например сил давления, электромагнитных и др. Тепловое взаимодействие состоит в передаче теплоты. Обмен веществом — в переносе вещества через границы области, занимаемой телом. Все, что не входит в термодинамическую систему, но может оказывать на нее воздействие - объединяется понятием окружающей среды.
В термодинамике производится сопоставление рассматриваемой системы с окружающей средой, изучаются взаимодействия как внутри системы, так и между системой и окружающей средой. Если между системой и окружающей средой возможны все три типа взаимодействия, система называется открытой. В закрытой системе обмен веществом с другими системами отсутствует. Адиабатной называют систему, в которой отсутствует теплообмен с.другими системами. Адиабатными могут быть как открытая, так и закрытая системы. Система, не взаимодействующая с окружающей средой или другими системами ни энергетически, ни веществом, называется изолированной.
Различают термодинамические системы: однородные (однофазные), или гомогенные, и неоднородные (многофазные), или гетерогенные. Гомогенные системы имеют одинаковые или непрерывно и равномерно изменяющиеся химический состав и физические свойства. Например, газ, находящийся в баллоне; атмосферный воздух, давление которого изменяется непрерывно jio высоте; чистые, без сажи, продукты сгорания.
Гетерогенная система состоит из двух или более гомогенных областей, называемых фазами. На границах фаз скачкообразно изменяются химический состав или физические свойства вещества. Например, гетерогенная система из воды и льда имеет одинаковый химический состав, но разные физические свойства, а гетерогенная система из воды и куска сливочного масла — и разный состав, и разные свойства.
Совокупность физических свойств термодинамической системы в рассматриваемых условиях называют состоянием системы. Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами: давление — Р, удельный объем — v, температура— Т, внутренняя энергия — и, энтальпия — h, энтропия — s и др. Параметры, не зависящие от размеров системы (ее протяженности, массы), например температуру, давление, называют интенсивными, зависящие же, например объем, энтальпию, энтропию, — экстенсивными или аддитивными.
Если параметры с течением времени не изменяются, то состояние системы называется стационарным.
Состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты, называют равновесным. В 'противном случае состояние называют неравновесным. Состояние системы, при котором во всех её частях температура одинакова, называют термическим равновесием, при одинаковом во всех частях давлении — механическим равновесием.
При подводе или отводе энергии происходит изменение состояния термодинамической системы, то есть происходит изменение значений термодинамических параметров. Изменение состояния системы, характеризуемое изменением термодинамических параметров, называют термодинамическим процессом.
Равновесным называют процесс, представляющий собой непрерывный ряд последовательных равновесных состояний. Другими словами, равновесными считают процессы, при которых в каждый момент времени во всех точках системы одноименные параметры имеют одинаковые значения. Процесс, при котором система проходит через неравновесные состояния, называют неравновесным. Будем изучать только классическую термодинамику, рассматривая «как будто бы равновесные» процессы, по-гречески — «квазистатические», хотя все реальные процессы неравновесны, так как протекают с конечной скоростью и, следовательно, равновесие не успевает установиться во всей системе.
Энергия есть единая мера различных форм движения материи, она характеризует способность систем совершать работу.
Вещество, с помощью которого в тепловой машине совершается работа, называется рабочим телом. Рабочее тело должно обладать способностью к значительному расширению и сжатию. В качестве рабочего тела теоретически можно использовать любое вещество, обладающее этими свойствами. Практическое же применение получили только парогазовые вещества, которые под воздействием давления и при нагревании изменяют свой объем значительно сильнее, чем жидкие и твердые. Это дает возможность получить от них большую работу, чем от жидкостей и твердых тел. Конкретный выбор рабочего тела определяется типом и назначением машины.
Газ, молекулы которого не взаимодействуют друг с другом и имеют размеры значительно меньше, чем расстояние между ними, называется идеальным газом. Если указанные условия не выполняются, газ считается реальным. Введение понятия идеального газа в термодинамику дает возможность найти более простые аналитические зависимости между параметрами. Степень расхождения в свойствах идеальных и реальных газов зависит всякий раз от конкретных условий, в которых находится газ. Водород, азот, гелий и другие газы с малой молярной массой при комнатной температуре и атмосферном давлении ведут себя, как идеальные газы. Поэтому законы идеального газа во многих случаях могут применяться для расчета реальных газов.
6. 2. Термические параметры и функции состояния
Физические величины, характеризующие состояние системы и поддающиеся непосредственному измерению, называются параметрами состояния. В качестве основных параметров состояния удобно выбирать интенсивные величины, которые характеризуют конкретное тепловое состояние вещества и поэтому называются также термическими параметрами состояния. Основными параметрами состояния принято считать абсолютное давление, температуру (п. 5.3 и 5.4) и удельный объем. Объем тела V является экстенсивной величиной, он зависит от массы тела. Удельный объем тела представляет объем единицы массы (1 кг) данного вещества и становится интенсивной величиной, не зависящей от массы:
![]()
Таким
же параметром состояния может быть и
плотность вещества
— масса единицы объема
![]() , кг/м3.
Для удобства
сопоставления удельных объемов или
плотностей принято приводить их к
одинаковым условиям. Наибольшее
распространение
имеют так называемые нормальные
физические условия,
которым соответствуют нормальное
давление в 1 физическую атмосферу и
нормальная температура 0 °С. Объем,
измеренный
в этих условиях, обозначают — VН,
м3.
, кг/м3.
Для удобства
сопоставления удельных объемов или
плотностей принято приводить их к
одинаковым условиям. Наибольшее
распространение
имеют так называемые нормальные
физические условия,
которым соответствуют нормальное
давление в 1 физическую атмосферу и
нормальная температура 0 °С. Объем,
измеренный
в этих условиях, обозначают — VН,
м3.
Термодинамические параметры со сложной физической природой, характеризующие, как и параметры состояния, состояние термодинамической системы, называются функциями состояния системы. Наиболее широко используются в термодинамике следующие функции состояния:
внутренняя энергия U, Дж; u, Дж/кг;
энтальпия Н, Дж; h, Дж/кг;
энтропия S, Дж/К; s, Дж/(кг • К);
изохорно-изотермический потенциал или свободная энергия F = U - TS, Дж;
изобарно-изотермический потенциал или свободная энтальпия Ф = Н - TS, Дж; удельный изобарно-изотермический потенциал или химический потенциал = h — Ts, Дж/кг.
Значение перечисленных функций состояния можно определить расчетом только через параметры состояния. Поэтому их и называют функциями состояния.
Всякая система в определенных условиях обладает некоторым запасом полной энергии Е, которая складывается из внутренней и внешней, каждая из них, в свою очередь, состоит из кинетической и потенциальной.
Внутренняя
кинетическая энергия обусловлена
тепловым хаотическим
движением молекул, и это свойство
непосредственно
связано с температурой. Этот вид
внутренней энергии складывается
из кинетической энергии наступательного
—U![]() ,
вращательного
—
,
вращательного
—
![]() и
колебательного —
и
колебательного —
![]() движения
микрочастиц
системы. Внутренняя потенциальная
энергия зависит
от взаимодействия молекул друг с другом,
внутриатомных
и внутриядерных процессов.
движения
микрочастиц
системы. Внутренняя потенциальная
энергия зависит
от взаимодействия молекул друг с другом,
внутриатомных
и внутриядерных процессов.
Внешняя энергия представляет собой кинетическую энергию движения системы относительно других систем или тел окружающей среды тс2/2 и потенциальную энергию внешних
силовых
полей
![]() .
.
Потенциальная
энергия![]() ,
внешних силовых полей, рассматриваемая
в термодинамике, состоит:
,
внешних силовых полей, рассматриваемая
в термодинамике, состоит:
1) из потенциальной энергии Пr положения системы в поле гравитационных сил, равной произведению ускорения свободного падения g на высоту h расположения центра тяжести рассматриваемого рабочего тела массой m кг, от условного уровня отсчета, то есть Пr = mgh; 2) потенциальной энергии Пэм рабочего тела, находящегося в электромагнитном поле (прохождение электропроводящего газа через электромагнитное поле, сопровождаемое непосредственным превращением части его полной энергии в электрическую, — имеет место в магнитогидродинамическом генераторе); 3) потенциальной энергии давления Пд, равной произведению давления на объем ПД= PV, называемой работой проталкивания.
Следовательно,
(6.1)
Поскольку в энергетических установках летательных аппаратов электромагнитные поля не принимают участия в преобразовании энергии, величину Пэм в дальнейшем не учитываем. В большинстве случаев в термодинамике гравитационная составляющая потенциальной энергии системы не рассматривается, так как ее изменение в процессах мало. Окончательно уравнение для полной энергии термодинамической системы имеет вид
(6.2)![]() , Дж.
, Дж.
Потенциальная энергия давления (работа проталкивания) и кинетическая энергия системы имеют существенное значение при термодинамическом анализе потока газа. Поэтому основным понятием является внутренняя энергия.
Итак, внутренняя энергия может рассматриваться как одна из характеристик состояния термодинамической системы. Однако для термодинамического анализа процессов нет необходимости знать, из каких форм движения материи складывается внутренняя энергия, достаточно знать ее изменение в процессе.
Рассмотрим некоторые свойства внутренней энергии.
1. Внутренняя энергия является функцией состояния, изменение ее не зависит от характера термодинамического процесса, а определяется начальным и конечным состояниями системы. В связи с этим внутренняя энергия реального газа может быть представлена как функция любой пары параметров состояния:
(6.3)

![]()
Для
круговых процессов 1m2k1
и
1п2к1
можно
записать![]()
![]()
Значит, величина и не зависит от характера термодинамического процесса, а определяется начальным и конечным состояниями системы. Из математического анализа известно, что если значение криволинейного интеграла не зависит от пути интегрирования, а определяется лишь начальной и конечной точками интегрирования, то подынтегральное выражение представляет собой полный дифференциал. Поскольку из рассмотренного примера следует, что криволинейный интеграл от внутренней энергии (и любой другой функции состояния) не зависит от пути интегрирования, то дифференциал внутренней энергии (и любой другой функции состояния) является полным. Соответственно в переменных уравнения (6.3) полный дифференциал внутренней энергии реального газа равен:
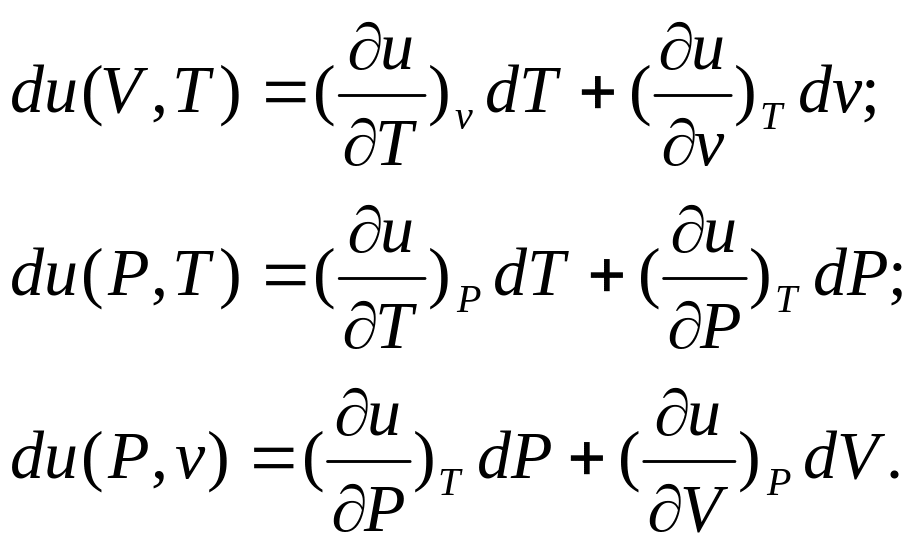 (6.4)
(6.4)
С точки зрения приложений термодинамики наибольший интерес представляет внутренняя энергия в переменных v и Т.
2.
Внутренняя энергия идеального газа
зависит только от температуры.
Это свойство внутренней энергии
идеального газа вытекает
из опыта Гей-Люссака и полученного из
него закона Джоуля:
![]() то
есть внутренняя энергия идеального
газа не зависит от объема и
давления.
то
есть внутренняя энергия идеального
газа не зависит от объема и
давления.
3.
Внутренняя энергия является экстенсивным
свойством системы.
Для системы, состоящей из «n»
макротел с соответственно
удельными значениями внутренней энергии
![]() ее
внутренняя энергия
ее
внутренняя энергия
![]() Для
однородной системы массой m
кг:
U
=
ти,
Дж.
Для
однородной системы массой m
кг:
U
=
ти,
Дж.
Термодинамика оперирует не абсолютными значениями внутренней энергии, а ее изменениями.
Внутренняя энергия может быть выражена в массовых, объемных и мольных единицах измерения.
Для случая открытой системы в виде потока вещества, движущегося с малой скоростью так, что можно пренебречь его кинетической энергией, согласно уравнению (6.2), полная энергия складывается из внутренней энергии системы и потенциальной энергии давления PV. Тогда сумма внутренней энергии и потенциальной энергии давления (работы проталкивания) составляет новую физическую величину, называемую энтальпией, реже, тепловой функцией Гиббса:
Н=U+PV,Дж,
h=и+pv,Дж/кг.
Следовательно, энтальпия есть полная энергия рабочего тела в потоке (открытой системе), определяемая количественно термодинамическим состоянием тела.
П отенциальная
энергия Pv
представляет
собой удельную работу проталкивания,
которую
нужно затратить, чтобы систему с
удельным объемом v
ввести в среду с давлением
Р.
Пример:
хотим втолкнуть газ в цилиндр.
Нужно затратить работу вталкивания,
которая пойдет на увеличение потенциальной
энергии груза массой m
(масса поршня
не учитывается): PV
= mg
.
Здесь
—
высота,
на которую поднимается поршень. Энтальпия,
как и внутренняя энергия, и
работа проталкивания, называемая еще
работой вытеснения, является энергетической
функцией состояния,
более полной, чем внутренняя энергия.
Итак, энтальпия — есть полная энергия
вещества в потоке (открытой системе),
движущегося с малой скоростью.
отенциальная
энергия Pv
представляет
собой удельную работу проталкивания,
которую
нужно затратить, чтобы систему с
удельным объемом v
ввести в среду с давлением
Р.
Пример:
хотим втолкнуть газ в цилиндр.
Нужно затратить работу вталкивания,
которая пойдет на увеличение потенциальной
энергии груза массой m
(масса поршня
не учитывается): PV
= mg
.
Здесь
—
высота,
на которую поднимается поршень. Энтальпия,
как и внутренняя энергия, и
работа проталкивания, называемая еще
работой вытеснения, является энергетической
функцией состояния,
более полной, чем внутренняя энергия.
Итак, энтальпия — есть полная энергия
вещества в потоке (открытой системе),
движущегося с малой скоростью.
Рассмотрим некоторые свойства энтальпии.
1.
Энтальпия является функцией состояния,
изменение ее не
зависит от характера термодинамического
процесса, а определяется
начальным и конечным состоянием системы.
Бесконечно
малое изменение энтальпии является
полным дифференциалом.
В круговом процессе
![]() = 0 .
= 0 .
Энтальпия реального газа, как и внутренняя энергия, может быть представлена в виде функции от любой пары параметров состояния:
(6.5)
Аналогичными рассуждениями, что и для внутренней энергии, придем к выводу о том, что изменение энтальпии не зависит от характера термодинамического процесса, а бесконечно малое изменение энтальпии является полным
дифференциалом: (6.6)
(6.6)
![]()
C точки зрения приложений термодинамики наибольший интерес представляет энтальпия в переменных Р и Т.
2.Энтальпия идеального газа зависит только от температуры. Это свойство энтальпии идеального газа вытекает из опыта Гей-Люссака и полученного из него закона Джоуля:
![]()
то есть энтальпия идеального газа не зависит от объема и давления.
3.Энтальпия
является Интенсивным свойством системы.
Для
системы, состоящей из п
макротел
с удельными значениями![]() ее энтальпия:
ее энтальпия:
![]()
Для однородной системы, массой т кг: Н = т h, Дж.
Термодинамика оперирует не абсолютными значениями энтальпии, а ее изменениями.
Энтальпия может быть выражена в массовых, объемных. и мольных единицах измерения.
6.3. Уравнение состояния идеального газа
Вспомним
закон Авогадро для идеального газа,
известный из
школьного курса физики. Закон этот нужен
для получения уравнения
состояния идеального газа. Формулируется
закон Авогадро
следующим образом: в разных газах
одинакового объема
при одинаковой температуре и давлении
находится одинаковое
число молекул. На основе этого закона
доказывается,
что для разных газов при одном и том же
давлении и одной и
той же температуре произведение молярной
массы газа на его удельный объем является
одной и той же величиной![]() ,
называемой
молярным объемом, который при нормальных
физических
условиях равен 22,414 м3Н/кмоль.
Из закона Авогадро
следует, что при одинаковых условиях
(Р
=
const
и
Т=
const)
молярные
объемы любых газов одинаковы.
,
называемой
молярным объемом, который при нормальных
физических
условиях равен 22,414 м3Н/кмоль.
Из закона Авогадро
следует, что при одинаковых условиях
(Р
=
const
и
Т=
const)
молярные
объемы любых газов одинаковы.
Молярный
объем может быть определен ив виде
отношения
объема газа к числу молей:![]() .
Это
следует из понятия
молярной массы вещества как отношения
его массы т
= N
то,
кг (где то
— масса
одной структурной частицы) к числу
vn
молей:
=
т/
.
Это
следует из понятия
молярной массы вещества как отношения
его массы т
= N
то,
кг (где то
— масса
одной структурной частицы) к числу
vn
молей:
=
т/![]() ,
кг/моль.
Тогда
,
кг/моль.
Тогда
(6.7)![]() ,
м3/моль.
,
м3/моль.
Все реальные газы несколько отклоняются от закона Авогадро. Однако для подавляющего большинства технических расчетов закон Авогадро достаточно точен.
Параметры Р, v, T состояния газа связаны между собой определенной зависимостью, которая аналитически выражается равенством F(P, v, T) = 0, называемым уравнением состояния газа в общем виде. Конкретная аналитическая форма уравнения состояния может быть установлена теоретическим путем на основании представления молекулярно-кинетической теории газов о давлении Р = пкТ, Па.
Поскольку
число молекул в единице объема n=
N/V,
то
предыдущее уравнение можно записать в
виде: Р
=
(N/V)kT.
Так
как число молей vn
определяется отношением рассматриваемого
числа N
структурных
микрочастиц к числу Авогадро: vn
=
N/NA,
то
N
= vnNA.
С
учетом этого предыдущее равенство можно
записать в виде PV
= vnNA
kT.
Откуда
P(V/vn)
=
kNAT.
Согласно
(6.7) V/vn
=![]() ,
а произведение двух констант k*NA
=
1,38*10 -23*6,022*1023
= 8,314 Дж/(мольК)=8314 Дж / (кмольК)= =
8,314 кДж / (кмольК) называют универсальной
газовой постоянной.
Используя изложенное, получим уравнение
состояния
для одного моля идеального газа
,
а произведение двух констант k*NA
=
1,38*10 -23*6,022*1023
= 8,314 Дж/(мольК)=8314 Дж / (кмольК)= =
8,314 кДж / (кмольК) называют универсальной
газовой постоянной.
Используя изложенное, получим уравнение
состояния
для одного моля идеального газа
.![]() (6.8)
(6.8)
(6.9)
PV = RT,
а для m кг идеального газа
PV = mRT. (6.10)
Постоянную R называют характеристической или индивидуальной газовой постоянной идеального газа. Физическое содержание индивидуальной и универсальной газовых постоянных состоит в том, что они представляют собой работу, совершаемую соответственно 1 кг и 1 моль рабочего тела при изменении температуры на 1 К в изобарном процессе.
Реальные газы, применяемые в технике при не очень высоких давлениях (до 10—30 бар), достаточно точно подчиняются уравнению Клапейрона, и поэтому последнее широко применяется в технике для термодинамических расчетов.
Например, можно рассматривать, как идеальный газ воздух в большинстве теплосиловых установок (давление до 100 бар, температуры от 50 до 1000 °С); водяной пар и хладагенты, типа фреонов, только при очень низких давлениях не выше 1-2 бар и при высоких температурах.
6.4. Первый закон термодинамики
Физика изучает закономерности различных форм движения материи. Общая количественная мера движения при его превращении из одного вида в другой называется энергией. Какие бы процессы в мире ни происходили, какие бы превращения форм движения ни совершались, всегда общее количество энергии остается неизменным.
Первый закон термодинамики есть не что иное, как фундаментальный закон сохранения и превращения энергии, представленный в форме, удобной для термодинамического анализа. Закон сохранения и превращения энергии играет важнейшую роль во всем естествознании, в том числе и в термодинамике, так как относится к неотъемлемому свойству материи.
Процесс передачи энергии направленного движения микрочастиц от рассматриваемого тела к другим телам и наоборот представляет собой работу L, Дж. Процесс отдачи или восприятия энергии хаотического молекулярного и внутримолекулярного движения называется теплотой, а количество переданной энергии — количеством теплоты Q, Дж. Другие формы передачи энергии не известны. Таким образом, принимается, что теплота и работа являются двумя единственно возможными формами передачи энергии.
Если в начальном состоянии рассматриваемая система имела полную энергию Е1, а в конце процесса Е2, то, согласно закону сохранения и превращения энергии,
(6.11)![]() .
.
Для удобства технических расчетов условно считают положительными теплоту, подводимую к телу, и работу, совершаемую над телом, то есть Q и L присваивают разные знаки, при этом уравнение (6.11) принимает вид:
![]() (6.12)
(6.12)
Индексы при Q и L указывают на принятую условность знаков. В дальнейшем эти индексы не будут использоваться. В соответствии с соотношением (6.12) закон сохранения и превращения, энергии в применении к процессам, изучаемым в термодинамике, имеет следующую формулировку: разность между полученной извне теплотой и отведенной к окружающей среде работой равна изменению полной энергии рабочего тела (системы). Отводимая работа — это работа, которая производится тепловым двигателем, и называют ее технической, то есть Lотв= LT. Под технической работой понимают работу на валу двигателя: на коленчатом валу поршневого двигателя, на валу турбины, паровой или газовой.
Следует напомнить еще одну из формулировок первого закона — вечный двигатель первого рода невозможен. Вечный двигатель первого рода — это такой воображаемый механизм, который при наличии первоначального энергетического импульса способен безостановочно двигать сам себя и, кроме того, 'производить полезную работу.
6.5. Рабочая диаграмма Pv. Работа — функция процесса
Состояние рабочего тела однозначно определяется заданием каких-нибудь двух параметров состояния, например Р и v. Поэтому в координатной системе Pv каждой точке соответствует некоторое равновесное состояние, и каждому равновесному состоянию рабочего тела отвечает одна определенная точка на плоскости Pv. Всякая кривая, проведенная на плоскости .Pv, изображает термодинамический процесс. Температуру рабочего тела на этой диаграмме непосредственно определить нельзя. Она может быть вычислена по значению Р и v с помощью уравнения состояния. Поскольку каждая точка кривой процесса однозначно характеризует равновесное состояние рабочего тела, то на диаграмме состояний, каковой является диаграмма Pv, может быть изображен только равновесный процесс.
 На
рис. 6.3 показан процесс
расширения 1а2
(dv>0).
Начальное
состояние Р1
v1
характеризуется
точкой 1, а конечное
состояние P2v2
— точкой
2. Заштрихованная на
чертеже элементарная площадка
На
рис. 6.3 показан процесс
расширения 1а2
(dv>0).
Начальное
состояние Р1
v1
характеризуется
точкой 1, а конечное
состояние P2v2
— точкой
2. Заштрихованная на
чертеже элементарная площадка
![]() графически
изображает элементарную удельную работу
изменения объема.
Тогда удельная физическая работа
процесса 1а2
графически
изображает элементарную удельную работу
изменения объема.
Тогда удельная физическая работа
процесса 1а2

может быть представлена как площадь, ограниченная линией процесса, двумя крайними ординатами и осью абсцисс, то есть площадью Ia2v2v1l.
Из
рис. 6.3 видно, что при изменении
состояния рабочего тела
в заданных пределах, но по
другому закону, кривая 1в2, удельная
работа
![]() ,
изображается
уже иной площадью и имеет,
следовательно, иное значение,
в данном случае большее, то
есть площадью 1в2v2v1..
Таким
образом, физическая работа
зависит от характера процесса
и является, следовательно, функцией
процесса. Это свойство
работы имеет, принципиально важное
значение.
,
изображается
уже иной площадью и имеет,
следовательно, иное значение,
в данном случае большее, то
есть площадью 1в2v2v1..
Таким
образом, физическая работа
зависит от характера процесса
и является, следовательно, функцией
процесса. Это свойство
работы имеет, принципиально важное
значение.
Процесс, обратный, например, 2al (рис.6.3), будет представлять собой процесс сжатия, и удельная работа процесса, изображаемая той же штрихованной площадью 2а1v1v22 будет иметь отрицательный знак. При этом происходит подвод энергии к рабочему телу извне.
6.6. Молярная и удельная теплоемкости
Теплоемкостью называется количество теплоты, необходимое для повышения температуры тела на один кельвин. В зависимости от того, к какой количественной единице вещества подводится теплота, рассматривается молярная и удельная теплоемкость. Удельная теплоемкость — это количество теплоты, необходимое для повышения температуры 1 кг тела на 1 кельвин, иначе говоря, это теплоемкость, отнесенная к 1 кг вещества— с, Дж/(кг·К). Соответственно мольная теплоемкость — теплоемкость, отнесенная к одному молю— Сm, Дж/(моль·К.Соотношение между удельной и мольной теплоемкостями следующее:
Сm =с·М, (6.13)
где М – молярная масса тела.
Количество теплоты, подводимое к веществу с целью изменения его температуры на 1 К, зависит от характера термодинамического процесса. Поэтому значения теплоемкости в различных процессах различны, то есть теплоемкость является функцией термодинамического процесса, как и теплота.
6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
Итак, теплоемкость зависит от характера термодинамического процесса, при котором подводится или отводится теплота. При экспериментальном определении теплоемкости обычно используют два термодинамических процесса, протекающих при постоянном объеме — изохорная теплоемкость сv, и давлении — изобарная теплоемкость ср. Теплоемкость реального газа при постоянном объеме:
![]() (6.14)
(6.14)
Это соотношение может рассматриваться как определение изохорной теплоемкости сv. Оно показывает, что теплоемкость сv характеризует темп изменения внутренней энергии в изохорном процессе с изменением температуры.
Кроме того, из равенства (6.14) следует, что подведенная при постоянном объеме теплота расходуется только на изменение внутренней энергии
![]() qv=
duv=
cvdT.
qv=
duv=
cvdT.
Изменение внутренней энергии идеального газа равно произведению теплоемкости при постоянном объеме на разность температур в любом процессе. Действительно, для идеального газа, внутренняя энергия которого является функцией только температуры, частная производная (du/dv)T равна нулю — закон Джоуля. Тогда du = (ди/дТ)v dT или
du = cvdT, Дж/кг (6.15)
независимо от характера процесса. А теплоемкость идеального газа в изохорном процессе равна
cv= du/dT, Дж/(кг·К) (6.16)
и является функцией только температуры.
Теплоемкость реального газа при постоянном давлении:
![]()
или
![]() (6.17)
(6.17)
Соотношение
(6.17) устанавливает в общем виде связь
между
теплоемкостями ср
и cv
реального
газа. С
учетом того, что из уравнения состояния
Pv
= RT
при
R
— const
и Р = const
(dv/
![]() )р=
R/Р,
получим
)р=
R/Р,
получим
сР=cv +R (6.18)
Это уравнение носит название уравнения Р. Майера.
6.8. Молекулярно-кинетическая теория теплоемкости
Молекулярно-кинетическая теория теплоемкости является весьма приближенной, так как не рассматривает колебательной и потенциальной составляющих внутренней энергии. Поэтому, согласно этой теории, задача состоит в определении распределения подводимой к веществу тепловой энергии между поступательной и вращательной формами внутренней кинетической энергии. Согласно распределению Максвелла-Больцмана, если системе очень_ большого числа микрочастиц сообщить некоторое количество энергии, то она распределяется

Молекула одноатомного газа имеет три степени, свободы, так как ее положение в пространстве определяется тремя координатами, причем для одноатомного газа эти три степени свободы являются степенями свободы поступательного движения.
Для двухатомного газа значения трех координат одного атома еще не определяют положение молекулы в пространстве, так как после определения положения одного атома необходимо учитывать, что второй атом имеет возможность вращательного движения. Для определения положения в пространстве второго атома необходимо знать две его координаты (рис. 6.7), а третья же определится из известного в аналитической геометрии уравнения
![]()
где — расстояние между атомами. Таким образом, при известном из шести координат необходимо знать только пять. Следовательно, молекула двухатомного газа имеет пять степеней свободы, из которых три — поступательного и две — вращательного движения.
Молекула
трехатомного газа имеет шесть степеней
свободы
— три поступательного и три вращательного
движения. Это
следует из того, что для определения
положения в пространстве
необходимо знать шесть координат атомов,
а именно:
три координаты первого атома, две
координаты второго атома
и одну координату третьего. Тогда
положение атомов в пространстве
будет полностью определено, так как
расстояния между
ними
![]() -
заданы.
-
заданы.
Если взять газ большей атомности, то есть 4-атомный и более, то число степеней свободы такого газа будет равно также шести, так как положение четвертого и каждого следующего атома будет определяться фиксированным расстоянием его от других атомов.
Согласно
молекулярно-кинетической теории
вещества, средняя
кинетическая энергия поступательного
и вращательного движений
каждой из молекул пропорциональна
температуре и
равна соответственно![]() и
и
![]() .
Поэтому кинетическая энергия
поступательного и вращательного движений
всех молекул будет
линейной функцией температуры
.
Поэтому кинетическая энергия
поступательного и вращательного движений
всех молекул будет
линейной функцией температуры
![]() Дж, (6.19)
Дж, (6.19)
(6.20)![]() Дж.
Дж.
Уравнения (6.19) и (6.20) выражают упомянутый закон равнораспределения энергии по степеням свободы, согласно которому на каждую степень свободы поступательного и вращательного движений молекул приходится одна и та же средняя кинетическая энергия, равная 1/2 (кТ).
Энергия колебательного движения молекул представляет собой сложную возрастающую функцию температуры и только в отдельных случаях при высоких температурах может быть приближенно выражена формулой, аналогичной (6.20). Молекулярно-кинетическая теория теплоемкости не учитывает колебательного движения молекул.
Между
двумя молекулами реального газа действуют
силы отталкивания
и притяжения. Для идеального газа
потенциальная
энергия взаимодействия молекул
отсутствует. С учетом изложенного
внутренняя энергия идеального газа
равна U=![]() .
Так
как N=vnNA
,то
.
Так
как N=vnNA
,то
![]() Внутренняя энергия одного моля идеального
газа при условии, что универсальная
газовая постоянная определяется
произведением двух констант: R=
kNA,
определяется
следующим образом:
Внутренняя энергия одного моля идеального
газа при условии, что универсальная
газовая постоянная определяется
произведением двух констант: R=
kNA,
определяется
следующим образом:![]() ,Дж/моль.
,Дж/моль.
Продифференцировав по Т и зная, что du /dT = Cv, получим мольную теплоемкость идеального газа при постоянном объеме
![]() (6.21)
(6.21)
Коэффициент
![]() называется коэффициентом
Пуассона или показателем адиабаты.
называется коэффициентом
Пуассона или показателем адиабаты.
Из
уравнения Майера Cv=Cp+R
получим
выражение для мольной
теплоемкости идеального газа при
постоянном давлении
![]() ,
Дж/(моль·К) (6.22).
,
Дж/(моль·К) (6.22).
6.9. Обратимые и необратимые термодинамические процессы
 Можно
рассмотреть ряд процессов, протекание
которых естественным
(самопроизвольным)
путем возможно только в одном на
правлении, хотя возможность протекания
их в обратном направлении не противоречит
первому закону термодинамики. Например:
1.Теплообмен между двумя телами
при Т1
> Т2
(рис.
6.8). Теплота переходит самопроизвольно
от
горячего тела к холодному. Энергия при
этом не исчезает, но самопроизвольный
обратный процесс
невозможен. Это значит, что горячая
печка может греть холодный чайник, но
холодный чайник не может греть печку.
Можно
рассмотреть ряд процессов, протекание
которых естественным
(самопроизвольным)
путем возможно только в одном на
правлении, хотя возможность протекания
их в обратном направлении не противоречит
первому закону термодинамики. Например:
1.Теплообмен между двумя телами
при Т1
> Т2
(рис.
6.8). Теплота переходит самопроизвольно
от
горячего тела к холодному. Энергия при
этом не исчезает, но самопроизвольный
обратный процесс
невозможен. Это значит, что горячая
печка может греть холодный чайник, но
холодный чайник не может греть печку.
Р
 асширение
газа в окружающую среду с меньшим
давлением
Р
> Рос
(рис. 6.9). Обратный процесс самопроизвольно
осуществлен
быть не может. При наличии компрессора
— да. Но
это будет уже процесс с дополнительной
затратой энергии.
асширение
газа в окружающую среду с меньшим
давлением
Р
> Рос
(рис. 6.9). Обратный процесс самопроизвольно
осуществлен
быть не может. При наличии компрессора
— да. Но
это будет уже процесс с дополнительной
затратой энергии.Диффузия газов при одинаковом давлении. Газы смешиваются самопроизвольно, суммарная внутренняя энергия при этом не меняется. Разделение газов самопроизвольно невозможно.
Сопротивление трения. При трении работа самопроизвольно превращается в теплоту. Обратный процесс невозможен.
Во всех случаях процессы «идут» в сторону меньшего потенциала воздействия. Обратный путь возможен только при дополнительной затрате энергии. Такой процесс, который может самопроизвольно протекать только в одном направлении, называют необратимым процессом. Обратимым процессом называют такой процесс, который способен происходить как в прямом, так и в обратном направлении, причем при возвращении в первоначальное состояние (при изменении внешних условий в противоположной последовательности) система проходит все равновесные состояния прямого процесса, но в обратном порядке и за счет только энергетического эффекта, полученного в прямом процессе. В изолированной термодинамической системе обратимые процессы можно осуществить при выполнении следующих условий:
Термодинамическая система должна находиться в состоянии механического и теплового равновесия, то есть давление и температура рабочего тела в каждом состоянии прямого и обратного процессов должны быть неизменными. Это возможно только при бесконечно медленном протекании процесса, то есть процессы, протекающие в системе, Должны быть равновесными.
Прямой и обратный процессы должны осуществляться без трения. При наличии трения часть энергии рабочего тела расходуется на работу трения, которая преобразуется в теплоту и рассеивается в трущихся элементах. Таким образом, теплота, полученная газом от внешней системы (теплоотдатчика) в прямом процессе расширения, не может быть полностью возвращена ему в обратном процессе сжатия, что не позволит Рабочему телу вернуться в исходное состояние.
В процессе теплообмена должно соблюдаться равенство температур теплоотдатчика и рабочего тела в продолжение всего процесса.
4.При осуществлении прямого и обратного процессов рабочее тело не должно подвергаться химическим изменениям.
При несоблюдении этих условий процессы будут необратимы. Все действительные процессы, протекающие в тепловых двигателях и вообще в природе, являются необратимыми, так как они неравновесны, сопровождаются трением, химическими превращениями и тепловыми потерями. Всякий необратимый процесс сопровождается потерей работоспособности рабочего тела, обесцениванием энергии для потребителя, ее деградацией. При трении механическая работа превращается в малоценную теплоту трения, низкопотенциальную внутреннюю энергию. Однако с целью упрощения исследования термодинамических процессов реальные процессы считаются обратимыми. Другими словами, в термодинамике в дальнейшем будут рассматриваться только такие процессы, в, которых разность потенциалов равна нулю. Такую термодинамику называют равновесной.
Рассмотрим реальную макросистему, состоящую из механических, электромагнитных, химических и других элементов, обладающих, что вполне естественно для реальных систем, трением, электрическим сопротивлением, теплопроводностью. В каждом звене такой системы различные формы движения материи превращаются в тепловую. А это превращение принципиально отличается от остальных тем, что. оно никогда не может быть полностью обратимым. По этой причине движение в каждом из элементов системы будет затухать и тем быстрее, чем больше трение. Таким образом, трение, генерирующее в системе тепловое движение, делает процесс необратимым. Именно в этой необратимости и состоит фундаментальное различие между воображаемым и идеальным миром, к которому так стремятся в технике, стараясь повысить КПД любого технического устройства, и в котором все процессы полностью обратимы и вечны, и реальным,, в котором все процессы в большей или меньшей степени необратимы и поэтому рано или поздно затухают.
Так что же представляет собой обратимый мир, в котором отсутствуют потери энергии в любом из процессов? И хорошо это или плохо, что нет энергетических потерь? Плохо. Значит, терять — это хорошо? Получается так, но при этом нужно стремиться к минимуму потерь. А плохо потому, что в обратимом мире требование обратимости налагает запрет на любое потребление энергии. А значит это то, что за прямым процессом последует обратный, который нейтрализует результат, достигнутый в прямом процессе. Первичный порядок вещей станет невозможным в обратимом мире: ткани, канаты, бумага расползутся на отдельные волокна; гвозди и шурупы повыскакивают из стен, раскрутятся все винты и гайки и все остальное, что держится силой трения.
И это не все. В необратимом мире кажется естественным то, что для движения автомобилей, кораблей, самолетов необходима непрерывная работа их двигателей, непрерывное действие на них движущей силы колёс, винтов, реактивных струй. В обратимом мире нет трения, а воздух, как и все другие газы и жидкости, утратил бы свою вязкость и стал бы сверхтекучим. Поэтому самолеты не испытывали бы в полете лобового сопротивления (зато возникла бы проблема создания подъемной вилы крыла). И, следовательно, в обратимом мире двигателе ее нужны. Все перевозки и поездки будут производиться катапультами. Остановить транспорт с помощью тормозов будет невозможно. Нужны ловушки.

От катастрофического обратимого мира нас избавляет необратимость, порожденная трением, как процессом непосредственного превращения различных форм движения материи в тепловое движение. Всякий необратимый процесс должен быть тепловым. И действительно, энергия, вырабатываемая электростанциями земного шара, превращается в теплоту на фабриках, заводах, шахтах. Цена такого превращения — получение металла, деталей из него, бумаги, тканей и т. д.
6.10. Второй закон термодинамики
Первый закон термодинамика, являясь общим законом сохранения и превращения энергии, представленный в форме, удобной для термодинамического анализа, утверждает, что теплота может превращаться в работу, а работа — в теплоту, не устанавливая условий, при которых возможны эти превращения. Кроме того, первый закон не рассматривает вопроса о возможном направлении протекания процесса; а не зная этого, нельзя предсказать его особенности и результаты.
Условия,
необходимые для осуществления какого-либо
преобразования,
устанавливает второй закон термодинамики.
Он имеет
частный характер, связанный со свойствами
тепловой энергии.
И второе, закон справедлив только для
макропроцессов.
Второй закон термодинамики не может
быть выведен из каких-либо теоретических
положений, а, как и первый, представляет
собой результат обобщения установленных
из опыта фактов.
Существует несколько эквивалентных
формулировок второго закона термодинамики.
Первая и наиболее общая принадлежит
Р. Клаузиусу и утверждает следующее:
«Теплота не может
сама собой переходить от тела с более
низкой температурой
к телу с белее высокой температурой,
или — процесс теплообмена
необратим». Эта формулировка позволила
доказать Р.
Клаузиусу теорему, носящую его имя: «Для
любого обратимого
процесса интеграл от приведенной теплоты
![]() ,
взятый по
замкнутому контуру, равен нулю»
,
взятый по
замкнутому контуру, равен нулю»
(6.41)![]() .
.
Равенство интеграла Р. Клаузиуса нулю указывает на существование некоторой функции состояния, которая была названа Р. Клаузиусом — энтропией, то есть
![]() (6.42)
(6.42)
Уравнение (6.41) называют первым интегралом Клаузиуса. Уравнение (6.42) считают математическим выражением второго закона термодинамики для обратимых процессов.
Чтобы разобраться с теоремой Р. Клаузиуса, рассмотрим схему процесса обратимого преобразования теплоты в работу (рис. 6.10). Для этого необходимо установить связь количеств теплоты q1 и д2 и температур Т1 и Т2.
По
первому закону термодинамики
q2
=
q1—
.
Используя понятие
термического
коэффициента полезного действия
![]() = (q1-
q2)/q1
=(Т1-—
Т2)/Т1
для
цикла Карно и заменив работу
на
ее значение
=
q1—
q2=
= (q1-
q2)/q1
=(Т1-—
Т2)/Т1
для
цикла Карно и заменив работу
на
ее значение
=
q1—
q2=![]() ,,
предыдущее уравнение можно переписать
в виде: q2
= q1
- ql(Tl
- T2)lT1.
После
упрощений получим q1/T
= q2/T2
.Получается,
что отношения количеств теплоты к
соответствующим температурам на
входе теплового потока в двигатель
и на выходе из него равны. Это следует
понимать как факт наличия тепловой
характеристики, названной энтропией
,,
предыдущее уравнение можно переписать
в виде: q2
= q1
- ql(Tl
- T2)lT1.
После
упрощений получим q1/T
= q2/T2
.Получается,
что отношения количеств теплоты к
соответствующим температурам на
входе теплового потока в двигатель
и на выходе из него равны. Это следует
понимать как факт наличия тепловой
характеристики, названной энтропией
(q/T) = s, Дж/(кгК),
сохраняющей для двигателя постоянное значение в процессах ее подвода и отвода. На рис. 6Д0 показано, что отношения q/T остаются одинаковыми и на входе теплоты, л на выходе. Это свойство величины q/T и обратило на себя внимание Р. Клаузиуса. Он первым придал величине q/T самостоятельное значение и назвал ее энтропией.
Возвратимся
к теореме и интегралу Клаузиуса.
Преобразуем
ql/T1
=
q2/T2
к
виду q1/T1-q2/T2=0,
так
как q2
,согласно
принятому
правилу знаков для теплоты, является
отрицательной
величиной, то получим q1/T1+q2/T2=
0
или s1
+ s2=0.
Для любого
обратимого процесса по замкнутому
контуру интеграл от
приведенной теплоты и составляет понятие
интеграла Клаузиуса
![]() =
0. Соотношением s
=
q/T
можно
пользоваться
тогда, когда все количество теплоты q
отдается
при одной и той же температуре Т.
Реально
температура при подводе теплоты
(кроме процессов, сопровождающихся
фазовым переходом)
повышается, а при отводе понижается.
Для каждой малой
«порции» теплоты
q
температура
будет уже другой; Поэтому
энтропию следует подсчитывать для
каждой «порции» теплоты
отдельно в виде ds=
q/T,
а
затем суммировать «порции»
энтропии ds.
В целом
изменение энтропии
s
в конечном
процессе
12 будет равно сумме
=
0. Соотношением s
=
q/T
можно
пользоваться
тогда, когда все количество теплоты q
отдается
при одной и той же температуре Т.
Реально
температура при подводе теплоты
(кроме процессов, сопровождающихся
фазовым переходом)
повышается, а при отводе понижается.
Для каждой малой
«порции» теплоты
q
температура
будет уже другой; Поэтому
энтропию следует подсчитывать для
каждой «порции» теплоты
отдельно в виде ds=
q/T,
а
затем суммировать «порции»
энтропии ds.
В целом
изменение энтропии
s
в конечном
процессе
12 будет равно сумме
.
Из соотношения ds = q/T следует, что поток теплоты можно представить как произведение температуры Т, при которой она Передается, на поток энтропии
q = Tds, (6.43)
а
в конечном процессе q .
.
Второй закон термодинамики устанавливает направление тепловых процессов и утверждает, что самопроизвольный переход теплоты от холодных тел к нагретым невозможен (холодный чайник греть горячую печку не может). Для этого необходимы дополнительные компенсирующие процессы, например подвод механической энергии, осуществляемый в холодильных установках. Если бы самопроизвольный переход теплоты от холодных тел к горячим был возможен, то в равновесной изолированной системе можно было бы без внешнего воздействия получить два источника теплоты с различной температурой. Итак, естественные процессы протекают от большего потенциала к меньшему, поэтому процесс теплообмена необратим.
Одновременно с Р. Клаузиусом в 1851г. В. Томсон предложил другую формулировку второго закона термодинамики: «Не вся теплота, полученная в тепловом двигателе от теплоотдатчика, может перейти в работу, а только некоторая ее часть. Часть теплоты Должна перейти в теплоприемник». Следовательно, для получения работы необходимо иметь источник теплоты с высокой температурой и приемник теплоты с низкой температурой.
Следующая формулировка второго закона, являющаяся следствием формулировки В. Томсона, высказана В. Оствальдом: «Осуществление вечного двигателя второго рода невозможно». Под вечным двигателем второго рода подразумевается такой двигатель, который способен полностью превращать в работу всю теплоту, полученную от одного источника. Если бы можно было осуществить тепловую машину, работающую на одном источнике теплоты, то в качестве таких источников могли бы служить окружающая среда, мировой океану запасы внутренней энергии которых безграничны. Такой двигатель был бы вечным и не противоречащим первому закону. Противоположный механизм, антипод вечного двигателя второго рода, возможен. Это, например, тормозной механизм, наждак, в которых работа полностью превращается в малоценную теплоту трения, что является для них полезным.
Существуют и другие формулировки второго закона термодинамики, например формулировка Л. Больцмана: «Природа стремится от состояний менее вероятных к состояниям более вероятным, или — естественные процессы развиваются необратимо в направлении увеличения беспорядка». Сказанное следует понимать как то, что беспорядок всегда вероятнее, чем относительный порядок. Здесь Л. Больцман отождествляет беспорядок с понятием энтропии и обосновывает тот факт, что любая форма упорядоченного движения, каким является механическое движение газа в целом, стремится перейти в неупорядоченное хаотическое внутримолекулярное движение самостоятельно, то есть работа в теплоту переходит без затруднения. В то же время, перевод теплоты в работу требует дополнительных затрат, добавочного компенсирующего процесса или просто компенсации, как говорил Р. Клаузиус. Формулировка Л. Больцмана с учетом изложенного может быть интерпретирована и так: «Какие бы изменения ни происходили в реальных изолированных системах, они всегда ведут к увеличению энтропии». Формулировка Л. Больцмана самая широкая и содержательная.
6.13.Энтропия
Итак, понятие энтропии введено Р. Клаузиусом в 1865 г. С помощью энтропии решаются многие важные теоретические, практические проблемы и не только термодинамические. И вместе с тем, трудно найти другое научное понятие, вокруг которого кипело бы столько страстей и которое вызвало бы столько кривотолков, ошибок и нападок. Последнее обусловлено чрезвычайной широтой участия энтропии в различных технических, биологических, астрофизических и других процессах. Попытаемся здесь и в следующем параграфе разобраться в многоликости этого понятия.
Ранее отмечалось, что термическое состояние рабочего тела характеризуется рядом параметров и функций состояния: Р, v, Т, и, h, s и др. В равновесном состоянии эти величины имеют одинаковые значения по всей массе тела и представляют собой, в сущности, некоторые средние значения результатов поведения громадного числа молекул, составляющих выбранную массу вещества.
В термодинамике применяются такие методы исследования и расчетов, при которых рабочие тела рассматриваются как нечто целое, отвлеченно от их атомно-молекулярной структуры. С такой точки зрения, полученная Р. Клаузиусом функция состояния — энтропия, имеет физический смысл в том, что это специфическая величина, характеризующая только тепловое взаимодействие системы со средой и что она меняется только в этом случае. Любая другая величина может изменяться при этом, но только изменение энтропии указывает на наличие теплового воздействия (подвод или отвод теплоты). Этот вывод следует из формулы (6.58). Действительно, поскольку абсолютная температура всегда больше нуля, то подвод или отвод теплоты зависит от знака ds., то есть при подводе теплоты энтропия всегда увеличивается: q > 0, ds > 0, при отводе—уменьшается: q< 0, ds < 0. Если энтропия не меняется (s = const, ds = 0), то теплообмена системы с окружающей средой нет, bq = 0. Изменение энтропии, равное нулю, указывает на отсутствие передачи энергии рабочему телу в форме теплоты. Каким же образом тогда работает тепловой двигатель, представленный на рис. 6.10. Ведь в нем теплота подводится и отводится, а энтропия постоянна — q1 /T1= q 2 /T2, s1 =s2. Это противоречие легко объяснить следующим образом. Да, внешние потоки энтропии одинаковы, но внутри двигателя циркулирующее рабочее тело периодически нагревается и охлаждается. При подводе теплоты в идеальном двигателе рабочее тело нагревается и энтропия его растет, при отводе теплоты рабочее тело охлаждается и энтропия его уменьшается до первоначального значения. Заметим, что идеальные тепловые двигатели обратимы. Это допускает двойную возможность движения теплоты от теплоотдатчика к теплоприемнику в тепловом двигателе с производством работы и от теплоприемника к теплоотдатчику в тепловом насосе (или холодильнике) с затратой работы. Следовательно, энтропия является индикатором направленности протекания термодинамических процессов.
И все было бы просто, если бы свойства энтропии ограничились постоянством в обратимых процессах. И споров вокруг энтропии было бы меньше. Начало же спорам положил Р. Клаузиус более 100 лет назад. И все из-за того, что идеи С. Карно он развил на новом уровне и приложил к необратимым процессам переноса теплоты, в которых возможен только односторонний переход системы в направлении меньшего потенциала. Р. Клаузиус распространил этот вывод на любые необратимые процессы и ввел тем самым принцип возрастания энтропии: во всех реальных процессах преобразования энергии в изолированных системах суммарная энтропия всех участвующих в них тел возрастает. Другими словами, принцип, который рассматривается как второй закон термодинамики, может быть сформулирован и так: какие бы изменения ни происходили в реальных изолированных системах, они всегда ведут к увеличению энтропии системы. Следовательно, энтропия является индикатором направленности необратимых процессов в изолированной системе. При этом, чем больше рост энтропии, тем «реальнее» процесс. Эта же мысль, высказанная в обратном направлении, будет звучать так: увеличить энтропию системы невозможно никаким иным путем, кроме подвода теплоты — либо от другой системы или окружающей сре-
ды, либо за счет внутренних необратимых процессов. Кстати, механическое сжатие и расширение, электризация, намагничивание, упругая деформация, то есть любое нетермическое воздействие не влияет на изменение энтропии.
 Из
изложенного следует, что второй закон
термодинамики состоит из констатации
двух положений: существования и
постоянства энтропии в обратимых
процессах и возрастания энтропии в
необратимых процессах. Что же касается
возможности
уменьшения энтропии в изолированной
системе, то второй закон
ее исключает. Уменьшение энтропии
невозможно в принципе,
так как предполагает возможность
самопроизвольного процесса в направлении
большего потенциала.
Из
изложенного следует, что второй закон
термодинамики состоит из констатации
двух положений: существования и
постоянства энтропии в обратимых
процессах и возрастания энтропии в
необратимых процессах. Что же касается
возможности
уменьшения энтропии в изолированной
системе, то второй закон
ее исключает. Уменьшение энтропии
невозможно в принципе,
так как предполагает возможность
самопроизвольного процесса в направлении
большего потенциала.
Более полно раскрывается смысл энтропии, если- исходить из ее статистической трактовки, то есть если рассматривать вещество как совокупность молекул, обладающих определенной массой и скоростью, и определять его термическое состояние, исходя из микроструктуры и определенных закономерностей, которым подчиняются совокупности. Термическое состояние рабочего тела в этом случае будет зависеть от координат каждой молекулы и ее скорости в соответствующий момент времени. Решение такой задачи обычными методами затруднено из-за большого числа молекул и непрерывных взаимодействий между ними. Поэтому здесь применяются способы исследования массовых явлений, так называемая статистика. Применительно к изучению термических явлений она называется статистической термодинамикой и основывается на положениях математической теории вероятности.
Л. Больцман исследовал законы поведения всего множества молекул газа, как системы, и установил, что существует непосредственная связь энтропии с тем состоянием, в котором находится система. Состояние системы в фиксированный момент времени, при котором для каждой молекулы определены положение в пространстве и скорость, называют микросостоянием. Таким образом, микросостояние системы определяется совокупностью параметров, характеризующих состояние каждой микрочастицы системы. Однако молекулы находятся в хаотическом движении и во взаимодействии друг с другом, это приводит к постоянному перераспределению энергии между молекулами, то есть к изменению микросостояний системы. Естественно, что одно и то же макросостояние может быть получено при различном расположении молекул внутри рабочего тела и их скоростях, так как средние значения этих величин по всей массе тела будут одни и. же" же. Иными словами, одному и тому же макросостоянию будет соответствовать большое число микросостояний или при одном и том же макросостоянии может происходить непрерывная смена микросостояний при неизменном давлении, температуре и других параметрах состояния.
Число эквивалентных микросостояний, позволяющих реализовать данное макросостояние, по предложению М. Планка, называют термодинамической вероятностью. Она равна отношению общего числа перестановок всех N частиц между собой в пределах системы, то есть N\, к числу перестановок молекул внутри каждой из энергетических групп, отличающихся распределением молекул в пространстве, по скоростям и энергиям (ге,! л2! п3! ...п\):
Так как число эквивалентных микросостояний велико, то термодинамическая вероятность значительно больше математической. Последняя, как известно, определяется отношением числа интересующих нас событий к числу всех равновозможных я не может быть больше единицы.
Термодинамическая вероятность наступления того или иного микросостояния зависит от величин, характеризующих молекулярное состояние. Рассмотрим систему, состоящую из восьми Молекул, хаотично движущихся в изолированном Объеме, мысленно разделенной на четыре части. Предположим три возможных состояния системы (рис. 6.11).
Термодинамические вероятности пребывания системы в каждом из трех состояний соответственно равны:
WP1 = AT!/raI! = 8!/8! = l;
W2 = N1/ (п,! га2! п3!) = 8!/(1! 4! 3!) = 280;
W3 = N]/ ( л,! га2! л3! га4) = 8!/(2! 2! 2!2!) = 2520.
В
соответствии со вторым законом
термодинамики и элементарной
логикой система из маловероятного
состояния с W,
самопроизвольно
переходит в состояние с W2
— 280
и далее в состояние
с максимальным значением термодинамической
вероят ности
Wз=
=2520. То есть
термодинамическая вероятность
изолированной
системы является функцией ее состояния
и стремится
к максимуму, который достигается при
равновесии системы.
ности
Wз=
=2520. То есть
термодинамическая вероятность
изолированной
системы является функцией ее состояния
и стремится
к максимуму, который достигается при
равновесии системы.
Из рассмотренного примера следует, что в изолированной системе самопроизвольно происходят только такие процессы, которые идут от менее равновесных состояний к более равновесным. Система стремится к более равновесному состоянию, то есть равновесное состояние более вероятно. Неравновесное состояние возможно, но вероятность его мала (см. ниже).
Необратимые процессы, как было рассмотрено ранее, идут с возрастанием энтропии системы. Причина увеличения энтропии в необратимых процессах состоит в переходе системы от. менее к более вероятным состояниям, то есть в увеличении термодинамической вероятности состояния изолированной системы. Это значит, что энтропия есть некоторая функция термодинамической вероятности состояния системы. Вид функции установлен Л. Больцманом и выражается формулой
S = k nW + const, Дж/К,
где к — постоянная Больцмана. Энтропия изолированной системы пропорциональна натуральному логарифму термодинамической вероятности данного состояния системы, то есть энтропия — мера вероятности данного состояния. Формула Л. Больцмана объединила макровеличину — энтропию, с микровеличиной— термодинамической вероятностью данного состояния.
В необратимых процессах в изолированной системе состояния меняются так, что их термодинамическая вероятность, а значит, и суммарное значение энтропии растет, ds > 0. В обратимых процессах в изолированной системе любое состояние является равновероятным, ds = 0. В общем случае имеет место принцип возрастания энтропии — ds 0. Получен тот же результат, что и при феноменологическом толковании энтропии. Таким образом, возрастание энтропии изолированных систем указывает на наиболее вероятное направление протекания естественных процессов. Наиболее вероятным является равновесное состояние, при котором система будет иметь максимальное значение энтропии. При этом не исключается возможность маловероятных событий, называемых флуктуациями, когда ds < 0 и имеет место несоблюдение второго закона термодинамики.
Кстати, мир Земли — мир постоянной энтропии, так как практически всю теплоту, получаемую от Солнца и от земных источников и в том числе за счет необратимых процессов (горение, механическое трение, электрическое сопротивление, теплообмен, ...), наша планета излучает в космос. В результате такого переизлучения энтропии в природе остаются изменения, по которым можно судить об эволюции природы.
6.14. Некоторые свойства энтропии
Энтропию нельзя измерить, ее смысл практически невозможно продемонстрировать. Но, несмотря на многоликость энтропии, ее можно понять по следующим интерпретациям. Вначале для иллюстрации сказанного используем уже известные определения энтропии, как функции состояния.
1.Энтропия
— индикатор направленности процессов
термического
взаимодействия системы со средой: ds
> 0
при
q
> 0,
ds
< 0 при
q
< 0,
ds
=
0 при
![]() = 0.
= 0.
Энтропия — индикатор направленности необратимых процессов в теплоизолированной системе ds > 0 при = 0.
Энтропия— мера необратимости реальных процессов, мера потери работоспособности системы (потери работы вследствие необратимости), мера обесценивания энергии для потребителя, ее деградации, то есть мера рассеивания энергии. Эта характеристика следует из принципа возрастания энтропии — ds > 0. Чем более необратим процесс в изолированной системе, тем больше возрастает энтропия и тем большая часть энергии
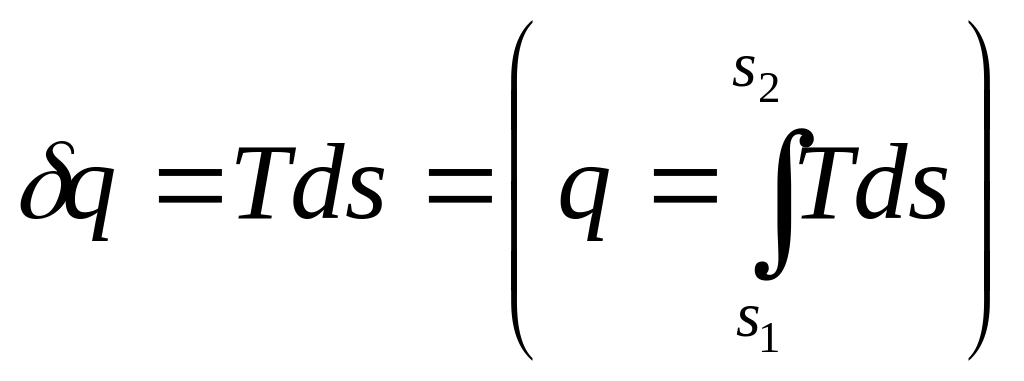 ,не
переходя в работу, рассеивается
в окружающей среде. Следовательно,
энтропия позволяет
оценить
энергетические возможности
термодинамических систем.
,не
переходя в работу, рассеивается
в окружающей среде. Следовательно,
энтропия позволяет
оценить
энергетические возможности
термодинамических систем.
Энтропия — мера трудности возврата системы в первоначальное состояние с начальной энтропией. Под «трудностью возврата» понимают количество энергии, необходимое для этого.
Энтропия — мера вероятности данного состояния системы. В теплоизолированной системе при протекании необратимых процессов состояния меняются так, что термодинамическая вероятность и энтропия возрастают. При обратимых процессах в теплоизолированной системе любое из состояний равновероятно и энтропия системы неизменна.
Энтропия — мера ценности теплоты, ее работоспособности и технологической эффективности. Опыт свидетельствует о том, что чем выше температура теплоносителя при том же количестве теплоты, то есть чем меньше энтропия (s = q/T), тем теплота ценнее, поскольку может быть использована не только для технологических нужд — выплавки металла, выпечки хлеба, отопления, но и для получения работы, например, в силовой установке летательного аппарата.
Таким образом, два энергетически эквивалентных количества теплоты q1 — q2 совсем не эквивалентны по содержащейся в них энтропии: то количество теплоты, которое связано с большей температурой, несет в себе меньше энтропии, чем то, которое связано с меньшей температурой.
7.
Энтропия — мера беспорядка (порядка) в
системе. Это так
называемая структурная энтропия. Она
является мерой неупорядоченности
строения систем. До сих пор приходилось
иметь дело с тепловой энтропией. При
подводе теплоты к системе
энтропия ее возрастает, так как
увеличивается хаотичность
теплового движения микрочастиц, порядок
в системе при этом
уменьшается. Наоборот, охлаждение
системы при постоянном
объеме есть отвод теплоты от системы,
а следовательно, и
энтропии; упорядоченность системы при
этом за счет уменьшения
кинетической энергии и хаотичности
движения микрочастиц
возрастает, а энтропия уменьшается. При
конденсации газа
упорядоченность в расположении молекул
скачком увеличивается,
что соответствует ступенчатому уменьшению
энт- ропии.
При дальнейшем уменьшении температуры
уменьшаются
интенсивность теплового движения,
беспорядок в системе и ее энтропия.
Кристаллизация жидкости приводит к
образованию
правильной кристаллической решетки и
дальнейшему увеличению порядка и
уменьшению энтропии. Подобная зависимость
в изменении температуры, энтропии и
порядка позволяет
предположить, что при нуле абсолютной
температуры
тепловое движение полностью прекратится
Eк
= 3kT/2
=
О и
в системе установится максимальный
порядок, то есть неупорядоченность
и энтропия станут равными нулю. Это
предположение, не поддающееся опытной
проверке, ибо абсолютный
нуль температуры недостижим из-за
необратимости реальных процессов
охлаждения, называют тепловой теоремой
Нернста
или третьим законом термодинамики —
при абсолютном
нуле: максимум порядка, отсутствие
беспорядка, энтропия
равна нулю —
![]() s
= 0.
s
= 0.
8. Энтропия — мера недостатка информации. Это так называемая информационная энтропия. Природные и техногенные

- Рассмотрим противоположную ситуацию: идеальный газ находится при высокой температуре. Положение хаотично движущихся молекул в этих условиях совершенно неопределенно, и о них нельзя получить никакой информации, кроме той, что .они движутся, то есть в этом случае информация близка к нулю, а энтропия — к максимуму (рис. 6.12). Следовательно, информация о микроеостоянии тем меньше, чем больше W, а значит, и энтропия S, Дж/К. Таким образом, энтропия оказывается величиной, изменяющейся противоположно информации I
![]()
где К — постоянная, по физическому содержанию отличная от постоянной Больцмана.
Итак, информация эквивалентна отрицательному изменению энтропии. А. Бриллюэн назвал отрицательную энтропию негэнтропией. И отсюда появляется еще одна характеристика энтропии, как меры неопределенности сообщения.
Относительно изменения этих двух величин предыдущее можно сформулировать следующим образом. Изменение энтропии системы противоположно изменению информации о ней. Информация — мера трудности познания макросостояния системы. Это значит, что из-за незнания микросостояния системы надо затратить много энергии, или, точнее, негэнтропии для возвращения системы в более упорядоченное состояние.
Интересно следующее замечание по данному свойству энтропии. В процессах развития наблюдаются две тенденции: стремление к усложнению организации системы и одновременно — к упрощению. Первая тенденция равносильна накоплению информации, а тенденция к упрощению означает умень-шение информации и накопление энтропии. Ведущей все-таки является тенденция усложнения.
Кстати, энтропийная основа информации была ясна до создания в 1949 г. теории информации.
9. Энтропия — мера жизненного потенциала. Возможность применимости второго закона термодинамики, к биологическим объектам интересует ученых с давних пор. Все живые, как, впрочем, и неживые объекты мира метастабильны. Мета-стабильность обусловлена, прежде всего, тем, что упомянутые объекты имеют определенную форму. Живым существам приходится активно бороться за ее сохранение и даже усложнение. Потеря формы означает смерть. Деятельность поддержания формы у неживых объектов устанавливается степенью активности их энергетического взаимодействия с окружающей средой. Форма, например, алмаза поддерживается неизменной на протяжении миллионов лет. У работающего алмаза продолжительность существования формы значительно меньше. Здесь уместно вспомнить, что термодинамика описывает любые явления, связанные с энергетическими процессами, которые невозможны в бесструктурных системах (системах без формы). Итак, второй закон, как смертный приговор, неукоснительно исполняется в неживой природе.
В 1935 г. Э. Бауэр сформулировал три основные особенности живых систем: самопроизвольное изменение состояния, противодействие внешним силам, постоянная работа против уравновешивания с окружающей средой. Третья особенность является отличительным признаком биологических систем. Она имеет очевидный термодинамический смысл.
Э. Шредингер также считал особенностью биологических объектов их неуравновешенность с окружающей средой, которая поддерживается непрерывным обменом открытой живой системы с окружающей средой, пищей, питьем, дыханием и т. д. Пища и остальные формы обмена представляют собой материал, необходимый для создания нового в системе. Конструирование же нового и выход на иной уровень упорядоченности системы создается, однако, не пищей, а развивающимся организмом.
Основное свойство всего живого состоит в том, что в момент перехода к состоянию равновесия оно поворачивает процесс в обратном направлении, и при этом живая система не просто восстанавливает свою структуру (энтропия системы понижается), но я делается более совершенной. Следовательно, неравновесное состояние биологических объектов поддерживается за счет извлечения ими из окружающей среды отрицательной энтропии — негэнтропии. Это равнозначно сбросу «наработанной» положительной энтропии. Ведь чем выше энтропия, тем больше беспорядок в системе — дряблость кожи, нарушение координации движений, потеря памяти и многое другое. Таким образом, жизнь в энтропийном отображении напоминает возвратно-поступательное движение вдоль энтропийной оси по схеме, вначале до достижения физиологической зрелости: шаг вперед, два шага назад (негэнтропийная тенденция эволюции биологических систем), а затем: два шага вперед, шаг назад (энтропийная тенденция). Получается, что жизнь — это, прежде всего, постоянная и затухающая реакция организма, вызванная изменениями условий окружающей среды и направленная только на возврат к исходному состоянию, то есть на поддержание внутренней среды организма. Другими словами, живую природу от неживой отличает обязательная обратимость физиологических процессов одновременно с естественной и обязательной для неживых систем необратимостью, обусловленной эволюционной морфологией биологического объекта. Именно эволюция объекта, и в том числе живого, приводит к возрастающему образованию структурной энтропии. Кстати, затормозить, сдержать рост энтропии можно уменьшением количества потребляемой пищи и увеличением двигательной активности биологического объекта. Поэтому старение начинается с момента, когда возникает смена негэн-тропийных тенденций на энтропийные. С этого момента организм постепенно утрачивает способность к восстановлению и усложнению своей структуры, вследствие снижения естественной физической активности, когда процессы синтеза перестают быть избыточными. Следует заметить, что окончательно не постигнута тайна, как организм без какого-либо вмешательства извне вначале в течение какого-то периода времени сам творит себя и лишь начиная с определенного времени сам же себя и разрушает. Но еще более загадочной является проблема: жизнь — это случайное или закономерное явление природы.
10. Энтропия — индикатор невозможности обратить течение времени. Природные процессы, как показывает человеческий опыт, являются необратимыми и идут в направлении накопления энтропии. Природой предусмотрен определенный - порядок чередования событий, по которому она, по крайней о мере, в пределах отдельных макрочастей стремится к равновесию. Однако порядок чередования событий в некоторых случаях нельзя смешивать с направлением событий (направление ем времени). Например, точки на прямой линии могут быть расположены в определенном порядке, но направление здесь отсутствует, так как сама линия не обладает каким-либо направлением. В необратимых же процессах приходится иметь в виду и порядок чередования событий, и направление времени в сторону его накопления. Постоянный во времени процесс роста энтропии психологически воспринимается как естественное направление времени. Порядок необратимых процессов во времени находится также во взаимосвязи с причинно-следственным механизмом. В нашем понимании причина и следствие идут во времени так, что сперва действует причина, а уж за нею появляется следствие. Конечно же, отношения между событиями сложнее, но очевидно, что второй закон термодинамики затрагивает глубокие философские вопросы.
Итак, последовательность событий, обусловленная законом возрастания энтропии, и привычная направленность времени приводят к очевидным выводам: время движется от прошлого к будущему; момент «теперь» есть настоящее время, отделяющее прошлое от будущего. Настоящее — это миг в сравнение с бесконечным прошлым и будущим; прошлое никогда не возвращается; нельзя изменись прошлое, но можно изменить будущее; можно иметь летописи прошлого, но не будущего.
6.15. Теория «тепловой смерти Вселенной»
Р. Клаузиус в 1864 г. в качестве одной из формулировок второго, закона термодинамики предложил: «Энтропия мира стремится к максимуму». Таким образом, Р. Клаузиус отождествил Вселенную с понятием изолированной системы. А как известно, в изолированной системе необратимые процессы приводят к росту энтропии,, а ори этом в результате трения, теплопроводности, теплового излучения, химические реакций потенциалы в системе выровняются—- исчезнет неоднородность в структуре системы, наступит термодинамическое равновесие с максимальной энтропией.
Формулировка Р. Клаузиуса означает, что Вселенная, исшагав непрерывный ряд превращений энергии, придет на основании закона возрастания энтропии и по истечении достаточно большого промежутка времени к состоянию равновесия, когда все имеющиеся во Вселенной разности физических величин из том числе температур станут равными нулю, всякое макродвижение прекратится, и наступит тепловая смерть Вселенной. Правомерность признания такой теории касается вопроса о границах применимости закона возрастания энтропии. Уже известно, что второй закон неприменим к микромиру. Но если предположить, что теория «тепловой смерти Вселенной» является надуманной, тогда закон возрастания энтропии неприменим и к мегамиру. Остается, что этот закон термодинамики применим только к макропроцессам, протекающим в макромире, исключая процессы микро- и мегамира. Это следует из того, что второй закон термодинамики имеет статистическую природу. Движение же тел, составляющих микро- и мегамир, является не хаотическим, а происходит по своим динамическим законам.
Несмотря на свою ошибочность, теория сразу же нашла признание у определенной части научной общественности и служителей церкви. Например, известный советский (обратите внимание, при прежней-то идеологии) физик А. Иоффе в XX столетии сказал: «... в бога я не верю, я не приписываю ему сотворение мира. Я не знаю, кто создал мир, но я твердо знаю, что он идет к постепенному выравниванию всех и всяких потенциалов, к состоянию наибольшей вероятности... Энтропию нельзя перешагнуть».
Теория «тепловой смерти Вселенной» приводит к энтропийному концу света, а следовательно, неизбежно и к божественному происхождению или первоначалу Вселенной. Папа Пий XII по этому поводу заметил: «Закон энтропии, открытый Рудольфом Клаузиусом, дал нам уверенность в том, что в замкнутой материальной системе, в конце концов, процессы в макроскопическом масштабе когда-то прекратятся. Эта печальная необходимость свидетельствует а существовании Необходимого Существа». Мысль, высказанная главой христианской церкви в середине XX века, приводит к противоречию е принципом вечности движения во Вселенной, выражающимся в законе сохранения и превращения энергии.
Основной вывод по проблеме состоит в той, что для земных процессов не существует предела, когда они приведут Землю к единому равновесному состоянию, «тепловой смерти», к возможному максимуму энтропии. Земная система, как и Вселенная, не является изолированной, и для нее возможно уменьшение энтропии и концентрации анергии*, не нарушающее общего баланса энергии космического пространства.
6.16.Тепловая диаграмма Ts. Теплота — функция процесса
Известно, что энтропия является функцией состояния системы!. В аналитических и графических расчетах удобно пользоваться удельной энтропией — s, Дж/(кгК). Чтобы рассчитать удельную теплоту процесса через энтропию по формуле
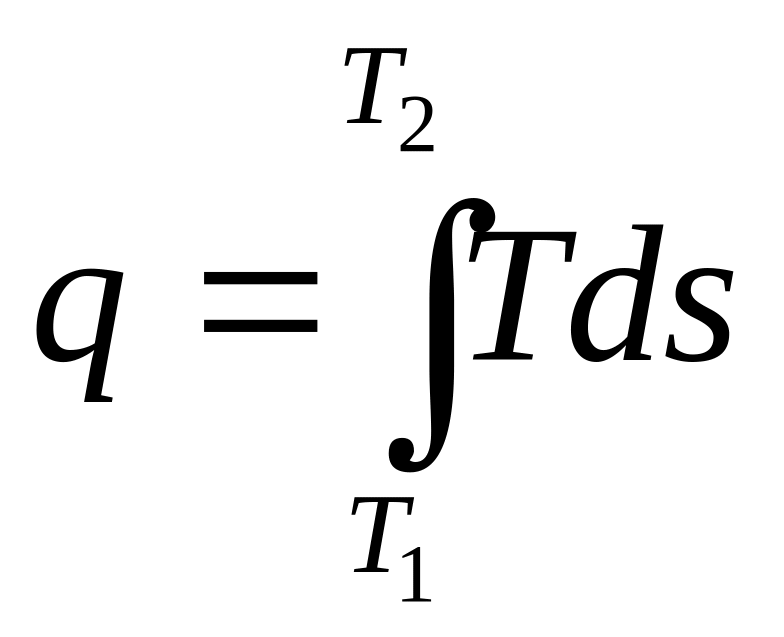 ,
необходимо
знать уравнение
процесса Т
=
f(s).
Если
же процесс задан графически
в системе координат Ts,
то
и теплоту процесса легко
найти графически. .Исходя
из этой возможности диаграмму
Ts
называют
тепловой
или энтропийной. С помощью
диаграммы удельная теплота
может быть определена графически
площадью под кривой
процесса. Действительно, элементарная
площадка с
основанием
ds
и
высотой Т
равна
Tds,
то
есть элементарной теплоте
q
в
бесконечно малом процессе (рис. 6.13). Вся
площадь 12s2
s1
определяет
удельную теплоту в конечном процессе
12:
,
необходимо
знать уравнение
процесса Т
=
f(s).
Если
же процесс задан графически
в системе координат Ts,
то
и теплоту процесса легко
найти графически. .Исходя
из этой возможности диаграмму
Ts
называют
тепловой
или энтропийной. С помощью
диаграммы удельная теплота
может быть определена графически
площадью под кривой
процесса. Действительно, элементарная
площадка с
основанием
ds
и
высотой Т
равна
Tds,
то
есть элементарной теплоте
q
в
бесконечно малом процессе (рис. 6.13). Вся
площадь 12s2
s1
определяет
удельную теплоту в конечном процессе
12:
![]()
П одводимое
(или отводимое)количество теплоты
q12(q21)
зависит
от характера процесса, так как между
состояниями 1
и 2 можно провести ряд процессов, и
теплота для каждого из них будет иметь
конкретное значение. В случае перехода
системы
из состояния 1 в состояние 2 по траектории
1а2 теплота q1a2
>q12
на величину
площади 1а21. Таким образом, теплота
является
функцией процесса.
одводимое
(или отводимое)количество теплоты
q12(q21)
зависит
от характера процесса, так как между
состояниями 1
и 2 можно провести ряд процессов, и
теплота для каждого из них будет иметь
конкретное значение. В случае перехода
системы
из состояния 1 в состояние 2 по траектории
1а2 теплота q1a2
>q12
на величину
площади 1а21. Таким образом, теплота
является
функцией процесса.
Достоинство диаграммы Ts состоит еще ив том, что по направлению кривой процесса легко определить знак теплоты согласно уравнению (6.43). Таким образом, если, например, энтропия уменьшается, то удельная теплота отводится независимо от знака изменения температуры. Следует обратить внимание на последнее утверждение: увеличение или уменьшение температуры в. общем случае не позволяет судить о том, подводится или отводится теплота. Признаком подвода теплоты может служить только рост энтропии, а отвода — ее уменьшение.
Вне процесса понятие теплоты не имеет смысла, так как означает не запас энергии, а ее количество, передаваемое в ходе процесса.
6.17. Изменение энтропии идеального газа
Рассмотрим уравнения первого закона термодинамики для закрытых и открытых систем с учетом того, что q = Tds:
![]()
Разделив обе части уравнений на Т, получим
(6.44)![]()
![]() (6.45)
(6.45)
Из уравнения состояния идеального газа
Pv = RT (6.46)
получим Р/Т = R/v и v/T = R/P. Подставим полученные выражения соответственно в (6.44) и (6.45):
![]() (6.47)
(6.47)
