
- •Природа ядерних реакцій. Поріг і механізм ядерних реакцій
- •2. Реакції ділення. Ланцюгова реакція. Використання ядерної енергії
- •Радіоактивність
- •Типи радіоактивності
- •Склад ядра атома
- •Склад ядра атома. Дефект маси. Енергія зв’язку атомних ядер
- •Дослід Франка—Герца
- •Експеримент
- •Пояснення
- •Інші гази
- •Рентгенівське випромінювання
- •Суцільний та характеристичний спектр випромінювання
- •Поглинання
- •Дифракція
- •Опромінення
- •Постулати Бора
- •Історичні відомості
- •Формулювання
- •Атом водню і його спектр за теорією Бора
- •Рівняння Ейнштейна.
- •Внутрішній фотоефект.
- •Застосування фотоелементів
- •Рівняння Ейнштейна
- •Характеристики
- •Стала Планка
- •Числове значення
Склад ядра атома
Важливою характеристикою ядра є його заряд і маса.
Заряд ядра визначається кількістю позитивних елементарних зарядів (протонів), які знаходяться в ньому.
У 1932 році англійський учений Джеймс Чедвік відкрив частинку, яка не має електричного заряду, маса якої приблизно дорівнює масі протону. Цю частинку назвалинейтроном.
Після відкриття нейтрону радянський фізик Дмитро Іваненко і німецький фізик Вернер Гейзенберг запропонували гіпотезу про протонно-нейтронну будову ядра.
Ядро складається з елементарних частинок двох сортів (нуклонів). Загальне число нуклонів, тобто сума протонів і нейтронів у ядрі атома, дорівнює масовому числу атома. Число протонів визначається за порядковим номером елементу в таблиці Менделєєва, а число нейтронів — як різниця між масовим числом і числом протонів.
Ядра з однаковим числом протонів, але різним числом нейтронів, є ядрами різнихізотопів одного хімічного елементу. Різні ізотопи одного хімічного елементу мають різну масу і відрізняються фізичними властивостями, але, маючи однаковий заряд, атоми різних ізотопів одного і того ж хімічного елементу мають однакову будову електронних оболонок і тому мають однакові хімічні властивості.
Сили притягання між нуклонами у ядрі називають ядерними.
Склад ядра атома. Дефект маси. Енергія зв’язку атомних ядер
Тривалий
час фізики вважали, що до складу ядер
важких атомів можуть входити поряд із
протонами електрони. Лише в 1932 р.
український фізик Д. Д. Іваненко і
німецький фізик В. Гейзенберг теоретично
довели, що ядра всіх атомів, крім водню ![]() ,
містять крім протонів і нейтрони.
Існування нейтрона експериментально
виявив у 1932 р. англійський фізик Дж.
Чедвік. Нейтрон не має результуючого
заряду, за масою близький до протона,
але все ж дещо масивніший:
,
містять крім протонів і нейтрони.
Існування нейтрона експериментально
виявив у 1932 р. англійський фізик Дж.
Чедвік. Нейтрон не має результуючого
заряду, за масою близький до протона,
але все ж дещо масивніший: ![]() ;
; ![]() ;
; ![]() (
(![]() ,
, ![]() і
і ![]() —
маси нейтрона, протона і електрона
відповідно).
І
протон, і нейтрон — нуклони, ядерні
частинки (від англ. nucleus —
ядро). Більшість хімічних елементів
може існувати у вигляді кількох ізотопів
(речовин, у ядрах атомів яких міститься
однакове число протонів
—
маси нейтрона, протона і електрона
відповідно).
І
протон, і нейтрон — нуклони, ядерні
частинки (від англ. nucleus —
ядро). Більшість хімічних елементів
може існувати у вигляді кількох ізотопів
(речовин, у ядрах атомів яких міститься
однакове число протонів ![]() ,
але різне число нейтронів
,
але різне число нейтронів ![]() ).
Символічно
ядро позначається
).
Символічно
ядро позначається ![]() ,
де
,
де ![]() (зарядове
число),
(зарядове
число), ![]() (масове
число). Приклади ізотопів: ізотопи
водню
(масове
число). Приклади ізотопів: ізотопи
водню ![]() («звичайний»
водень або протій),
(«звичайний»
водень або протій), ![]() (дейтерій),
(дейтерій), ![]() (тритій);
ізотопи урану
(тритій);
ізотопи урану ![]() ,
, ![]() (У
хімії термін «ізотопи» — збиральний,
окремо кажуть «нуклід»).
Маса
«готового» ядра менша від суми мас його
нуклонів.
Різниця
(У
хімії термін «ізотопи» — збиральний,
окремо кажуть «нуклід»).
Маса
«готового» ядра менша від суми мас його
нуклонів.
Різниця ![]() називається дефектом
мас ядра.
Дефекту мас відповідає енергія зв’язку Eзв
нуклонів у ядрі (енергія, з якою вони
утримуються там або яка потрібна для
поділу всього ядра на окремі нуклони).
Цю енергію прийнято виражати в
позасистемних одиницях енергії —
електрон-вольтах (1еВ дорівнює
називається дефектом
мас ядра.
Дефекту мас відповідає енергія зв’язку Eзв
нуклонів у ядрі (енергія, з якою вони
утримуються там або яка потрібна для
поділу всього ядра на окремі нуклони).
Цю енергію прийнято виражати в
позасистемних одиницях енергії —
електрон-вольтах (1еВ дорівнює ![]() Дж,
отже
Дж,
отже ![]() Дж).
Як правило, розглядають питому енергію
зв’язку
Дж).
Як правило, розглядають питому енергію
зв’язку ![]() .
.

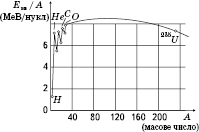 З
графіка залежності питомої енергії
зв’язку від масового числа A очевидні
два способи вивільнення внутрішньоядерної
енергії: поділ важких ядер (наприклад,
)
на більш легкі; злиття легких ядер,
наприклад ізотопів водню, у більш важкі
— синтез більш важких ядер (наприклад,
гелію).
З
графіка залежності питомої енергії
зв’язку від масового числа A очевидні
два способи вивільнення внутрішньоядерної
енергії: поділ важких ядер (наприклад,
)
на більш легкі; злиття легких ядер,
наприклад ізотопів водню, у більш важкі
— синтез більш важких ядер (наприклад,
гелію).
Дослід Франка—Герца
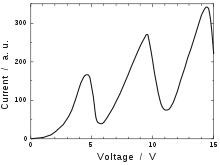
![]()
Схематична вольт-амперна характеристика в досліді Франка-Герца
.
Дослід Франка—Герца - експеримент, поставлений у 1913-1914 роках Джеймсом Франком та Густавом Людвігом Герцом, з непружного розсіянняелектронів на атомах. Експеримент підтвердив припущення моделі будови атома Нільса Бора. Франк і Герц були нагороджені Нобелівською премією з фізики за 1925 рік.
