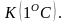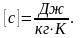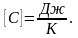- •З акон взаимосвязи массы и энергии. Полную энергию свободного тела можно определить как произведение его релятивистской массы на квадрат скорости света в вакууме
- •3.2Термодинамика
- •7) Первое начало термодинамики и его применение к изопроцессам.
- •8) Адиабатический процесс. Уравнение Пуассона(вывод). Работа на адиабатическом процессе(вывод).
- •12) Энтропия. Второе начало термодинамики, Следствие Клаузиуса.
- •Пусть постоянный ток I течёт по контуру (проводнику)γ, находящемуся в вакууме, — точка, в которой ищется поле, тогда индукция магнитного поля в этой точке выражается интегралом (в системе си) .
3.2Термодинамика
Термодинамика – это наука о наиболее общих макроскопических физических системах, находящихся в состоянии термодинамического равновесия и о процессах перехода между этими состояниями. Обратимый процесс (абстракция) – это такой равновесный процесс, при совершении которого системой сначала в прямом, а потом в обратном направлениях, повторяя все стадии пути, в исходное состояние возвращается как сама система, так и все внешние тела, с которыми она взаимодействовала. Необратимый процесс – это такой неравновесный процесс, при совершении которого систему нельзя вернуть в исходное состояние без изменений в окружающих телах.
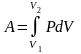 dS>0
необратимый процесс
dS=0
обратимый процесс
dS>0
необратимый процесс
dS=0
обратимый процесс
Прямой процесс – круговой процесс, протекающий по часовой стрелке.
Его работа > 0 (положительна). По такому процессу работает тепловой двигатель.
Обратный процесс – круговой процесс, протекающий против часовой стрелки.
Его работа < 0 (отрицательна).
По такому процессу работает холодильная машина.
Процесс расширения от объема V1 до объема V2 может происходить различным образом: например, можно при этом изолировать газ от нагревателя или, наоборот, нагревать газ и т.д. Иначе говоря, при перемещении из точки 1 в точку 2 в газе могут происходить различные процессы, даже если зафиксировано начальное и конечное состояния. В каждом процессе работа будет иметь свое значение, так как площадь под кривой процесса будет различной (кривые I, II, и III на рис.9.3). Таким образом, выполняемая газом работа зависит от процесса, который с ним происходит. Обычно (хотя это и не совсем точное выражение) говорят, что «работа газа есть функция процесса».Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин. ΔQA = ΔUA + Aint
Теплоемкость-
количество теплоты, которое необходимо
сообщить ИГ, чтобы нагреть его на один
градус. С=dQ/dT.Удельная
теплоемкость Суд-сфв,
характеризующая способность тела
поглощать или отдавать тепло и равная
Q
необходима для нагревания 1 гр вещ-ва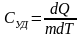 Дж/кгК
Дж/кгК
Молярная
теплоемкостьСм-СФВ,
равная Q
необходимому для нагревания 1 моля
вещ-ва на 1 Кельвин.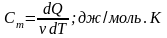
Тепловой процесс |
Формула для расчета количества теплоты |
Физический
смысл
|
Нагревание и охлаждение |
|
Удельная
теплоемкость вещества численно равна
количеству теплоты, которое поглощается
или выделяется 1
|
7) Первое начало термодинамики и его применение к изопроцессам.
Количество теплоты подведенное к системе идет на изменение внутренней энергии системы и на совершение системой работы против внешних сил.Q=∆U+A. Qдля изопроцессов:
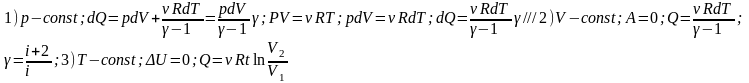
8) Адиабатический процесс. Уравнение Пуассона(вывод). Работа на адиабатическом процессе(вывод).
А.П.-Процесс, протекающий без теплообмена с окр. Средой.dQ=0:dA=-dU. Работа газа совершается за счет убыли его внутренней энергии.Сжатие газа сопроождается его нагревом, а расширение-охлаждением, то есть изменением внутренней энергии.
зависимостьтеплоемкости
к
изопроцессам,
происходящим
с
идеальным газом.
В изотермическом процессе температура
постоянная, следовательно, внутренняя
энергия не меняется. Тогда уравнение
первого закона термодинамики примет
вид: ![]() ,
т. е. количество теплоты, переданное
системе, идет на совершение работы при
изотермическом расширении, именно
поэтому температура не изменяется.
В изобарном процессе газ расширяется
и количество теплоты, переданное газу,
идет на увеличение его внутренней
энергии и на совершение им работы:
,
т. е. количество теплоты, переданное
системе, идет на совершение работы при
изотермическом расширении, именно
поэтому температура не изменяется.
В изобарном процессе газ расширяется
и количество теплоты, переданное газу,
идет на увеличение его внутренней
энергии и на совершение им работы: ![]() .
При
изохорном процессе газ не меняет своего
объема, следовательно, работа им не
совершается, т. е. А = 0, и уравнение первого
закона имеет вид
.
При
изохорном процессе газ не меняет своего
объема, следовательно, работа им не
совершается, т. е. А = 0, и уравнение первого
закона имеет вид ![]() ,
т. е. переданное количество теплоты идет
на увеличение внутренней энергии газа.2.
Применение первого начала термодинамики
к адиабатному процессу идеального
газа.
Уравнение
адиабатного процессаВ термодинамике
выводится уравнение адиабатического
процесса для идеального газа. В координатах
(p, V) это уравнение имеет вид
,
т. е. переданное количество теплоты идет
на увеличение внутренней энергии газа.2.
Применение первого начала термодинамики
к адиабатному процессу идеального
газа.
Уравнение
адиабатного процессаВ термодинамике
выводится уравнение адиабатического
процесса для идеального газа. В координатах
(p, V) это уравнение имеет вид
pV? = constЭто соотношение называют уравнением Пуассона. Здесь ? = Cp / CV – показатель адиабаты, Cp и CV – теплоемкости газа процессах с постоянным давлением и с постоянным объемом. Для одноатомного газа для двухатомного для многоатомного 1Необратимые процессы. Их направленность. Макро- и микросостояния.Вероятность осуществления данного макросостояния.Необратимые процессы-процессы которые протекают самопроизвольно(без вмешательства извне), протекают только в одном направлении. Направленность процесса связана с тем, что различные состояния процесса обнадеживает разность вероятностью. Система находясь в состоянии с малой вероятностью самопроизвольно переходит в состояние высшей вероятности. Макросостояния- Состояние характеризуемое небольшим числом макроскопических параметров. Одно макросостояние может быть реализовано большим числом микросостояний, за счет перестановки частиц, не меняющей наблюдаемого состояния. Микросостояние(x,y,z,р,v)-состояние системы определяемое заданием координат и импульсов всех составляющих систему частиц.
Вероятность осуществления данного макросостояния

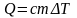 ,
где
,
где
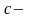 удельная
теплоемкость вещества.
удельная
теплоемкость вещества.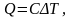 где
где
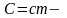 теплоемкость
тела.
теплоемкость
тела.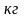 данного
вещества при изменении температуры
на 1
данного
вещества при изменении температуры
на 1