
- •ФЕРМЕНТЫ
- ••Ферменты (энзимы) - это высокоспецифичные глобулярные белки, выполняющие функции биологических катализаторов.
- •Стадии ферментативного процесса
- •Фермент
- •(Без участия воды)
- •НОМЕНКЛАТУРА ФЕРМЕНТОВ
- •Общие свойства ферментов (особенности ферментов как биологических катализаторов)
- •Кофакторы ферментов
- •Некоторые коферменты
- •Ацетилкофермент А
- •АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА
- •Механизм каталитического действия ферментов
- •Теория индуцированного соответствия
- •Субстратная специфичность химотрипсина
- •Сериновые протеазы
- •Уравнение Михаэлиса-Ментен
- •Вывод уравнения Михаэлиса-Ментен
- •Единица активности фермента
- •Ингибирование ферментов
- •Конкурентное ингибирование
- •Конкурентное
- •Аллостерические ферменты
- •Неконкурентное ингибирование
- •Неконкурентное
- •Схема действия ингибирующих и активирующих модуляторов
- •Ферментативный анализ
- •Метод определения глюкозы в крови
- •инженерная энзимология
- •В производстве стиральных порошков используются следующие ферменты:
- •Получение ферментных препаратов
- •Выделение и очистка ферментов
- •Поверхностный способ производства ферментов
- •Глубинный способ производства ферментов
- •Рост мицелия, образование -амилазы и
- •Принципиальная схема получения очищенных ферментных препаратов из культур микроорганизмов
- •Иммобилизация ферментов
- •Иммобилизованные ферменты
- •Типы иммобилизации
- •Носители для иммобилизованных ферментов
- •Ковалентное и поперечное связывание
- •Иммобилизованные ферменты, используемые в промышленности (Poulsen, 1984)
- •Промышленные процессы с иммобилизованными ферментами
- •Иммобилизованные клетки
- ••КОНВЕРТОР ДЛЯ БИОДЕСТРУКЦИИ НЕФТЯНЫХ УГЛЕВОДОРОДОВ ИЗ ВОДНЫХ СРЕД

Ацетилкофермент А



АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА
В активном центре различают адсорбционный участок (центр) и каталитический участок (центр).
Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином
аллостерический центр.
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента
(кофермент).
Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Эта сорбция происходит только за счет слабых типов
связей и потому является обратимой.
Положение активного центра в сериновых протеазах типа трипсина. Показаны части активного центра: каталитического центра, где выделены боковые группы «триады переноса заряда» - Ser195 (оранжевый), His57 (синий) и Asp102 (малиновый), и субстрат-связывающего центра, где зеленым изображены NH-группы, образующие оксианионовую дыру, голубым - неспецифическая субстрат-связывающая площадка, и желтым - группы, выстилающие специфический субстрат-связывающий карман
Механизм каталитического действия ферментов
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента.
Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
В активном центре происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями.
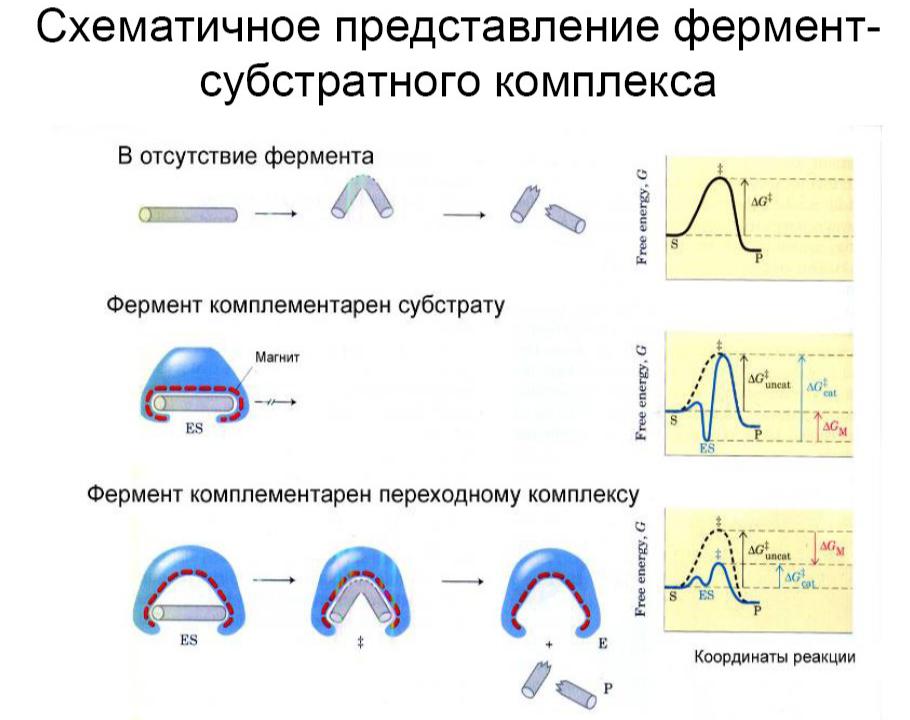

Теория индуцированного соответствия
•Индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, - а не полной перестройкой укладки белковой цепи. Смещения эти происходят в основном путем мелких локальных деформаций.
Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом.
.
Впоследствии опыт полностью подтвердил эту гипотезу, но только для тех белков, которым нужно скрыть обрабатываемый субстрат от конкурирующей с ним воды. Для действия трипсина, например, этого не нужно, и в нем индуцированного соответствия субстрату не наблюдается: трипсин (а также - химотрипсин, эластаза, субтилизин и т.д.) не деформируется и опознает субстрат по простейшему принципу "ключ - замок".
•.

Субстратная специфичность химотрипсина
Химотрипсин - ферментный препарат протеолитического действия, получаемый из поджелудочной железы крупного рогатого скота. Гидролизует белки и пептиды, расщепляет связи, образованные остатками ароматических аминокислот (тирозин, триптофан, фенилаланин, метионин) при участии воды.


