
Ионное произведение воды. Водородный показатель
Вода является слабым электролитом, поэтому в любом водном растворе существует равновесие
![]() ,
,
которое количественно характеризуется константой диссоциации:
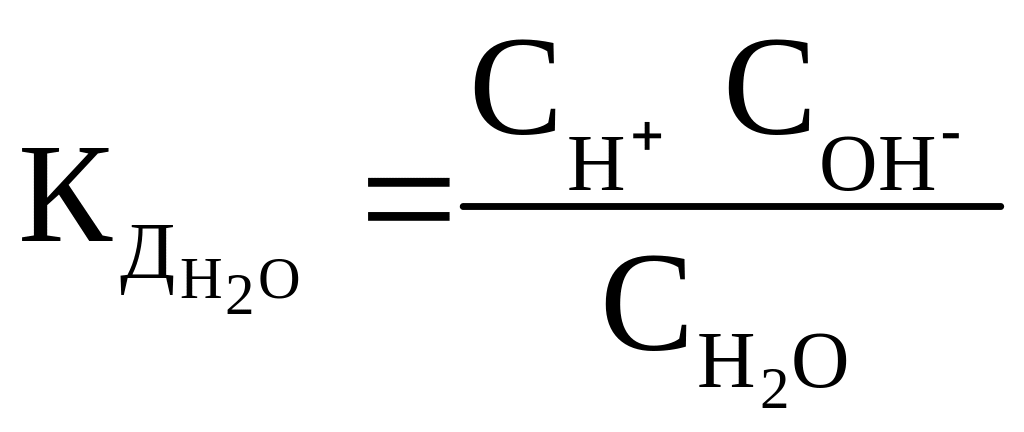 =1,86·10–16
при 298 К.
=1,86·10–16
при 298 К.
Численное значение
![]() определено экспериментально по данным
электропроводности воды. Равновесная
концентрация недиссоциированных молекул
воды
определено экспериментально по данным
электропроводности воды. Равновесная
концентрация недиссоциированных молекул
воды
![]() практически равна ее молярной концентрации,
которая для воды объемом 1 л составляет
практически равна ее молярной концентрации,
которая для воды объемом 1 л составляет
![]() моль/л
(1000/18) и является постоянной величиной.
Произведение двух постоянных КД
и
дает новую постоянную, называемую
константой
воды
моль/л
(1000/18) и является постоянной величиной.
Произведение двух постоянных КД
и
дает новую постоянную, называемую
константой
воды
![]() или ионным произведением воды:
или ионным произведением воды:
|
(2.13) |
Величина ионного
произведения воды (![]() )
остается постоянной при неизменной
температуре (298 К) не только в чистой
воде, но и в любом водном растворе
электролита (кислоты, основания, соли).
Тогда
)
остается постоянной при неизменной
температуре (298 К) не только в чистой
воде, но и в любом водном растворе
электролита (кислоты, основания, соли).
Тогда
|
(2.14) |
В чистой воде
![]() моль/л.
моль/л.
Для практической оценки характера среды в водных растворах используется водородный показатель рН.
Водородный показатель (рН) – отрицательный десятичный логарифм молярной концентрации ионов водорода в растворе
|
(2.15) |
Гидроксильный показатель (рОН) – отрицательный десятичный логарифм молярной концентрации гидроксид-ионов в растворе
|
(2.16) |
||
Тогда при 298 К |
|
(2.17) |
|
Таблица 2.1
Значение рН и рОН в различных средах при стандартных условиях
Среда |
|
|
рН |
рОН |
Кислая |
> 1 · 10–7 до 1 |
< 1 · 10–7 |
< 7 |
> 7 |
Нейтральная |
1 · 10–7 |
1 · 10–7 |
7 |
7 |
Щелочная |
< 1 · 10–7 |
>1 · 10–7 |
> 7 |
< 7 |
14.1-й закон термодинамики. Внутренняя энергия (U) и энтальпия системы (Н) и их взаимосвязь. Физический смысл.
Термодинамика-наука, изучающая связи между превращениями в-ва и превращениями энергии.Термодинамика изучает возможность или невозможность самопроизвольного перехода системы из одного состояния в другое и энерг эффекты этих переходов. Знание хим.термодинамики позволяет: 1)предсказать условия устойчивости веществ и возможность их взаимодействия; 2)рассчитать тепловые балансы ф-х процессов; 3) раскрыть закономерности наблюдаемые при равновесии; 4) выбрать оптимальные режимы процесса Т, Р, С и др. хар.; 5) определить пути подавления или полного прекращения нежелательных реакций.
Функции состояния: т-д состояние систему описывается функциями состояния, которые определяются через параметры состояния P, T, V. Изменение хотя бы одного из них влечет изменение всех функций состояния. Функции состояния не зависят от пути и времени процесса, приводящие систему в данное состояние, а определяются только начальным и конечным состоянием системы.К функциям состояния относят: U внутренняя энергия; Н энтальпия;
Первый закон т/д. Внутренняя энергия, энтальпия: определение, физический смысл. Первый закон т-д: Теплота и работа – это два различных и единственно возможных способа обмена внутренней энергией между системой и средой при условиях, что переход вещества через границу системы отсутствует. ∆U=Q-A.
Первый закон т-д: Теплота, подведенная к системе, расходуется на увеличение внутренней энергии и на совершение системой механической работы. Q=∆U+A , A=p∆V+Amax, Q=∆U+p∆V+Amax
p∆V – работа расширения или работа против сил внешнего давления, необходимая для удержания системы в состоянии равновесия.
Amax – максимально полезная работа, которую может совершить система при протекании в ней самопроизвольных процессов.
Для химической реакции наиболее характерна работа расширения, т.е. Amax=0 Q=∆U+p∆V.
U внутренняя энергия: любая система, состоящая их большого числа частиц, находящихся в постоянном движении, характеризуется определенным запасом энергии. E=K+П+U (полная энергия системы). В т-д рассматриваются системы, находящиеся в покое (К=0) и пренебрегают действием силовых полей (П=0). Тогда Е=U.
Внутренняя
энергия системы – это ее полная
энергия, состоящая из кинетической и
потенциальной энергии всех частиц
системы. Величина экстенсивная.
Учет всех состояний
при определении U
невозможен, поэтому при т-д изучении
системы достаточно знать изменение ее
внутренней энергии при переходе из
состояния U1 в U2.
∆U=U2-U1.
Теплота. Работа:
Изменение внутренней энергии может
происходить за счет обмена энергией
между системами или системой и средой
в двух формах: теплоты и работы.
Теплота –
мера переданной энергии за счет
хаотического столкновения молекул
соприкасающихся тел. Теплота стимулирует
хаотическое движение.
Работа – мера
переданной энергии путем упорядоченного
перемещения вещества от одной системы
к другой под действием каких-либо сил.
Работа стимулирует организованное
движение.
Теплота и работа
относятся не к состоянию системы, а к
какому-то процессу, т.е. являются
функциями процесса.
Энтальпия(теплосодержание
системы)-сумма внутр энергии системы
и работы,которую она производит против
силы внешнего давления( есть полная
энергия расширенной системы):это ф-ция
состояния: H=U+PV
[Дж]
Физический смысл
энтальпии:полная энергия расширенной
системы в изобарно-изотермических
условиях: ∆H=∆U+P∆U
15.Стандартные энтальпии образования сложных соединений из простых (ΔН0298). Закон Гесса и следствие из него.
Стандартная энтальпия образования соединения ∆Hоf,298 –энтальпия р-ции образования 1 моля этого соединения в ст.условиях из простых в-в, находящихся в станд состоянии.Размерность кДж/моль. Стандартные условия Р=101.3кПа Т=298
Стандартные
состояния вещества – физическое
состояние, в котором чистое вещество
наиболее стабильно при стандартных
условиях. Энтальпия образования простых
веществ в стандартном состоянии принята
равной 0.
1)Закон Лавуазье-Лапласа: теплота которая выделяется при образования хим соединения равна теплоте поглощаемой при его разложении на исходные в-ва(тепловой эффект прямой р-ции равен и противоположен по знаку тепловому эффекту обратной р-ции. 2) Закон Гесса – тепловой эффект реакции не зависит от пути процесса, определяется только начальным и конечным состояниями веществ при условии что система совершает только механическую работу. Следствие: стандартная энтальпия реакции равна разности стандартных энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Характеристика индивидуального вещества – ∆Hof,298
Характеристика процесса – ∆Ho298
Численное значение теплового эффекта любой р-ции зависит от:природы реаг в-в и их агрегатного состояния.от числа молей. От температуры.
Для расчета теплового эффекта при любой исходной температуре используется уравнение Кирхгофа:
∆HоT =∆Ho298+∆Cop,298*(T-298)
Cop - Молярная изобарная теплоемкость кол-ва теплоты, необходимой для нагревания 1 моля вещества на 1К при постоянном давлении. Условно принято, что теплоемкость не зависит от температуры, поэтому можно рассмотреть изменение теплоемкости в ходе процесса.
Изменении энтальпии характеризует вещество и процесс, но тепловой эффект нельзя использовать в качестве критерия осуществимости процесса.
16.Расчет тепловых эффектов х. р. при стандартных условиях и при заданной температуре (ΔН0298 (х. р.) и ΔН0Т (х. р.)).
17.2-ой закон термодинамики. Энтропия системы (S) и её физический смысл. Стандартные энтропии веществ (S0298).
Второй закон термодинамики определяет направленность превращения энергии при переходе системы из одного состояния в другое и имеет несколько эквивалентных формулировок в зависимости от группы явлений, к которым применяется.
1)Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.(Клаузиус)
2)Невозможно всю теплоту превратить в полную работу, часть ее непременно теряется. (Кельвин-Планк) Q=T∆S (Q – рассеянная энергия, та часть теплоты, которая не может быть превращена в работу и определяет меру беспорядка в системе, ∆S – изменение энтропии). Термодинамический смысл энтропии – мера связанной энергии, отнесенная к 1К, т.е. мера перехода энергии в такую форму, из которой она не может самостоятельно переходить в другие формы.
3)Естественные процессы развиваются необратимо в направлении увеличения беспорядка (Больцман). S=К ln W – уравнение Больцмана. К- постоянная Больцмана, W- термодинамическая вероятность состояния системы – число микросостояний системы, которым можно реализовать данное макросостояние.
Статистический смысл энтропии – мера неупорядоченности системы, количественная мера хаотического движения и взаимного расположения частиц системы.
В изолированных системах энтропия самопроизвольно протекающего процесса возрастает, в случае неизолрованных систем энтропия в ходе процесса может как увеличиваться так и уменьшаться:
Увеличение-расширение газов,фазовые превражение (т-ж-г),растворение кристалических в-в
Уменьшение-сжатие газов,конденсация и кристализация в-в (г-ж-т)
В отличие от других т-д функций для любого вещества можно определить абсолютное значение энтропии, т.к каждое вещество в определенном агрегатном состоянии имеет свой собственный «беспорядок», обусловленный его природой.
Стандартная энтропия вещества ( So298) – это энтропия 1 моля вещества в его стандартном состоянии при стандартных условиях. Значения в таблице.[Дж/мольК]
18.Он
19.Расчет изменения энтропии химических реакций при ст. у. (ΔS0298 (х. р.)) и при заданной температуре (ΔS0 Т (х. р.)).
20.Уравнение, объединяющее 1-й и 2-й законы термодинамики. Свободная энергия Гиббса (G) и её физический смысл.
Уравнение,
объединяющее первый и второй законы
т/д. Свободная энергия Гиббса или
изобарно-изотермический потенциал (G)
и его изменение (ΔG) в
физико-химических
процессах при стандартных условиях и
заданной температуре Т.
Вывод основного
уравнения т-д
Первый закон
Q=∆U+p∆V+Amax
Второй закон
Q=T∆S
T∆S=∆U+p∆V+Amax=∆H+Amax
Amax=
T∆S-∆H=
(TS2-TS1)-(H2-H1)=
(H1-TS1)-(H2-TS2)
Функция (H-TS)
– энергия Гиббса
Amax=
G1-G2= -(G2-G1)=
- ∆G
Основное уравнение
т-д ∆G=∆H-T∆S
Физический смысл
∆G – это та часть
энергетического эффекта реакции,
которую можно превратить в работу в
обратном процессе при P,T=const
Свободная энергия
Гиббса: Из основного уравнения т-д
следует 2-ой подход в определении
физического смысла энергии Гиббса.
Разность между полной энергией
расширенной системы и ее связанной
энергией есть свободная энергия системы
∆G.
21.Свободная и связанная энергии системы. Роль энтальпийного и энтропийного факторов в определении направленности протекания самопроизвольных процессов.
22.Термодинамические условия протекания обратимых х. р. и наступления равновесия. Расчет температуры равновесия.
Термодинамическое
условие равновесия
Пределом убыли
свободной энергии Гиббса при
самопроизвольном протекании процесса
является ее минимальное значение,
отвечающее состоянию равновесия. Такое
состояние системы наиболее устойчиво,
всякое отклонение от него требует
затрат энергии. ∆G=0,
∆H-T∆S=0
В состоянии
термодинамического равновесия оба
процесса в системе равновероятны.
Пренебрегая
зависимостью ∆H и ∆S
от температуры можно приближенно
определить температуру наступления
равновесия :
Tравн=∆Ho298/∆So298
Взаимосвязь между
константой равновесия и изобарным
потенциалом выражается уравнением
изотермы хим р-ции.
____________________________________
23.Электрохимические процессы и системы. Понятие электродов, природа возникновения электродных потенциалов (φ, В).(стр.31)
Электрохимические процессы можно разделить на две основные группы:
1) процессы превращения химической энергии самопроизвольно идущих окислительно-восстановительных реакций в электрическую (в гальванических элементах);
2) процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником 2-го рода) служат растворы, расплавы электролитов или твердые электролиты.
Электрод – система, состоящая из двух контактирующих фаз: материала с электронной проводимостью и ионного проводника.
Электроды бывают:
1) инертные (нерастворимые), не способные окисляться в ходе реакции, например графитовые или платиновые;
2) активные (растворимые), способные окисляться в ходе реакции. В общем случае это любой металл, кроме благородного. В зависимости от условий эксплуатации некоторые активные металлы могут вести себя как инертные из-за явления пассивации.
Все металлы характеризуются свойством в большей или в меньшей степени растворяться в воде. Под действием полярных молекул (диполей) воды ионы поверхностного слоя металла отрываются и в гидратированном состоянии переходят в жидкость. При этом пластина металла заряжается отрицательно (из-за появления в ней избыточных электронов), а слой электролита у ее поверхности – положительно (гидратированные катионы металла). В результате электростатического притяжения противоположных зарядов на границе металл – раствор возникает двойной электрический слой и разность потенциалов в нем. С увеличением концентрации катионов у поверхности металла становится вероятным обратный процесс – восстановление ионов металла. Когда скорости указанных процессов сравняются, в системе устанавливается равновесие, которое можно выразить уравнением
Me + |
(3.1) |
Состояние равновесия зависит от активности металла, концентрации его ионов в растворе и численно характеризуется константой равновесия, которая для данной гетерогенной системы при P = const равна
|
(3.2) |
Для
активных металлов
(Zn,
Fe,
Cr
и др.) равновесие
(3.1)
смещено вправо (КР>1).
Например, Zn ![]() (
(![]() ).
При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы металла
будут переходить в раствор и поверхность
металла зарядится отрицательно, а
раствор электролита – положительно.
).
При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы металла
будут переходить в раствор и поверхность
металла зарядится отрицательно, а
раствор электролита – положительно.
Для малоактивных
металлов (Cu,
Ag,
Hg
и др.) равновесная концентрация ионов
металла в растворе очень мала и равновесие
(3.1)
смещается влево (КР<1).
Например, Cu ![]()
![]() При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы
металла из раствора
будут переходить на поверхность металла
и она зарядится положительно, а раствор
электролита – отрицательно.
При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы
металла из раствора
будут переходить на поверхность металла
и она зарядится положительно, а раствор
электролита – отрицательно.
Потенциал, возникающий на металлическом электроде, находящемся в равновесии с собственными ионами в растворе электролита, называется электродным потенциалом (φ, В).
24.Металлические и газовые электроды, их схематическая запись. Уравнения электродных реакций.(стр.32)
Электроды, обратимые относительно своих ионов в растворе электролита, называются электродами 1-го рода. К ним относятся металлические и газовые электроды: водородный, кислородный.

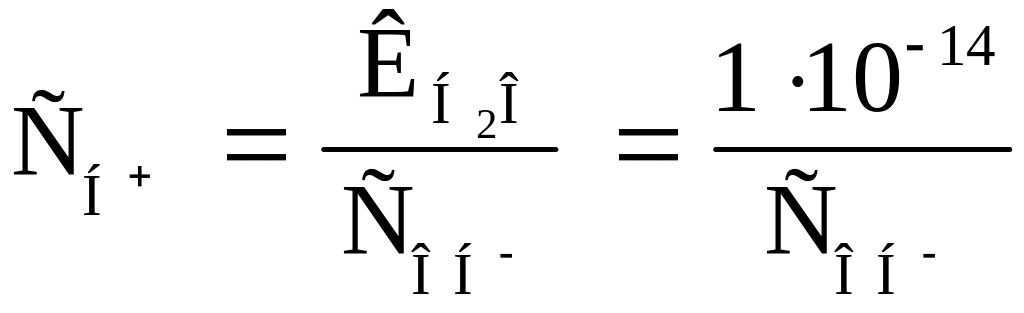 ;
; 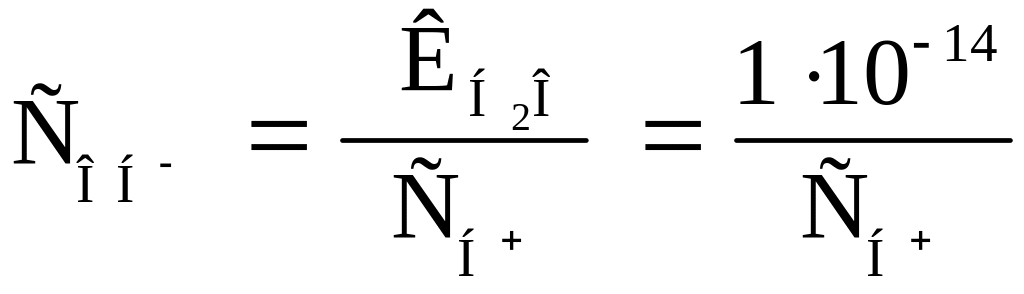 .
.