
Термодинамическая система.
Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Для описания термодинамической системы вводят так называемые термодинамические величины — набор физических величин, значения которых определяют термодинамическое состояние системы. Примерами термодинамических величин являются:
температура
давление
объем
внутренняя энергия
энтропия - в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния
энтальпия - термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц
свободная энергия Гельмгольца - термодинамический потенциал, убыль которого в квазистатическомизотермическом процессе равна работе, совершённой системой над внешними телами
энергия Гиббса - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции
Если термодинамическое состояние системы не меняется со временем, то говорят, что система находится в состоянии равновесия. Строго говоря, термодинамические величины, приведённые выше, могут быть определены только в состоянии термодинамического равновесия.
Термодинамические системы подразделяются на однородные по составу (например, газ в сосуде) и неоднородные (вода и пар или смесь газов в сосуде).
Выделяют также изолированные системы, то есть системы, которые не обмениваются с окружающей средой ни энергией, ни веществом, и закрытые системы, которые обмениваются со средой только энергией, но не обмениваются веществом. Если же в системе происходят обменные процессы с окружающей средой, то её называют открытой.
Состояние термодинамической системы
В курсе механики было введено понятие физической системы (системы тел), для описания изменений которой используются законы динамики. Такую систему называют механической системой. Когда кроме законов механики требуется применение законов термодинамики, систему называют термодинамической системой. Необходимость использования этого понятия возникает, если число элементов системы (например, число молекул газа) весьма велико, и движение отдельных её элементов является микроскопическим по сравнению с движением самой системы или ее макроскопических составных частей. При этом термодинамика описывает макроскопические движения (изменения макроскопических состояний) термодинамической системы.
Параметры, описывающие такое движение (изменения) термодинамической системы, принято разделять на внешние и внутренние. Это разделение весьма условно и зависит от конкретной задачи. Так, например, газ в воздушном шаре с эластичной оболочкой в качестве внешнего параметра имеет давление окружающего воздуха, а для газа в сосуде с жёсткой оболочкой внешним параметром является объём, ограниченный этой оболочкой. В термодинамической системе объём и давление могут изменяться независимо друг от друга. Для теоретического описания их изменения необходимо введение как минимум еще одного параметра - температуры.
В большинстве термодинамических задач трёх параметров достаточно для описания состояния термодинамической системы. В этом случае изменения в системе описываются с помощью трёх термодинамических координат, связанных с соответствующими термодинамическими параметрами.
Равновесным состоянием - состоянием термодинамического равновесия - называется такое состояния термодинамической системы, в котором отсутствуют всякие потоки (энергии, вещества, импульса и т.д.), а макроскопические параметры системы являются установившимися и не изменяются во времени.
Классическая термодинамика утверждает, что изолированная термодинамическая система (предоставленная себе самой) стремится к состоянию термодинамического равновесия и после его достижения не может самопроизвольно из него выйти. Данное утверждение часто называю нулевым началом термодинамики.
Системы, находящиеся в состоянии термодинамического равновесия, обладают следующими свойствами:
Если две термодинамические системы, имеющие тепловой контакт, находятся в состоянии термодинамического равновесия, то и совокупная термодинамическая система находится в состоянии термодинамического равновесия.
Если какая-либо термодинамическая система находится в термодинамическом равновесии с двумя другими системами, то и эти две системы находятся в термодинамическом равновесии друг с другом.
Далее, если не будет специально оговорено, нами будут рассматриваться термодинамические системы, находящиеся в состоянии термодинамического равновесия. Описание систем, находящихся в неравновесном состоянии, то есть в состоянии, когда имеют место макроскопические потоки, занимается неравновесная термодинамика, краткое изложение основных положений которой приведено в четвертой и шестой главах.
Переход из одного термодинамического состояния в другое называется термодинамическим процессом. Ниже, если не будет особо оговорено, будут рассматриваться только квазистатические процессы или, что то же самое, квазиравновесные процессы. Предельным случаем квазиравновесного процесса является происходящий бесконечно медленно равновесный процесс, состоящий из непрерывно следующих друг за другом состояний термодинамического равновесия. Реально такой процесс протекать не может, однако если макроскопические изменения в системе происходят достаточно медленно (за промежутки времени, значительно превышающие время установления термодинамического равновесия), появляется возможность аппроксимировать реальный процесс квазистатическим (квазиравновесным). Такая аппроксимация позволяет проводить вычисления с достаточно высокой точностью для большого класса практических задач. Равновесный процесс является обратимым, то есть таким, при котором возвращение к значениям параметров состояния, имевшим место в предыдущий момент времени, должно приводить термодинамическую систему в предыдущее состояние без каких-либо изменений в окружающих систему телах.
Практическое применение квазиравновесных процессов в каких-либо технических устройствах малоэффективно. Так, использование в тепловой машине квазиравновесного процесса, например, происходящего при практически постоянной температуре (см. описание цикла Карно в третьей главе), неминуемо приводит к тому, что такая машина будет работать очень медленно (в пределе - бесконечно медленно) и иметь очень малую мощность. Поэтому на практике квазиравновесные процессы в технических устройствах не используются. Тем не менее, так как предсказания равновесной термодинамики для реальных систем с достаточно высокой точностью совпадают с экспериментально полученными для таких систем данными, то она широко применяется для расчета термодинамических процессов в различных технических устройствах.
Если в ходе термодинамического процесса система возвращается в исходное состояние, то такой процесс называется круговым или циклическим. Круговые процессы, также как и любые другие термодинамические процессы, могут быть как равновесными (а следовательно - обратимыми), так и неравновесными (необратимыми). При обратимом круговом процессе после возвращения термодинамической системы в исходное состояние в окружающих ее телах не возникает никаких термодинамических возмущений, и их состояния остаются равновесными. В этом случае внешние параметры системы после осуществления циклического процесса возвращаются к своим исходным значениям. При необратимом круговом процессе после его завершения окружающие тела переходят в неравновесные состояния и внешние параметры термодинамической системы изменяются.
Первое начало термодинамики.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным. Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
![]()
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале μ, и работы A', совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил
ΔU = Q − A + μΔN + A'.
Рассмотрим несколько частных случаев:
Если δQ > 0, то это означает, что тепло к системе подводится.
Если δQ < 0, аналогично — тепло отводится.
Если δQ = 0, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая:
в конечном процессе ![]() элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q —
это алгебраическая сумма количеств
теплоты, сообщаемых на всех участках
этого процесса. В ходе процесса теплота
может поступать в систему или уходить
из неё разными способами.
элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q —
это алгебраическая сумма количеств
теплоты, сообщаемых на всех участках
этого процесса. В ходе процесса теплота
может поступать в систему или уходить
из неё разными способами.
Первое начало термодинамики:
при изобарном процессе
![]()
при изохорном процессе (A = 0)
![]()
при изотермическом процессе (ΔU = 0)
![]()
Здесь ![]() — масса газа,
— масса газа, ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при
постоянном объёме,
— молярная
теплоёмкость при
постоянном объёме, ![]() — давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единицы измерения: Джоули Дж
Рассмотрим систему, состоящую из двух тел A и B. Предположим, что тело B заключено почти полностью в жёсткую адиабатическую оболочку, так что оно не способно совершать макроскопическую работу, а обмениваться теплом (то есть энергией) посредством микроскопических процессов может лишь с телом A. Предположим, что тело A также заключено в адиабатическую оболочку почти полностью, так что для него возможен теплообмен лишь с B, но не будем предполагать, что оболочка жёсткая. Количеством теплоты, сообщённой телу A в некотором процессе, будем называть величину QA = − ΔUB, где ΔUB — изменение внутренней энергии тела B. Согласно закону сохранения энергии,
ΔA = ΔUA + ΔUB
где ΔA — макроскопическая работа внешних сил над телом A. Если учесть, что
ΔA = − Aint
где Aint — работа, совершённая телом A, то закону сохранения энергии можно придать форму первого начала термодинамики:
ΔQA = ΔUA + Aint
Из первого начала термодинамики следует корректность введённого определения количества теплоты, то есть независимость соответствующей величины от выбора пробного тела B и способа теплообмена между телами. Заметим, что для определения количества теплоты необходимо пробное тело, в противном случае первое начало теряет смысл содержательного закона и превращается в определение количества теплоты (весьма бесполезное в таком виде). При определении количества теплоты независимо от ΔA и ΔUA первое начало становится содержательным законом, допускающим экспериментальную проверку.
Отметим, что, как и совершённая работа, количество переданной теплоты зависит от конкретного процесса, совершённого над телом.
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
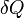 —
подведённая
к телу теплота,
измеренная в джоулях
—
подведённая
к телу теплота,
измеренная в джоулях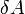 — работа,
совершаемая телом против внешних сил,
измеренная в джоулях
— работа,
совершаемая телом против внешних сил,
измеренная в джоулях
U = A/q Эта формула является математическим выражением первого начала термодинамики
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа не
зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости при
постоянном объёме,  .
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
.
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
 .
.
Эта же формула верна и для вычисления изменения внутренней энергии любого тела, но только в процессах при постоянном объёме (изохорных процессах); в общем случае CV(T,V) является функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
ΔU = νCVΔT,
где ν — количество вещества, ΔT — изменение температуры.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
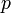 — давление,
— давление, — молярный
объём,
— молярный
объём,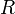 — универсальная
газовая постоянная
— универсальная
газовая постоянная — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как ![]() ,
где
,
где ![]() — количество
вещества,
а
— количество
вещества,
а ![]() ,
где
—
масса,
— молярная
масса,
уравнение состояния можно записать:
,
где
—
масса,
— молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() — закон
Бойля — Мариотта.
— закон
Бойля — Мариотта.
![]() — Закон
Гей-Люссака.
— Закон
Гей-Люссака.
![]() — закон Шарля (второй
закон Гей-Люссака, 1808 г.)
— закон Шарля (второй
закон Гей-Люссака, 1808 г.)
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С
другой стороны, в сильно сжатом и,
следовательно, более плотном газе
молекулы заметно притягиваются к другим
молекулам гораздо большую часть времени,
чем молекулы в разреженном газе. Это,
наоборот, уменьшает число ударов молекул
в стенку, так как при наличии притяжения
к другим молекулам молекулы газа движутся
по направлению к стенке с меньшей
скоростью, чем при отсутствии притяжения.
При не слишком больших давлениях более
существенным является второе обстоятельство
и произведение ![]() немного
уменьшается. При очень высоких давлениях
большую роль играет первое обстоятельство
и произведение
увеличивается.
немного
уменьшается. При очень высоких давлениях
большую роль играет первое обстоятельство
и произведение
увеличивается.
Политропические процессы
Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где
величина ![]() называется
показателем политропы.
называется
показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
Здесь γ — показатель адиабаты.
4.
Изохорный процесс: ![]() ,
так как
,
так как ![]() ,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1 обратились
в 1, n должна быть бесконечность.
,
значит P1 / P2 =
(V2 / V1)n,
значит V2 / V1 =
(P1 / P2)(1
/ n),
значит, чтобы V2 / V1 обратились
в 1, n должна быть бесконечность.
Энтропия
Энтропи́я (от др.-греч. ἐντροπία «поворот», «превращение») в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; \
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения ее частиц.
Дифференциальная энтропия — энтропия для непрерывных распределений
Энтропия динамической системы — в теории динамических систем мера хаотичности в поведении траекторий системы.
Энтропия — функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы.
Энтропия — функция, устанавливающая связь между макро- и микро- состояниями; единственная функция в физике, которая показывает направленность процессов. Энтропия — функция состояния системы, которая не зависит от перехода из одного состояния в другое, а зависит только от начального и конечного положения системы.
Второе начало термодинамики.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло Q1 у нагревателя, отдав Q2холодильнику и совершив при этом работу A = Q1 − Q2. После этого воспользуемся процессом Клаузиуса и вернем тепло Q2 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S(T,x,N), называемая энтропией, такая, что ее полный дифференциал dS = δQ / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы.
Барометрическая формула
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекул по скоростям делалось предположение, что внешние силы не действуют на молекулы газа, поэтому молекулы равномерно распределены по объему. Но молекулы любого газа находятся в потенциальном поле тяготения Земли. Сила тяжести, с одной стороны, и тепловое движение молекул — с другой, приводят газ к некоторому стационарному состоянию, при котором давление газа с высотой уменьшается. Выведем закон изменения давления с высотой, предполагая при этом, что масса всех молекул одинакова, поле тяготения однородно и температура постоянна.

Если
атмосферное давление на высоте h равно
р , то на высоте h+dh оно равно p+dp (при dh>0
dp<0, так как давление с высотой
уменьшается). Разность давлений р и p+dp
равна весу газа, заключенного в объеме
цилиндра высотой dh с основанием площадью
1 м2:
![]() где
ρ — плотность газа на высоте h (dh настолько
мало, что при изменении высоты в этом
интервале плотность газа можно считать
постоянной). Значит,
где
ρ — плотность газа на высоте h (dh настолько
мало, что при изменении высоты в этом
интервале плотность газа можно считать
постоянной). Значит,
![]() (1)
Зная
уравнение состояния идеального газа
pV=(m/M) RT (m — масса газа, М — молярная масса
газа), находим, что
(1)
Зная
уравнение состояния идеального газа
pV=(m/M) RT (m — масса газа, М — молярная масса
газа), находим, что
![]()
Подставив
это выражение в (1), получим
![]() или
или ![]() С
изменением высоты от h1 до
h2 давление
изменяется от р1 до
р2 (рис.
67), т. е.
С
изменением высоты от h1 до
h2 давление
изменяется от р1 до
р2 (рис.
67), т. е.
![]() или
или
![]() (2)
Выражение
(2) называется барометрической
формулой.
Она позволяет вычислить атмосферное
давление в зависимости от высоты или,
измеряя давление, найти высоту: Так как
высоты считаются относительно уровня
моря, где давление считается нормальным,
то выражение (2) может быть представлено
в виде
(2)
Выражение
(2) называется барометрической
формулой.
Она позволяет вычислить атмосферное
давление в зависимости от высоты или,
измеряя давление, найти высоту: Так как
высоты считаются относительно уровня
моря, где давление считается нормальным,
то выражение (2) может быть представлено
в виде
![]() (3)
где
р — давление на высоте h.
Прибор
для определения высоты над земной
поверхностью называется высотомером (или альтиметром).
Его работа основана на применении
формулы (3). Из этой формулы следует, что
чем тяжелее газ, тем давление с высотой
убывает тем быстрее.
Барометрическую
формулу (3) можно преобразовать, если
воспользоваться формулой p=nkT:
где
n – концентрация молекул на высоте h,
n0 –
то же, на высоте h=0. Так как M=m0NA (NA –
постоянная Авогадро, m0 –
масса одной молекулы), a R=kNA,
то
(3)
где
р — давление на высоте h.
Прибор
для определения высоты над земной
поверхностью называется высотомером (или альтиметром).
Его работа основана на применении
формулы (3). Из этой формулы следует, что
чем тяжелее газ, тем давление с высотой
убывает тем быстрее.
Барометрическую
формулу (3) можно преобразовать, если
воспользоваться формулой p=nkT:
где
n – концентрация молекул на высоте h,
n0 –
то же, на высоте h=0. Так как M=m0NA (NA –
постоянная Авогадро, m0 –
масса одной молекулы), a R=kNA,
то
![]() (4)
где
m0gh=P
— потенциальная энергия молекулы в
поле тяготения, т. е.
(4)
где
m0gh=P
— потенциальная энергия молекулы в
поле тяготения, т. е.
![]() (5)
Выражение
(5) называется распределением
Больцмана для
внешнего потенциального поля. Из него
видно, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если
частицы находятся в состоянии хаотического
теплового движения и имеют одинаковую
массу и , то распределение Больцмана
(5) применимо в любом внешнем потенциальном
поле, а не только в поле сил тяжести.
(5)
Выражение
(5) называется распределением
Больцмана для
внешнего потенциального поля. Из него
видно, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если
частицы находятся в состоянии хаотического
теплового движения и имеют одинаковую
массу и , то распределение Больцмана
(5) применимо в любом внешнем потенциальном
поле, а не только в поле сил тяжести.
Вязкость
Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Различают динамическую вязкость (единицы измерения: пуаз, 0,1Па·с) и кинематическую вязкость (единицы измерения: стокс, м²/с, внесистемная единица — градус Энглера). Кинематическая вязкость может быть получена как отношение динамической вязкости к плотности вещества и своим происхождением обязана классическим методам измерения вязкости, таким как измерение времени вытекания заданного объёма через калиброванное отверстие под действием силы тяжести.
Прибор для измерения вязкости называется вискозиметром.
Сила вязкого трения пропорциональна скорости относительного движения V тел, пропорциональна площади S и обратно пропорциональна расстоянию между плоскостями h.
![]()
Коэффициент пропорциональности, зависящий от сорта жидкости или газа, называют коэффициентом динамической вязкости.
Качественно существенное отличие сил вязкого трения от сухого трения, кроме прочего, то, что тело при наличии только вязкого трения и сколь угодно малой внешней силы обязательно придет в движение, то есть для вязкого трения не существует трения покоя, и наоборот - под действием только вязкого трения тело, вначале двигавшееся, никогда (в рамках макроскопического приближения, пренебрегающего броуновским движением) полностью не остановится, хотя движение и будет бесконечно замедляться.
Вторая вязкость, или объёмная вязкость — внутреннее трение при переносе импульса в направлении движения. Влияет только при учёте сжимаемости и/или при учёте неоднородности коэффициента второй вязкости по пространству.
Если динамическая (и кинематическая) вязкость характеризует деформацию чистого сдвига, то вторая вязкость характеризует деформацию объёмного сжатия.
Вязкость газов
В кинетической теории газов коэффициент внутреннего трения вычисляется по формуле
![]() ,
,
где ![]() —
средняя скорость теплового движения
молекул,
—
средняя скорость теплового движения
молекул, ![]() −
средняя длина свободного пробега. Из
этого выражения в частности следует,
что вязкость не очень разреженных газов
практически не зависит от давления,
поскольку плотность ρ прямо
пропорциональна давлению, а
-
обратно пропорциональна. Такой же вывод
следует и для других кинетических
коэффициентов для газов, например,
для коэффициента
теплопроводности.
Однако этот вывод справедлив только до
тех пор, пока разрежение газа не становится
столь малым, что отношение длины
свободного пробега к линейным размерам
сосуда не становится по порядку величины
равным единице;
−
средняя длина свободного пробега. Из
этого выражения в частности следует,
что вязкость не очень разреженных газов
практически не зависит от давления,
поскольку плотность ρ прямо
пропорциональна давлению, а
-
обратно пропорциональна. Такой же вывод
следует и для других кинетических
коэффициентов для газов, например,
для коэффициента
теплопроводности.
Однако этот вывод справедлив только до
тех пор, пока разрежение газа не становится
столь малым, что отношение длины
свободного пробега к линейным размерам
сосуда не становится по порядку величины
равным единице;
С
повышением температуры вязкость
большинства газов увеличивается, это
объясняется увеличением средней скорости
молекул газа u,
растущей с температурой как ![]()
Влияние температуры на вязкость газов
Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:

где:
μ = динамическая вязкость в (Па·с) при заданной температуре T,
μ0 = контрольная вязкость в (Па·с) при некоторой контрольной температуре T0,
T = заданная температура в Кельвинах,
T0 = контрольная температура в Кельвинах,
C = постоянная Сазерленда для того газа, вязкость которого требуется определить.
Эту формулу можно применять для температур в диапазоне 0 < T < 555 K и при давлениях менее 3,45 МПа с ошибкой менее 10%, обусловленной зависимостью вязкости от давления.
Вязкость жидкостей Динамический коэффициент вязкости
Внутреннее трение жидкостей, как и газов, возникает при движении жидкости вследствие переноса импульса в направлении, перпендикулярном к направлению движения. Справедлив общий закон внутреннего трения — закон Ньютона:
![]()
Коэффициент вязкости η (динамическая вязкость) может быть получен на основе соображений о движениях молекул. Очевидно, что η будет тем меньше, чем меньше время t «оседлости» молекул. Эти соображения приводят к выражению для коэффициента вязкости, называемому уравнением Френкеля-Андраде:
η = Cew / kT
Иная формула, представляющая коэффициент вязкости, была предложена Бачинским. Как показано, коэффициент вязкости определяется межмолекулярными силами, зависящими от среднего расстояния между молекулами; последнее определяется молярным объёмом вещества VM. Многочисленные эксперименты показали, что между молярным объёмом и коэффициентом вязкости существует соотношение
![]()
где с и b — константы. Это эмпирическое соотношение называется формулой Бачинского.
Динамическая вязкость жидкостей уменьшается с увеличением температуры, и растёт с увеличением давления.
Кинематическая вязкость
В технике, в частности, при расчёте гидроприводов и в триботехнике, часто приходится иметь дело с величиной
![]()
и эта величина получила название кинематической вязкости. Здесь ρ — плотность жидкости; η — динамическая вязкость (см. выше).
Кинематическая вязкость в старых источниках часто указана в сантистоксах (сСт). В систему СИ эта величина переводится следующим образом:
1 сСт = 1мм2 / 1c = 10 − 6 м2 / c
