
Денисенко 4 сем (билеты)
.pdf
a-Аминокислоты являются бифункциональными соединениями, содержащими аминную и карбоксильную группы. Реакции по этим группам являются общими для различных аминокислот: 1) по аминной группе - реакции трансаминирования и дезаминирования; 2) по карбоксильной группе - реакции декарбоксилирования, образования аминоациладенилатов; 3) реакции по радикалу являются специфичными для каждой аминокислоты.
Для освобождения аммиака аминокислоты подвергаются реакциям трансаминирования с последующим дезаминированием. Аминогруппы аминокислот утилизируются для синтеза мочевины, которая экскретируется как конечный продукт метаболизма белков.
Углеродный скелет аминокислот сначала превращается в кетокислоты, которые используются для получения энергии, синтеза глюкозы, кетоновых тел и незаменимых аминокислот.
Трансаминирование
Трансаминирование является первым этапом и основным путем метаболизма аминокислот. Трансаминирование (переаминирование) – реакции межмолекулярного переноса аминогруппы от аминокислоты на a-кетокислоту без промежуточного образования аммиака. Этот процесс открыт в 1937 году Е. А. Браунштейном и М. Г. Крицман. По меньшей мере 11 аминокислот способны вступать в реакции трансаминирования.
1.Реакции трансаминирования являются универсальными у всех живых организмов. Трансаминирование катализируют ферменты аминотрансферазы (трансаминазы). Для каждой пары аминокислоты и кетокислоты существует свой фермент.
Аспартатаминотрансфераза (АсАТ) и аланинаминотрансфераза (АлАТ) являются основными трансаминазами.
2. Коферментом трансаминаз является пиридоксальфосфат–производное витамина В6 (пиридоксол, пиридоксин). Пиридоксальфосфат функционирует как переносчик аминогруппы в активном центре трансаминаз. Трансаминазы подвергаются обратимому превращению между альдегидной формой (пиридоксальфосфатом), которая является акцептором аминогруппы, и аминированной формой, пиридоксаминфосфатом, которая является донором аминогруппы на α-кетокислоту.
Ферментысодержатся в цитозоле и митохондриях клеток.
4.Реакции трансаминирования обратимы.
5.Основными кетокислотами, принимающими участие в трансаминировании, являются
пируват, оксалоацетат и2-оксоглутарат.
6.Трансаминирование происходит при катаболизме и анаболизме аминокислот и является пунктом "переключения" метаболических превращений. В процессе трансаминирования происходит перераспределение аминогрупп и синтез заменимых аминокислот.

7. Происходит накопление a-аминогрупп в форме одной аминокислоты - глутаминовой кислоты, которая затем подвергается дезаминированию.
1)a-АК + 2-оксоглутарат « a-кетокислота + ГЛУТАМАТ
2)a-АК + оксалоацетат « a-кетокислота + аспартат
аспартат + 2-оксоглутурат « оксалоацетат + ГЛУТАМАТ (АсАТ)
3) a-АК + пируват « a-кетокислота + аланин
аланин + 2-оксоглутарат « пируват + ГЛУТАМАТ (АлАТ)
8. Для лабораторной практики особое значение имеет определение активности АлАТ и АсАТ. Их активность в клетках превышает активность в сыворотке крови. Эти ферменты появляются в сыворотке крови при повреждениях тканей. При поражении сердца преимущественно повышается активность сывороточной АсАТ, а при повреждениях гепатоцитов - АлАТ.
Значение аминокислот для организма в первую очередь определяется тем, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Объясняется это тем, что белки входят во все основные структурные компоненты клеток, тканей и органов тела человека и животных, выполняют ферментативные функции, участвуют в переносе веществ через мембраны и т.д. Важную роль в координации работы всех систем клеток играют белковые гормоны. Аминокислоты непосредственно участвуют в биосинтезе не

только белков, но и большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны - производные аминокислот. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклео-тидов, тема, креатина, холина и других веществ. Катаболизм аминокислот может служить источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет и др.) и преимущественно белковом питании. Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений. Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
8. Катаболизм углеродного скелета АК. Кетогенные и гликогенные аминокислоты.
Превращение углеродного скелета ак
Азот аминокислот, отщепляемый, как правило, на ранних стадиях катаболизма, включается в общий метаболический пул. В зависимости от потребностей организма он может рсутилизироваться в анаболических процессах или включаться в конечный продукт обмена азота — мочевину и экскретироваться из организма.
Безазотистые углеродные остатки аминокислот образуют кислоты, чаше всего кетокислоты, которые далее деградируют по общим путям катаболизма других окисленных углеводородов
Метаболиты, образующиеся из углеродных скелетов аминокислот, либо непосредственно включаются в цикл трикарбоновых кислот, либо превращаются в пируват и через ацетилКоА деградируют до образования конечных продуктов — С02 и Н20
Катаболизм аминокислот включает два этапа:
1. дезаминирование, заключающееся в отщеплении аминогруппы с образованием a - кетокислоты

2. катаболизм углеродного скелета, то есть a -кетокислоты.
Катаболизм аминокислот в организме животных происходит в двух различных ситуация. В нормальных условиях, когда в диете присутствует избыточное количество белка, и, следовательно после переваривания и всасывания много аминокислот дезаминируются, а углеродный скелет ( a -кетокислота) или используется для конверсии в запасной жир, или для окисления и извлечения энергии. При голодании разрушаются белки тканей, и получившиеся после дезаминирования кетокислоты могут служить как для глюконеогенеза, так и для окисления.
Дезаминирование - это превращение аминокислот в соответствующие a -кетокислоты в результате отщепления аминогруппы в виде аммиака. Реакция сопровождается окислением, поэтому называется окислительным дезаминированием . Наиболее широко распространенной реакцией является окислительное дезаминирование глутаминовой кислоты, катализируемое NAD-зависимой дегидрогеназой:
Эта реакция обратима, но ее основная роль заключается в дезаминировании, хотя в некоторых органах она может протекать в сторону синтеза глутаминовой кислоты. В ходе дезаминирования глутамата аминогруппа сразу превращается в ион аммония, поэтому эта реакция называется прямое окислительное дезаминирование . Другие аминокислоты дезаминируются непрямым путем , включающим два этапа:
1.трансаминирование с a -кетоглутаратом с образованием глутамата
2.окислительное дезаминирование глутамата.

Катаболизм углеродных скелетов , полученных в результате дезаминирования аминокислот, приводит к образованию либо ацетил-СоА , а далее из него жиров или кетоновых тел ( кетогенные аминокислоты ), или образованию метаболитов, способных включаться в глюконеогенез ( гликогенные аминокислоты ) и поддерживать уровень глюкозы в крови при голодании.
Гликогенные и кетонные аминокислоты
В зависимости от потребностей организма безазотистые метаболиты могут включаться в синтез глюкозы (гликогенные аминокислоты) либо в синтез высших жирных кислот
(кетогенные аминокислоты).
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут
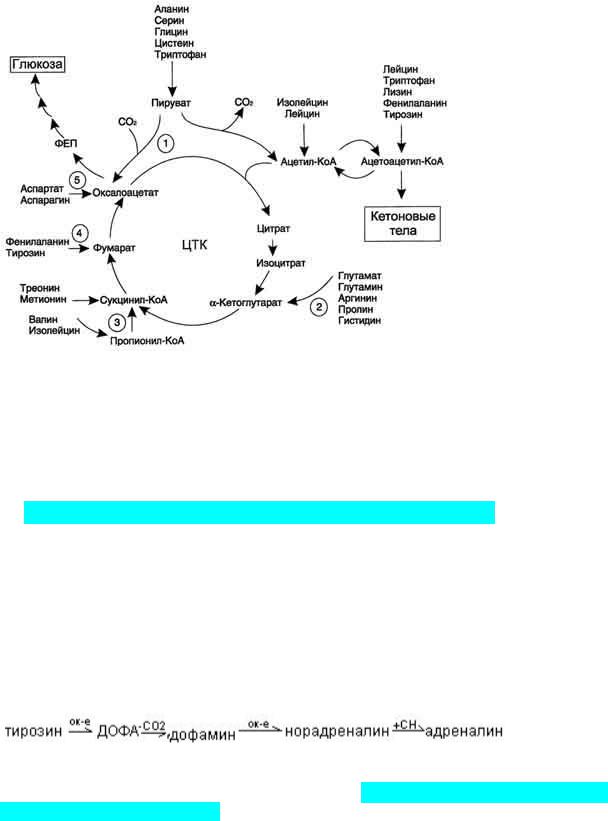
использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их
катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными
9. Биогенные амины: гистамин, серотонин, катехоламины.
Биогенные амины – это вещества, которые образуются в организме животных или растений из аминокислот и обладают высокой биологической активностью. Выполняют функции гормонов и нейромедиаторов. К биогенным аминам относятся:
-катехоламины (дофамин, адреналин, норадреналинидр.) -серотонин -мелатонин -гистаминидр
Катехоламины – это вещества, которые синтезируются из аминокислоты тирозина.
Синтезируются преимущественно в мозговом слое надпочечников и в нервных окончаниях симпатической нервной системы. Главная функция – помочь организму приспособиться к острым и хроническим стрессам. при многих заболеваниях катехоламины и их метаболиты (метанефрин и норметанефрин) секретируются в большом количестве, эти вещества удобно использовать для диагностических целей
•адреналин– катехоламин, гормон мозгового вещества надпочечников. Его секреция резко повышается при стрессовых состояниях. Адреналин вызывает спазм сосудов, повышают артериальное давление, стимулирует работу сердца, является гормоном

•Норадреналин -катехоламин, гормон мозгового вещества надпочечников. Действие сходно с действием адреналина. Обладает большим сосудосуживающим действием. в основном выполняет нейромедиаторные функции.
•Дофамин - нейромедиатор, а так же гормон, вырабатываемый мозговым слоем надпочечников и другими тканями. Является предшественником норадреналина и адреналина. Участвует в поведенческих реакциях, сне, настроении, внимании, формировании ощущения удовлетворения. Один из «гормонов счастья». возбуждающий медиатор, при его дефиците развивается болезнь Паркинсона
Клиническое значение катехоламинов: Увеличение концентрации: -феохромацитома (в 10—100 раз), -симпатобластома (в 2—10 раз),
-гипертоническая болезньI стадии (в 1,5 – 2 раза), -гипертонический криз, -почечная гипертензия,
-гипертензивная форма вегетососудистой дистонии, -черепно-мозговая и другие виды травм, -маниакальная стадия маниакально-депрессивного психоза, -острый период инфаркта миокарда, -хронический алкоголизм
!Уменьшение концентрации: -почечная недостаточность
-депрессивнаястадияманиакально-депрессивногопсихоза-миастения-миопатия-гиперкинез !Определение Допамина имеет особое значение для подтверждения диагноза нейробластомы у детей.
Серотонин– это биогенный амин, один из основных нейромедиаторов.
-при снижении серотонина повышается чувствительность болевой системы организма (даже самое слабое раздражение отзывается сильной болью)
-участвует в регуляции сосудистого тонуса -снижение уровня серотонина в мозгу приводит к депрессивным состояниям и к тяжелым формам мигрени («Гормон удовольствия»).
Увеличение концентрации серотонина :
-злокачественные новообразования желудка, кишечника и легких (выше нормы 5-10 раз) -медуллярный рак щитовидной железы, -острая кишечная непроходимость, -демпинг- синдром, -муковисцидоз -острый инфаркт миокарда.
Снижение уровня серотонина: -болезньВерльгофа -лейкозы -гиповитаминоз В6
-паренхиматозные заболевания печени -синдром Дауна.

Гистамин – биогенный амин, содержащийся главным образом в базофильных лейкоцитах и тучных клетках. Накопление гистамина в организме может привести к патологическим явлениям.
Гистамин высвобождается из клеток при анафилактических и аллергических реакциях, поэтому он является медиатором гиперчувствительности немедленного типа. Клиническое использование:
-измерение количества высвобождаемого гистамина при гиперчувствительности немедленного типа -количество гистамина в моче и плазме крови после проявления аллергической реакции.
Гистамин в пище
Гистамин является одним из биогенных аминов, образующихся в рыбе и некоторых других пищевых продуктах при декарбоксилировании гистидина, в том числе, в результате деятельности бактерий.
Продукты риска:
скумбрия, ставрида, сайра, макрель, тунец, сельдь, шпрот, лосось, сыр, мясо, шампанское, вино, пиво и кислая капуста.
!Уровень гистамина в пище свыше 50 мг/кг считается токсичным. !Клиническое применение.
Повышенное поступление гистамина может вызвать: -«гистаминовая» мигрень (синдром Хортона) -эрозия Желудка -головная боль и другие симптомы
III.Строение и функции ферментов. (5)
10.Общие и специфические свойства ферментов как катализаторов. Структура ферментов.
Ферменты -Белки, увеличивающие скорости биохимических реакций в тысячи, и даже миллиарды раз по сравнению со скоростями тех же реакций в отсутствие ферментов.
•фермент не способен вызвать новую химическую реакцию, он ускоряет уже идущую;
•фермент не изменяет направление реакции, определяемое концентрациями реагентов, катализирует как прямую, так и обратную реакции.
Ферменты обладают всеми свойствами белков
•они наделены амфотерными свойствами, растворимостью, легко осаждаются из водных растворов методами высаливания, добавлением ацетона, этанола и др. веществ, не теряя при этом каталитических свойств. После высаливания ферменты можно освободить от солей методом диализа.
•подвергаются денатурации, которая сопровождается потерей нативной конформации и каталитической функции. каталитическая функция и активность ферментов зависит от сохранности иативной конформации белка.
Являясь катализаторами, ферменты имеют ряд общих свойств с небиологическими катализаторами.

•Ферменты не могут возбудить те реакции, протекание которых противоречит законам термодинамики. Они ускоряют только те реакции, которые протекают и
без них
2H202 ®2H2O+O2 без катализатора требуется 75 КДж/моль (18 Ккал) энергии активации (Еа), при добавлении коллоидной платины Еа понижается до 49 КДж (11,7 Ккал), а при действии фермента каталазы - до 7 КДж (1,3 Ккал:).
•Скорость реакции катализируемой ферментом на несколько порядков выше, чем при участии небелковых катализаторов.
•Ферменты не смещают положения равновесия реакции, а лишь ускоряют его достижение.
•Ферменты не входят в состав конечных продуктов реакции и выходят из нее, как правило, в первоначальном виде, т.е. они не расходуются в процессе катализа
Для ферментов характерны и специфические свойства, отличающие их от химических катализаторов.
1.по своему химическому строению все ферменты являются белками.
2.Ферменты обладают узкой специфичностью, выражающейся в избирательном
действии на субстраты (вещества вовлекаемые в реакции).
3.У ферментов большая чувствительность и зависимость активности от температуры, рН, модуляторов и др. факторов среды, чем у небелковых катализаторов.
4.регулируемость их действия. Регуляция ферментактивного аппарата направлена на поддержание постоянства внутренней среды организма, на приспособление организма к меняющимся условиям окружающей среды.
5.характерен почти 100 % выход продуктов.
6.В процессе катализа ферменты "изнашиваются". Период полураспада от 1 часа до нескольких суток. Для поддержания метаболизма клетка постоянно ''обновляет'" ферменты.
Ферменты (энзимы) – белки, являющиеся биологическими катализаторами. По строению могут быть простыми и сложными белками. Последние состоят из белковой части (апофермента) и небелковой части (кофермента). По отдельности каталитической активностью не обладают, активны лишь вместе. Существуют мультиферментные комплексы, состоящие из нескольких ферментов
Некоторые ферменты имеют четвертичную структуру – состоят из двух и более радикалов более мелких белков (субъединиц). Некоторые ферменты могут катализировать одну реакцию, но отличаться по строению субъединиц. Их называют изоферментами. Например, креатинкиназа-1 мозга состоит из субъединиц ВВ, креатинкиназа-2 миокарда - из субъединиц ВМ, а креатинкиназа-3 скелетных мышц – из субъединиц ММ.
В молекуле фермента различают активый и аллостерический центры.
К активному присоединяется вещество, на которое действует фермент (субстрат), происходит его превращение, образуется продукт реакции. Этот центр занимает лишь часть молекулы фермента. В его составе выделяют контактный участок, к которому присоединяется субстрат и каталитический центр, где происходит ферментативная реакция. В составе каталитического центра могут быть радикалы аминокислот, содержащие группы –СООН, -ОН, -NH2и др., а у ферментов-сложных белков – и кофермент. Аллостерический центр (allos– другой) – участок фермента, к которому присоединяются вещества, отличные от субстрата, способные изменять форму активного центра, ускоряя
таким образом ферментативную реакцию (активаторы) или замедляя ее (ингибиторы). Такими веществами могут быть продукты собственной реакции, других реакций, гормоны и др.
Строение коферментов.
Витаминные коферменты.. К ним относят никотинамидные, флавиновые, тиаминовые, пиридоксалевые, пантотеновые, кобаламиновые и другие коферменты.
Никотинамидные коферменты – производные витамина РР.
К ним относят никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотид фосфат (НАДФ). НАД из соединенных между собой остатков аденозинмонофосфата (АМФ) и никотинамидрибозилмонофосфата (НМФ). Он входит в состав ферментов дегидрогеназ, отщепляющих ионы водорода от гидроксильных, альдегидных или аминогрупп. Ионы водорода присоединяются к атому углерода никотинамида, находящемуся в четвертом положении. НАД способен переносить ионы водорода в дыхательную цепь митохондрий, где они окисляются с образованием АТФ.
НАДФ отличается по строению тем, что к второму углеродному атому радикала рибозы АМФ присоединяется остаток фосфорной кислоты. Является коферментом дегидрогеназ пентозного цикла, откуда ионы водорода поставляются в реакции биосинтеза различных веществ.
Флавиновые коферменты– производные витамина В2.
К ним относя флавинмононуклеотидд (ФМН) и флавинадениединуклеотид (ФАД). Первый из них входит в состав дыхательной цепи митохондрий. Он принимает ионы водорода и электроны от НАД-Н2и передает их убихинону.
ФАД состоит из остатков АМФ и ФМН. Является коферментом дегидрогеназ, отщепляющих ионы водорода от янтарной кислоты и активированных жирных кислот. Ионы водорода присоединяются к атомам азота изоалаксозинового цикла и переносятся в дыхательную цепь митохондрий.
Тиаминовые коферменты– производные витамина В1. К ним относя тиаминдифосфат (ТДФ). Входит в состав транскетолазы пентозного цикла, а также ферментов отщепляющих углекислый газ от пировиноградной и альфа-кетоглутаровой кислот.
Пиридоксальфосфат (ПФ) – производное витамина В6. Входит в состав ферментов обмена аминокислот – декарбоксилаз, трансамназ.
Пантотеновые коферменты– производные витамина В3. К ним относят коэнзим А (КоА), входящий в состав ферментов, переносящих остатки уксусной, янтарной или жирных кислот.
Фолатные коферменты -производные витамина Вс (фолиевой кислоты).
Участвуют в переносе метильных, альдегидных и других одноуглеродных фрагментов
Невитаминными коферментамимогут быть гем (у каталазы, цитохромов и др. ферментов), ионы металлов (у глутатионпероксидазы, супероксиддисмутазы, амилазы и
