
контрольная 8 вариант
.pdf
Вариант 8 Часть 1
Дано:
T1 285 K1 60 c T2 298 K2 30 c
Ea ?
?
№ 103.
Решение:
Для решения задачи используем правило Вант -Гоффа:
v |
v |
|
T2 T1 |
10 |
|||
T2 |
T1 |
|
|
Скорости реакции при различных температурах равны:
v |
|
C1 |
v |
|
C2 |
, |
||
|
|
|||||||
T1 |
|
|
1 |
T2 |
|
|
2 |
|
|
|
|
|
|
|
|
||
где С1 и С2 - концентрации реагирующих веществ; C1 C2 , т.к. начальные концентрации равны, откуда:
vT1 1 vT2 2
v298 1 60 2 v285 2 30
Подставив данные, получим:
|
298 285 |
|
v298 |
|
|||
|
10 |
|
1,3 |
|
2 |
||
|
v285 |
||||||
|
|
|
|
|
|
|
|
|
1,3 |
2 |
1,7 |
|
|
|
|
Значение энергии активации найдем из уравнения Аррениуса:
E |
A |
|
T2 |
T1 |
lg |
vT2 |
2,3 R |
298 285 |
lg2 2,3 8,314 |
|
T |
T |
v |
|
|||||||
|
|
|
|
|
298 285 |
|||||
|
|
2 |
1 |
|
T1 |
|
|
|
|
|
37606 |
Дж/ моль 37,6 |
кДж/ моль |
||||||||
Ответ: 1,7
EA 37,6 кДж/ моль
Численное значение γ зависит от природы реагирующих веществ.
Численное значение Ea зависит от природы реагирующих веществ и присутствия катализатора.
Физический смысл γ: величина γ показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10°.
Физический смысл Ea: величина Ea соответствует минимальной энергии, которую необходимо сообщить частицам для их эффективного взаимодействия.
№ 133.
СКР СO2 Г 2СO Г Q
Всоответствии с принципом Ле Шателье, при оказании на систему, находящуюся в состоянии равновесия, внешнего воздействия равновесие в системе смещается в сторону противоположную оказанному воздействию.
1) При повышении температуры равновесие в данной системе смещается в сторону
еепоглощения (эндотермической реакции), т.е. в сторону прямой реакции (вправо). Это приведет к увеличению концентрации СО, являющегося продуктом реакции.
2) При повышении давления равновесие в данной системе смещается в сторону уменьшения числа молей газообразных продуктов реакции, т.е. в сторону обратной реакции (влево). Это приведет к уменьшению концентрации СО.
Численное значение Kp зависит только от природы веществ и температуры, но не зависит от концентраций или парциальных давлений. Это значит, значение Kp изменится в

первом случае (при увеличении температуры). Так как процесс эндотермический, то значение Kp увеличится.
№153.
Вметодичке неверный ответ!!!
Дано:
СН (HCl) 1 Н
СН (KOH) 0,2 H
V(р ра KOH) 10 мл
V(р ра HCl) ?
Решение:
KOH HCl KCl H2O
Рассчитаем объем раствора HCl, исходя из соотношения:
СН (KOH) V(р ра KOH) СН (HCl) V(р ра HCl)
V(р ра HCl) СН (KOH) V(р ра KOH) 0,2 10 2 мл СН (HCl) 1
Ответ: V(р ра HCl) 2 мл
№ 183.
Дано:
СН (H2SO4 ) 0,5 н
(H2SO4 ) 90%
H ?
SO42 ?
NH ?
NSO42 ?
Решение:
Уравнение диссоциации серной кислоты:
H2SO4 2H SO42
С |
М |
(H |
SO ) |
СН (H2SO4) |
|
|
0,5 |
0,25 м |
|
|
|
|
|
||||||||
|
|
2 4 |
z |
2 |
|
|
|
|||
|
|
|
|
|
образуется 2 иона H+ и 1 |
|||||
При диссоциации 1 молекулы H2SO4 |
||||||||||
иона SO42-, т.е. концентрация ионов |
SO42- равна молярной |
|||||||||
концентрации |
H2SO4, а концентрация ионов |
H+ больше |
||||||||
концентрации |
H2SO4 в |
2 раза, |
т.е. равна |
нормальной |
||||||
концентрации H2SO4. С учетом степени диссоциации:
H СН (H2SO4 ) 0,5 0,9 0,45 моль/ лSO42 СМ (H2SO4 ) 0,25 0,9 0,225 моль/ л
Рассчитаем количество ионов H+:
NH H NA 0,45 6,02 1023 2,709 1023 ионов/ л
Рассчитаем количество ионов SO42-:
NSO42 SO42 NA 0,225 6,02 1023 1,3545 1023 ионов/ л
Ответ:
H 0,45 моль/ л
SO42 0,225 моль/ л
NH 2,709 1023 ионов/ л
NSO42 1,3545 1023 ионов/ л

|
|
|
|
№ 218. |
|
|
|
|
|
|||
Дано: |
Решение: |
|
|
|
|
|
|
|
||||
pH(р ра NH4OH) 11,13 |
Уравнение диссоциации NH4OH: |
|
|
|
||||||||
|
NH4OH NH4 OH |
|
|
|
|
|
||||||
СМ (NH4OH) ? |
|
|
|
|
|
|||||||
Выражение для константы диссоциации NH4OH: |
||||||||||||
|
||||||||||||
|
КД NH4OH |
NH4 OH |
|
|
|
|
||||||
|
|
|
|
|
|
NH4OH |
|
|
|
|
|
|
|
Выражение для расчета рН раствора NH4OH: |
|||||||||||
|
pH(р ра NH |
OH) 14 |
1 |
pK |
О |
(NH |
OH) |
|||||
|
1 |
|
|
4 |
|
2 |
|
4 |
, |
|||
|
lgC |
|
(NH |
OH) |
|
|
|
|
||||
|
M |
|
|
|
|
|
||||||
|
2 |
|
4 |
|
|
|
|
|
|
|
||
|
откуда |
|
|
|
|
|
|
|
|
|
||
lgCM (NH4OH) 28 2 pH(р ра NH4OH)
pKО (NH4OH) 28 2 11,13 4,74 1
CM (NH4OH) 10 1 0,1 М
Ответ: CM (NH4OH) 0,1 М
№ 243.
Так как соль - это продукт нейтрализации кислоты основанием, то реакция образования Na2PO4 выразится уравнениями:
3NaOH H3PO4 Na3PO4 3H2O молекулярная форма
OH H H2O краткая ионная форма
Являясь хорошо растворимой солью, Na2PO4 диссоциирует полностью (α = 1):
K2SO3 2K SO32
Гидролиз идет по трехзарядному аниону PO43-. В соответствии с условием задачи запишем в полной молекулярной и краткой ионной формах уравнения гидролиза но первой стадии:
Na3PO4 H2O Na2 HPO4 NaOH молекулярная форма
PO43 H2O HPO42 OH краткая ионная форма
Появляющиеся в результате гидролиза ионы ОН- изменяют характер среды на щелочной, т. е. рН > 7.
Запишем уравнение гидролиза по второй стадии:
Na2 HPO4 H2O NaH2 PO4 NaOH молекулярная форма
HPO42 H2O H2PO4 OH краткая ионная форма
и по третьей стадии:
NaH2PO4 H2O H3PO4 NaOH молекулярная форма
H2PO4 H2O H3PO4 OH краткая ионная форма
Гидролиз солей по трехзарядному аниону PO43- по второй и третьей стадии практически не протекает вследствие избытка ионов ОН-.

Дано: |
|
Решение: |
|
|
|||
nЭ Na3PO4 0,02 |
моль |
Уравнение гидролиза но первой стадии: |
|
||||
V р ра Na3PO4 |
1 л |
Na3 PO4 H2O Na2 HPO4 NaOH |
|
||||
|
М р ра Na3PO4 |
nЭ Na3PO4 |
|
||||
рН ? |
|
С |
|
||||
|
V р ра Na3PO4 NNa zNa |
||||||
|
|
|
|
0,02 |
0,0067 М |
|
|
|
|
|
|
|
|
||
|
|
|
1 3 1 |
|
|
||
Численное значение рН зависит от концентрации ионов OН-, которая, в свою очередь, зависит от степени гидролиза (h) по первой стадии:
|
|
|
|
|
|
|
|
|
10 14 |
|
|
|
|
СОН |
СМ |
h1 |
KГ 1 СМ |
|
|
|
СМ |
||||||
KД 3 H3PO4 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
10 14 |
|
0,0067 0,007моль/ л |
|
|
|
||||||
|
|
12 |
|
|
|
||||||||
|
1,3 10 |
|
|
|
|
|
|
|
|
||||
Найдем значение рОН:
pOH lgOH lg0,007 2,14
Найдем значение рН:
pH 14 pOH 14 2,14 11,86
Ответ: pH 11,86
№ 258.
2KI Pb 4O2 4HNO3 Pb 2 NO3 2 I20 2KNO3 2H2O
2I 2e I20 |
|
|
2 |
1 |
1 |
|
|
|
|
||||||
Pb 4 2e Pb 2 |
2 |
1 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||
I окисляется восстановитель |
|
|
|
|
|||||||||||
Pb 4 |
восстанавливается окислитель |
|
|
|
|||||||||||
KCl 5O 3Mn 4O |
2 |
|
6KOH 3K |
Mn |
6O KCl 3H |
O |
|||||||||
|
3 |
|
|
2 |
|
4 |
2 |
|
|||||||
Mn 4 2e Mn 6 |
|
2 |
|
|
6 |
|
3 |
|
|
|
|
||||
|
|
|
|
|
|
|
|||||||||
Cl 5 6e Pb 2 |
|
|
|
6 |
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
Mn 4 |
окисляется восстановитель |
|
|
|
|||||||||||
Cl 5 |
восстанавливается окислитель |
|
|
|
|||||||||||
Вариант 8 Часть 2
№ 6.
Дано:
НH0 |
2S(Г ) |
20,6 кДж/ моль |
||
НО0 |
|
0 кДж/ моль |
||
|
2(Г ) |
|
|
|
НH0 |
O |
241,81 кДж/ моль |
||
|
|
2 (Г) |
|
|
НSO0 |
296,9 кДж/ моль |
|||
|
|
2(Г) |
|
|
CP0 |
H2S(Г ) |
33,44 |
Дж/ моль K |
|
CP0 |
О |
29,37 |
Дж/ моль K |
|
|
2(Г ) |
|
|
|
CP0 |
H |
O |
33,61 |
Дж/ моль K |
|
2 |
(Г ) |
|
|
CP0 |
SO |
2(Г ) |
39,87 |
Дж/ моль K |
|
|
|
|
|
T 1000 K
CP0 T
H10000 ?
Решение:
H2S(Г) 32О2(Г) H2O(Г) SO2(Г)
Используя следствие из закона Гесса и справочные данные, рассчитаем тепловой эффект при 298 К, а также изменение теплоемкости:
H2980 |
n' HОБР0 |
.КОН. |
n'' HОБР0 |
.ИСХ. |
||||||||||||||
H2980 |
( НH0 |
O |
( |
Г) |
НSO0 |
) |
|
|
||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
2(Г ) |
|
|
|
|||
( НH0 |
2 |
S |
3 |
2 |
НО0 |
|
) |
|
|
|
||||||||
|
|
|
|
(Г) |
|
|
|
|
2(Г) |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
( 241,81 ( 296,9)) (( 20,6) 3 |
0) |
|||||||||||||||||
491,11 кДж |
|
|
|
|
|
|
|
|
2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
CP0 |
298 |
n' CP0 |
КОН. n'' CP0 |
ИСХ. |
|
|||||||||||||
CP0 |
298 |
(CP0 |
H |
O |
CP0 |
SO |
|
) |
|
|
||||||||
|
|
|
|
|
|
|
|
2 |
|
(Г ) |
|
|
|
2(Г ) |
|
|
|
|
(C0 |
|
|
|
|
3 |
|
C0 |
|
) |
|
|
|
|
|||||
|
P H2S(Г ) |
|
2 |
|
|
P О2(Г ) |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
33,61 39,87 (33,44 |
3 |
29,37) 4,015 Дж/ K |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
Используя уравнение Кирхгофа, рассчитаем тепловой эффект при 1000 К:
H10000 |
H |
2980 CP0 |
298 (1000 298) |
|
491110 |
4,015 (1000 298)) 493929 |
Дж 494 кДж |
||
Тепловой эффект при при 2500 К можно вычислить, только
предположив, чтоCP0 |
T в интервале от 1000˚С до2500˚С: |
|||
H25000 |
H2980 CP0 |
298 (2500 298) |
|
|
491110 4,015 (2000 298)) 497943 |
Дж 498 кДж |
|||
Ответ: H10000 |
494 кДж |
|
||
|
№ 36. |
|
|
|
Дано: m СО2 22 г
P1 105 Па P2 106 Па
T 1000 K
S1000 ?
Решение:
Изменение энтропии для изотермического сжатия:
S0 |
Rln |
P |
|
|
10 |
5 |
|
|
Дж/ моль К |
||||
1 |
8,314 ln |
|
|
|
19,14 |
||||||||
|
|
|
|
||||||||||
1000 |
|
|
P |
|
|
10 |
6 |
|
|
|
|||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
Рассчитаем химическое количество СО2: |
|||||||||||||
n CO2 |
|
m CO2 |
|
22 |
0,5 |
|
моль |
|
|||||
M CO2 |
|
44 |
|
|
|||||||||
Пересчитаем изменение энтропии для полученного химического количества СО2:
S1000 |
S10000 |
n CO2 19,14 0,5 9,57 Дж/К |
Ответ: S1000 9,57 Дж/ К

Дано:
H2980 SO2(Г) 296,9 кДж/ моль
H2980 О2(Г) 0 кДж/ моль
H2980 SO3(Г) 395,85 кДж/ моль
S2980 |
SO2(Г) 248,07 |
|
Дж/ моль K |
||||
S2980 |
О2(Г) 205,04 |
Дж/ моль K |
|||||
S0 |
|
SO |
256,69 |
|
Дж/ моль K |
||
298 |
|
3(Г) |
|
39,87 |
|
||
C0 |
|
|
SO |
Г) |
Дж/ моль K |
||
P 298 |
2( |
|
|
|
|||
CP0 |
298 |
О2(Г) 29,37 |
|
Дж/ моль K |
|||
C0 |
|
|
SO |
Г) |
50,09 |
Дж/ моль K |
|
P 298 |
3( |
|
|
|
|||
T 798 K
Направление-?
№ 42.
Решение:
2SО2 Г О2(Г) 2SО3(Г)
Направление протекания реакции определяется изменением свободной энергии Гиббса (ΔG). Используя следствие из закона Гесса и справочные данные, рассчитаем тепловой эффект при 298 К, а также изменение энтропии и теплоемкости:
H2980 n' HОБР0 .КОН. n'' HОБР0 .ИСХ.
H2980 2 H2980 (SО3(Г) )
(2 H2980 (SО2 Г ) H2980 (О2(Г) ))
2 ( 395,85) (2 ( 296,9) 0)
197,9 кДж 197900 Дж
S2980 n' SОБР0 .КОН. n'' SОБР0 .ИСХ.
S2980 2 S2980 (SО3(Г) )
(2 |
S2980 (SО2 Г ) S2980 (О2(Г) )) |
2 256,69 |
(2 |
248,07 205,04) 187,8 |
Дж/ К |
CP0 298 n' CP0 КОН. n'' CP0 ИСХ.
СP0 298 2 СP0 298 (SО3(Г) )
(2 СP0 298 (SО2 Г ) СP0 298 (О2(Г) )) 2 50,09
(2 39,87 29,37) 8,93 Дж/ К
Рассчитаем изменение энтальпии и энтропии реакции при заданной температуре:
H7980 H2980 CP0 298 (T 298)
197900 ( 8,93) (798 298) 202365 Дж
S7980 |
S2980 |
CP0 |
298 |
ln |
Т |
|
|
|
|||||||
|
|
|
|
298 |
|
||
187,8 ( 8,93) ln2,6779 196,6 Дж/К
Изменение свободной энергии Гиббса (ΔG) равно:
G7980 Н7980 Т S7980 202365
(798 ( 196,6)) 45478 Дж 45,478 кДж
Так как энергия Гиббса при Т=798 К принимает отрицательное значение, реакция при этой температуре идет слева направо, т.е. в сторону образования продуктов реакции (прямая реакция).
Ответ: реакция при этой температуре идет слева направо.
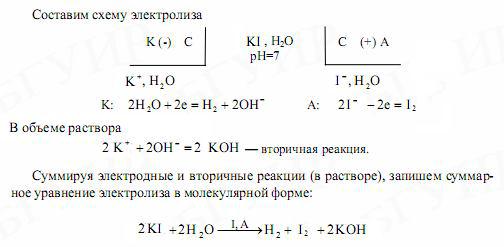
№ 88.
Cd FeSO4 CdSO4 Fe
Схема элемента: Cd |Cd2 || Fe2 | Fe
Катодный процесс:K :Fe2 2e- Fe0 Анодный процесс:A :Cd0 2e- Cd2
Суммарно:Fe2 Cd0 Fe0 Cd2
ЭДС равна::
80 мВ 0,08 В по условию задачи
Электродные потенциалы равны:
|
К |
0 |
2 |
/ Fe |
0,440 |
В |
|
|
|||||||||||||
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
||||
А |
Cd2 /Cd |
К 0,440 0,08 0,52 |
|||||||||||||||||||
|
|
2 |
|
|
0 |
2 |
|
|
|
0,059 |
lg Cd2 , |
||||||||||
Cd |
/Cd |
/ |
|
|
|
||||||||||||||||
|
|
|
|
|
|
Cd |
|
Cd |
|
|
2 |
|
|
||||||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
0,059 |
lg Cd |
2 |
|
|
2 |
|
|
0 2 |
0,52 0,403 0,117 В |
|||||||||||
|
|
Cd |
/Cd |
||||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Cd |
/Cd |
|||||
|
|
|
|
|
|
|
2 0,117 |
|
|
|
|
|
|||||||||
lg Cd2 |
|
3,966 |
|
||||||||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
0,059 |
|
|
|
|
|
|
|
|
|||
Cd2 10 3,966 |
|
1 10 4 моль/ л |
|
||||||||||||||||||
Найдем КР: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
lgK |
P |
|
n |
|
|
2 0,08 |
2,7 |
|
|||||||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
0,059 |
|
0,059 |
|
|
|
|
||||||||||
|
KP 102,7 |
|
515 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ 117. |

Дано:
ВТ 80%
V(H2 ) 5,6 л
Q ?
mПР(I2 ) ?
Решение:
По уравнению, объединяющему 1-й и 2-й законы Фарадея с учетом выхода по току:
Q |
V H2 |
F |
5,6 96500 |
|
А с 150 |
А ч |
|||||||
|
|
|
|
|
|
|
|
|
540400 |
||||
V H |
2 |
В |
11,2 0,8 |
||||||||||
|
Э |
Т |
|
|
|
|
|
|
|
|
|||
На катоде окисляется иод: |
|
|
|
|
|||||||||
mПР (I2 ) |
Q mЭ I2 ВТ |
|
540400 127 0,8 |
569 г |
|||||||||
|
|
||||||||||||
|
|
|
|
|
F |
|
|
|
|
96500 |
|
|
|
Ответ: Q 150 |
А ч |
|
|
|
|
||||||||
mПР (I2 ) 569 г
№ 133.
При катодной защите оборудование подключается к отрицательному полюсу внешнего источника тока, а вспомогательный электрод - к положительному. При этом создается электролизная система, в которой защищаемая конструкция служит катодом, а на положительном вспомогательном электроде - аноде - идут процессы окисления: самого анода (электрод растворимый) или восстановителя окружающей среды (электрод инертный).
Пример катодной защиты железного изделия: Катодная защита:
В качестве электрода можно использовать графитовый стержень, либо отходы железа:
с графитовым стержнем:
К ( ) Fe| H2O,O2 |C ( ) А
Анодный процесс:
2H2O 4e О2 4H
Катодный процесс:
O2 2H2O 4e 4ОН Суммарно:
2H2O O2 2H2O O2 4H2O
с железными отходами:
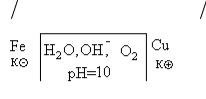
К ( ) Fe| H2O,O2 | Fe(ОТХ ) ( ) А
Анодный процесс:
Fe 2e Fe2
Катодный процесс:
O2 2H2O 4e 4ОН Суммарно:
2Fe O2 2H2O 2Fe(ОН)2
Катодным называют покрытие, металл которого менее активный, чем металл изделия. В случае повреждения катодного покрытия коррозия металлического изделия усиливается, так как изделие является анодом и окисляется (корродирует).
Пример - катодное покрытие на железном изделии:
В качестве протектора можно использовать любой металл, активность которого
значительно |
меньше |
активности |
железа, |
например, |
медь |
( |
Е2980 (Fe0 Fe2 ) 0,44 В, Е2980 |
(Cu0 Cu2 ) |
0,337 В: |
|
|
|
|
А ( ) Fe| H2O,O2 |Cu ( ) K
Анодный процесс:
Fe 2e Fe2
Катодный процесс:
O2 2H2O 4e 4ОН Суммарно:
2Fe O2 2H2O 2Fe(ОН)2
№ 157.
Основной процесс:
А ( ) Ni | NiSO4 ,H | Me( ) K
Анодный процесс:
Ni 2e Ni2
Катодный процесс:
Ni2 2e Ni
В качестве катода применяются твердые металлы, либо ртуть и амальгамы. Побочные процессы:
Более активные, чем никель, металлы не осаждаются на катоде, а накапливаются в электролите, откуда периодически удаляются:
А ( ) Zn| NiSO4 ,H | ( ) K
Анодный процесс:
Zn 2e Zn2
Катодный процесс:
Ni2 2e Ni
А ( ) Fe | NiSO4 ,H | ( ) K
Анодный процесс:
Fe 2e Fe2
Катодный процесс:
Ni2 2e Ni
А ( ) Pb | NiSO4 ,H | ( ) K
Анодный процесс :
Pb 2e Pb2
Катодный процесс :
Ni2 2e Ni
Медь выпадает в виде анодного шлама.
№168.
Кметаллам относятся: все s-элементы, кроме H и He; p-элементы III группы, кроме B; IV группы, кроме C и Si; в V группе - Sb и Bi; в VI группе - Po; все d-элементы (т.е. все элементы B-подгрупп); все f-элементы (т.е. лантаноиды и актиноиды).
По сравнению с неметаллами металлы имеют особенности электронного строения: - небольшое число электронов на внешней электронной оболочке (1,2,3, реже -
4,5,6);
- большое число свободных орбиталей на внешней электронной оболочке; - больший размер радиуса атома.
Валентные электроны непрочно связаны с ядром, поэтому атомы металлов легко отдают электроны и являются хорошими восстановителями.
Все эти особенности обуславливают возникновение металлической связи. Природу химической связи и характерные особенности металлов можно объяснить
на примере лития следующим образом. В кристалле металла число электронов значительно меньше числа орбиталей. Поэтому электроны могут переходить из одной орбитали в другую. Тем самым электроны принимают участие в образовании связи между всеми атомами кристалла металла. К тому же атомы металлов характеризуются невысокой энергией ионизации - валентные электроны слабо удерживаются в атоме, т.е. легко перемещаются по всему кристаллу. Возможность перемещения электронов по кристаллу определяет электрическую проводимость металла.
Таким образом, в отличие от ковалентных и ионных соединений в металлах небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле. Иначе говоря, в металлах имеет место сильно делокализованная химическая связь. Таким образом, металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронным газом).
Кристаллические решетки металлов могут быть различных типов. Однако для большинства металлов характерны три типа решеток: объемноцентрированная кубическая (Li, Nа, К, V, Сr, Fe, Рb, W и др.), гранецентрированная кубическая (Аl, Ca, Fe в интервале температур от 911 до 1392˚С, Ni, Сu, Ag, Аu и др.), гексагональная (Be, Мg, Сd, Ti, Со, Zn
идр.).
В конструкционной технике находит применение большинство выпускаемых промышленностью марок стали. Стали составляют основной объём конструкционных материалов, используемых техникой.
Чугуны широко применяются в машиностроении для изготовления станин, коленчатых валов, зубчатых колёс, цилиндров двигателей внутреннего сгорания, деталей, работающих при температуре до 1200 °С в окислительных средах, и др.
