
Белорусский государственный университет информатики и радиоэлектроники
КОНТРОЛЬНАЯ РАБОТА №1
по дисциплине: Химия
Вариант №5
Выполнил: студент
1 курса заочного факультета
Минск 2010 г.
Выполнение заданий:
9. На нейтрализацию 2,45 г кислоты идет 2,0 г гидроксида натрия. Определите эквивалентную массу кислоты и запишите ее формулу, если кислота двухосновная. Какое ее количество потребуется на окисление 46 г натрия?
Решение:
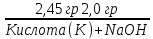
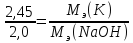
Э(NaOH)
=
 = 1
= 1
Мэ = 23 + 1 + 16 = 40
Мэ
=
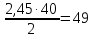
Исходя из полученных данных, нашему условию удовлетворяет двухосновная кислота Н2SO4
Э(Н2SO4)
=

Мэ(Н2SO4) = ½ * (2+16*4+32) = 49
Исходя
из уравнения
 ,
получаем
,
получаем
Мэ(Na)
= 1*23 = 23,
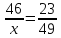 ;
х =
;
х =
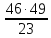 = 98 гр.
= 98 гр.
Ответ: Мэ(К) = 49, ее формула Н2SO4, для окисления 46 грамм потребуется 98 грамм кислоты.
42. Какие значения могут принимать квантовые числа n, 1, ml и ms, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома германия?
Решение:
n = от 1 до бесконечности;
l = от 0 до (n - 1);
ml = от –l через 0 до +l;
ms = -1/2 и +1/2.
Ge – порядковый номер 32, 4s2p2, следовательно:
n = 4
l = 0, 1, 2, 3;
ml = -1, 0, +1
ms= -1/2 и +1/2.
Ответ: - решение
55. Охарактеризуйте d-элементы периодической таблицы. С какого периода и почему начинается формирование d-элементов? Чем обусловлена близость их свойств и название "переходные металлы "?
Ответы:
К d-элементам относят те элементы, атомы которых содержат валентные электроны на (n – 1)d ns-уровнях и составляют побочные (IIIВ–VIIВ, IВ, IIВ) подгруппы, занимая промежуточное положение между типичными s-металлами (IА, IIА) и p-элементами. Из 109 элементов периодической системы 37 относятся к d-элементам; из них последние 7 радиоактивны и входят в незавершенный седьмой период. Электронное строение атомов d-элементов определяет их химические свойства. 3d-Элементы по химическим свойствам существенно отличаются от 4d- и 5d-элементов. При этом элементы IVВ–VIIВ подгрупп очень схожи по многим химическим свойствам. Это сходство обусловлено лантаноидным сжатием , которое из-за монотонного уменьшения радиусов при заполнении 4f-орбиталей приводит к практическому совпадению радиусов циркония и гафния, ниобия и тантала, молибдена и вольфрама, технеция и рения. Элементы этих пар очень близки по физическим и особенно по химическим свойствам; первые шесть элементов встречаются в одних рудных месторождениях, трудно разделяются; их иногда называют элементами-близнецами.
Атомы d-элементов характеризуются общей электронной формулой (n – 1)d 1–10ns 0–2. Некоторые из тяжелых d-элементов не являются полными электронными аналогами. Увеличение числа электронов иногда сопровождается немонотонностью заселения d-орбиталей. Это обусловлено сближением энергий (n – 1)d- и ns-орбиталей и усилением межэлектронного взаимодействия к концу периода.
По мере увеличения числа d-электронов в периоде они могут переходить с одного уровня на другой для достижения требуемой правилами Гунда одной из наиболее устойчивых конфигураций (d 5, d 10). Такие переходы реализуются, например, в случае Cr(3d 54s 1), Cu(3d 104s 1), Mo(4d 55s 1), Ag(4d 105s 1). Обращает на себя внимание тот факт, что в одной подгруппе существуют элементы с разными электронными конфигурациями, например: V(3d 34s 2), Nb(4d 45s 1) и Ta(5d 36s 2); Ni(3d 84s 2), Pd(4d 105s 0) и Pt(5d 96s 1).
Подгруппы, в которых расположены s- и p-элементы, называют главными, а подгруппы с d-элементами - побочными подгруппами. главные и побочные подгруппы иногда обозначают соответственно буквами "А" и "Б", или "А" и "В", или "а" и "б".
Элементы побочных подгрупп (d-элементы) называют ПЕРЕХОДНЫМИ элементами или переходными металлами (все d-элементы - металлы).
Термин “переходные металлы” возник вследствие того, что все d-элементы в периодах (строчках таблицы) служат как бы “переходным мостиком” от металлических s-элементов к p-элементам, среди которых уже много неметаллов. Иногда термин “переходные металлы” применяют и к f-элементам, о которых мы расскажем в следующем параграфе.
Поскольку в периодах (горизонтальных строчках Периодической таблицы) имеется всего по 2 s-элемента и по 6 p-элементов (в сумме 8), а d-элементов по определению должно быть больше (10 в каждом периоде), возникла масса неудобств в оформлении таблицы. Например, в VIII группе вместе с инертными газами (главная подгруппа) пришлось расположить не по одному, а по 3 элемента побочной подгруппы в каждой строчке!
Разумеется, ярко выраженные металлы - железо (Fe), кобальт (Co), никель (Ni) и другие элементы этой побочной подгруппы ничего общего не имеют с элементами главной группы: гелием, неоном, аргоном и другими инертными газами.
Электронное строение и химические свойства элементов главных и побочных подгрупп могут не иметь ничего общего.
96. Что называется электрическим моментом диполя и длиной диполя? В каких единицах они измеряются? Определите длину диполя молекулы NF3, если μ(NF3) = 0,2 D.
