
- •Лекция 13 азотсодержащие соединения
- •1. Нитросоединения
- •1.1. Классификация, номенклатура, изомерия.
- •1.2. Способы получения.
- •1.3. Физические свойства и строение.
- •1.4. Химические свойства
- •1.4.1. Образование солей (реакция со щелочами)
- •1.4.2. Реакция с карбонильными соединениями
- •1.4.3. Реакция с азотистой кислотой
- •1.4.4. Восстановление нитросоединений
- •2. Амины
- •2.1. Классификация, номенклатура, изомерия.
- •2.2. Способы получения
- •2.2.3. Гипогалогенитная реакция Гофмана
- •2.2.4. Восстановление оксимов и нитрилов
- •2.4. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Кислотно-основные свойства.
- •2.4.2. Амины как нуклеофилы
- •2.4.3. Электрофильное замещение в ароматических аминах.
- •2.4.4. Реакции аминов с азотистой кислотой.
- •3. Диазо- и азосоединения
- •1. Реакции, протекающие с выделением азота;
- •3.1. Реакции, протекающие с выделением азота;
- •3.2. Реакции, протекающие без выделения азота
1.4.1. Образование солей (реакция со щелочами)
Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Т.е. проявляют свойства сопряженных С-Н кислот, что объясняется устойчивостью образующегося аниона:

Если щелочной раствор нитросоединения обработать минеральной кислотой, то происходит образование аци-формы нитросоединения, которая изомеризуется в обычную форму. Поэтому нитросоединения относятся к псевдокислотам.
1.4.2. Реакция с карбонильными соединениями
Первичные и вторичные нитросоединения в присуствии щелочей нуклеофильно присоединяются по карбонильной группе альдегидов. При этом образуются нитроспирты:

Таким образом в нитрометане можно заместить три атома водорода с образованием три-(гидроксиметил)нитрометана О2N-С(СН2ОН)3.
Кислотность нитросоединений очень высокая. Поэтому в случае ароматических альдегидов гидроксипроизводное соединение выделить не удается. Реакция завершается на стадии ненасыщенного нитросоединения:

1.4.3. Реакция с азотистой кислотой
Первичные и вторичные нитросоединения реагируют с азотистой кислотой НNO2. В водном растворе азотистая кислота может распадаться следующим образом:
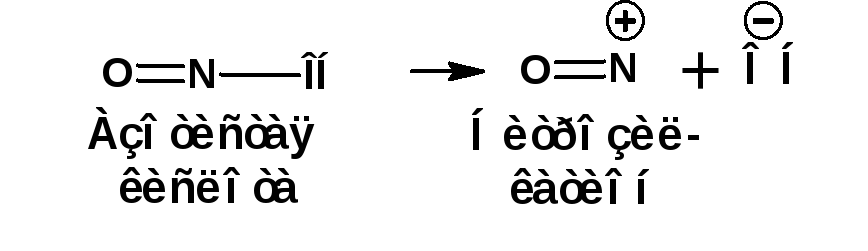
Образующийся ион гидроксила отщепляет протон от α-углеродного атома и образующийся анион присоединяется к атому азота нитрозил-катиона:

Из первичных нитросоединений образуются нитроловые кислоты. Вторичные нитросоединения образуют псевдонитролы.
Третичные нитросоединения не имеет атома водорода у α-углеродного атома. Поэтому не способны вступать реакции по типу альдольно-кротоновой конденсации.
1.4.4. Восстановление нитросоединений
Основной реакцией, характеризующей свойства нитросоединений, является реакция восстановления нитрогруппы до амино-группы. Реакция может протекать в кислой и щелочной средах. В качестве восстановителей могут быть использованы: железо или цинк в соляной кислоте, двухлористое олово в соляной кислоте, водород на катализаторах гидрирования, электрохимическое восстановление, сульфидом аммония. Классическая реакция Зинина – восстановления нитробензола осуществлена полисульфидом амммония (NH4)2Sn.
Механизм реакции восстановления нитробензола в кислой и нейтральной среде:

Механизм восстановления в щелочной среде:

2. Амины
Производные аммиака, в которых атомы водорода замещены углеводородными группами, называются аминами.
2.1. Классификация, номенклатура, изомерия.
Изомерия аминов определяется положением аминогруппы в углеродной цепи, количеством углеводородных групп и их строением.
В зависимости от количества углеводородных групп, с которыми связана аминогруппы, различают первичные, вторичные и третичные амины.
По числу аминогрупп в молекуле амина различают моно- ди- три- и полиамины.
В зависимости от природы углеводородного радикала, с которым соединена аминогруппа различают амины алифатические, ароматические и алкилароматические.
Действуют три номенклатуры. Тривиальные названия, например, анилин, толуидин, анизидин. Название по рациональной номенклатуре строятся как производное аммика, добавкой суффикса «амин» к названию углеводородного радикала. По систематической номенклатуре, цифрой указывается положение аминогруппы и к названию углеводорода добавляется суффикс «амин». Если амин вторичный или третичный, то положение наименьших радикалов обозначается буквами «N», например, N,N-диметилпропанамин-2. В иерархии заместителей аминогруппа следует за нитрогруппой перед алкильными радикалами обозначается префиксом «амино». Например:


В систематической номенклатуре сохраняется тривиальное название «анилин».
